
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поперечнополосатая и косоисчерченная мышечные ткани
Характеристика и классификация По принципу организации мышечные ткани этого типа в свою очередь могут быть подразделены на 3 группы. 1). Ткани, образованные системой мышечных и эпителиально-мышечных клеток. Они образованы обычно мышечными клетками, объединёнными между собой межклеточными структурами в пучки или пласты, то есть в известной степени они устроены аналогично гладкомышечным тканям. Такие ткани образуют лишь единичные мышцы в тех органах, где нужны быстрые и правильно организованные движения. Они изучены менее подробно, чем другие типы «полосатых» мышечных тканей. Однако широкое распространение саркомерной организации миофибрилл в разных систематических группах животных вновь свидетельствует о многократном и независимом их происхождении в филогенезе. 2). Мышечные ткани, образованные поперечнополосатыми симпластическими волокнами. 3). Косоисчерченные мышечные ткани. Ткани двух последних групп рассматриваются ниже. Наиболее сложно устроенными являются ткани второго типа, которые составляют основу соматической мускулатуры позвоночных животных. Поперечнополосатая мышечная ткань позвоночных Общая характеристика (Приложение, рис. 20) Поперечнополосатая мышечная ткань имеется у животных самых разнообразных систематических групп. Её с труктурной единицей является поперечно-полосатое мышечное волокно (мион), являющееся симпластом (результатом слияния клеток-предшественников – миобластов). По этой причине в волокнах этой ткани могут насчитываться сотни ядер. Поперечно-полосатое мышечное волокно имеет форму цилиндра со слегка заострёнными концами. Его длина может составлять до 12 см. Термином «оболочка волокна» (сарколемма) обозначается комплекс двух структур: плазмолеммы симпласта и его базальной мембраны. Между плазмолеммой и базальной мембраной расположены клетки-сателлиты (см. ниже). В саркоплазме (то есть внутри волокна) расположены миофибриллы, саркоплазматическая сеть, митохондрии, включения (гранулы гликогена). Каждая миофибрилла окружена регулярно повторяющимися элементами саркоплазматического ретикулума – аностомозирующими мембранными трубочками, заканчивающимися терминальными цистернами. На границе между тёмными и светлыми дисками две смежные терминальные цистерны контактируют с Т-трубочками, образуя так называемые триады, формирующие Т-систему (рис. 16).
Саркоплазматическая сеть (ретикулум) – модифицированная гладкая эндоплазматическая сеть, выполняющая функцию депо кальция. Внутри этой сети находится Са2+-связывающий белок (кальсеквестрин). В момент сокращения мышечного волокна ионы кальция через каналы выбрасываются из депо в саркоплазму. При расслаблении мышечного волокна ионы кальция откачиваются из саркоплазмы Са2+-транспортирующими АТФазами саркоплазматического ретикулума (см. ниже). Между отдельными мышечными волокнами располагаются прослойки рыхлой волокнистой соединительной ткани (эндомизий), которые содержат кровеносные и лимфатические сосуды, нервные волокна. Группы мышечных волокон и окружающая их в виде чехла волокнистая соединительная ткань (перимизий) формируют пучки. Их совокупность образует мышцу, которая в свою очередь одета в плотный соединительнотканный чехол – эпимизий. Поперечная исчерченность скелетного мышечного волокна (рис. 16) обусловлена регулярным чередованием в миофибриллах участков (дисков), различно преломляющих поляризованный свет – светлых изотропных (I-диски) и тёмных анизотропных (А-диски). Разное светопреломление дисков обусловлено упорядоченным расположением по длине саркомера тонких и толстых нитей (см. ниже).
Рис. 16. Часть поперечнополосатого мышечного волокна млекопитающего (по А. Хэму, Д. Кормаку, 1983): 1 – Т-трубочка; 2 – терминальные цистерны саркоплазматического ретикулума (по Хэм А, Кормак Д., 1983). Каждый светлый диск пересекает Z-линия. Участок миофибриллы между соседними Z-линиями называется саркомером, который и является структурно-функцианальной единицей миофибриллы. Механизм сокращения Способность мышечного волокна к сокращению обусловлена его ультраструктурой (рис. 17). I-диск содержит только тонкие нити. Один конец такой нити прикреплён к Z–линии (рис. 16, 17), а другой – направлен к середине саркомера.
Рис. 17. Ультраструктура саркомера (по W. Ronald., 1990). Толстые нити занимают центральную часть саркомера; их совокупность морфологически и обуславливает то, что называют А-диском. Тонкие нити лишь частично входят между толстыми. Следовательно, в саркомере имеется участок, содержащий только толстые нити – так называемая Н-зона. В середине Н-зоны проходит М-линия (мезофрагма) (рис. 16).
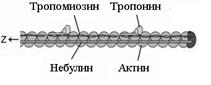
Таким образом, I-диск входит в состав двух саркомеров; то есть каждый саркомер содержит один А-диск (тёмный) и две половины I-дисков (светлых). Толстая нить образована несколькими белками. Прежде всего, каждая миозиновая нить состоит из 300-400 молекул миозина, а также С-белка. Половина молекул миозина обращена головками (см. ниже) к одному концу нити, а вторая – к другому. Свободные концы толстых нитей с Z-линией связывает титин. Миозин. В молекуле миозина различают тяжёлый и лёгкий меромиозин. Тяжёлый имеет два субфрагмента (S): S1 образован глобулярными головками миозина, S2 – эластичным компонентом. Лёгкий меромиозин образует концевую часть хвостовой нити миозина длиной 100 нм. Молекула миозина имеет два шарнирных участка, позволяющих ей изменять конформацию («сгибаться»). Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой – в области шейки молекулы миозина (S1-S2 соединение); при этом лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность. Титин (Tn) – наибольших размеров полипептид, входящий в состав толстых нитей: его молекулярная масса около 300 кД. Он работает наподобие «молекулярной пружины», обеспечивая структурную целостность миофибрилл во время сокращения. Один конец молекулы проникает в Z-линию и через С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, он обеспечивает одинаковый диаметр и стандартную длину толстых нитей. Тонкая нить также образована рядом белков - актином, тропомиозином и тропонином. Актин. Молекулы глобулярного актина (G-актин) полимеризуются и образуют фибриллярный актин (F-актин). Уложенные друг за другом молекулы F-актина в тонкой нити формируют две спирально закрученные цепочки. Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются «конец в конец» в желобке между описанными выше цепочками F-актина. Тропонин – комплекс, образованный тремя глобулярными молекулами. Препятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина, и потому он располагается с интервалами 40 нм. Небулин – фибриллярный белок, ассоциированный с тонкими нитями. Сокращение Сокращение мышечного волокна (рис. 18) происходит при поступлении возбуждения по аксонам двигательных нейронов к нервно-мышечным синапсам в виде нервных импульсов (потенциал действия нервных волокон). Это - непрямое сокращение (оно опосредовано нервно-мышечной синаптической передачей). Прямое же сокращение (например, мышечные подёргивания, или фибрилляции) – патология.
Сокращение мышечного волокна происходит при взаимодействии толстых и тонких нитей. В покое взаимодействие тонких и толстых нитей невозможно, так как миозинсвязывающие участки молекул актина заблокированы тропомиозином. При поступлении импульса (как уже отмечалось) из Т-системы по каналам саркоплазматической сети в сарколемму поступают ионы кальция. При высокой их концентрации эти ионы связываются с комплексом TnC и вызывают конформационные изменения тропомиозина. Это, в свою очередь, приводит к разблокированию миозинсвязывающих участков молекул актина, благодаря чему головки миозина начинают поочерёдно присоединяться к молекулам актина тонкой нити и изменяют свою конформацию. Таким образом, создаётся тянущее усилие, и тонкие нити начинают скользить между толстыми. При этом головка миозина совершает около 5 циклов в секунду; когда одни головки миозина толстой нити производят тянущие усилия, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом «гребковые» движения (молекула миозина сгибается) стягивают тонкие нити к центру саркомера. Таким образом, скользящие тонкие нити тянут за собой Z-линии, вызывая укорочение саркомера. В процесс сокращения практически одновременно вовлечены все саркомеры мышечного волокна, за счёт чего и происходит его укорочение (сокращение).
Рис. 18. Механизм сокращения мышечного волокна (по W. Ronald, 1990). Расслабление Как уже указывалось выше, Са После смерти организма, когда содержание АТФ в мышечных волокнах снижается вследствие прекращения её синтеза, головки миозина оказываются устойчиво прикреплёнными к тонкой нити. Это состояние трупного окоченения продолжается до тех пор, пока не начнётся разрушение волокон.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.119.148 (0.013 с.) |

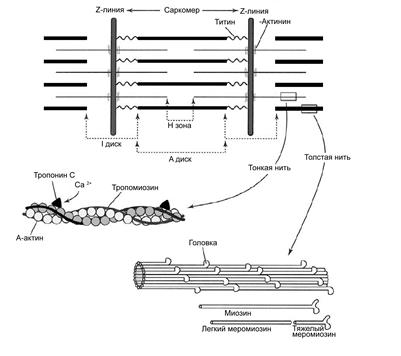
 -актинин связывается с молекулой титина соседнего саркомера. Другой конец молекулы приближается к М-линии и при помощи миомезина прикрепляется к свободному концу молекулы титина второй половины саркомера. В I-диске титин ассоциирован с тонкими нитями, а в А-диске белок связывается с толстыми нитями. Таким образом, контактируя в области Z-линии, молекулы титина образуют непрерывную цепь.
-актинин связывается с молекулой титина соседнего саркомера. Другой конец молекулы приближается к М-линии и при помощи миомезина прикрепляется к свободному концу молекулы титина второй половины саркомера. В I-диске титин ассоциирован с тонкими нитями, а в А-диске белок связывается с толстыми нитями. Таким образом, контактируя в области Z-линии, молекулы титина образуют непрерывную цепь.
 -АТФаза саркоплазматической сети закачивает ионы кальция из саркоплазмы в цистерны ретикулума, где они связываются кальсевестрином. При понижении концентрации ионов кальция до определённого уровня Са
-АТФаза саркоплазматической сети закачивает ионы кальция из саркоплазмы в цистерны ретикулума, где они связываются кальсевестрином. При понижении концентрации ионов кальция до определённого уровня Са 


