Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Промышленный способ получения серной кислоты: научные принципы данного химического производства. Защита окружающей среды от химических загрязнений. ⇐ ПредыдущаяСтр 7 из 7
Сырьём для производства серной кислоты могут служить минералы, содержащие серу: самородная сера S, серный колчедан FeS2 и другие. 1. Первая стадия – получение оксида серы (IV) SO2: S+O2→ SO2 4FeS2+ 11O2→2Fe2O3+8SO2 +Q (обжиг серного колчедана – пирита) Для ускорения процесса используется чистый кислород, для увеличения поверхности соприкосновения веществ пирит измельчают и реакцию проводят в «кипящем слое». 2. Вторая стадия – окисление SO2 в SO3: 2SO2+O2 эта реакция обратимая, чтобы увеличить скорость реакции, вводят катализатор оксид ванадия V2O5 и повышают давление. SO3 + H2O Если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную серную кислоту. Экологические проблемы: загрязнение атмосферы оксидами серы и пылью. Во избежание этого герметизируют аппаратуру, создают специальные фильтры.
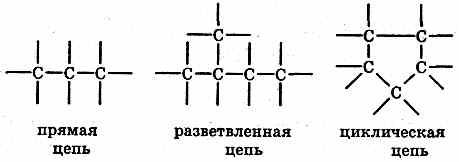
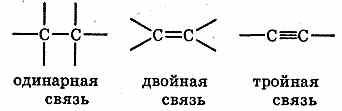
Причина многообразия неорганических и органических веществ; взаимосвязь веществ. 1.Многообразие неорганических веществ. а) Химические элементы образуют как простые, так и сложные вещества. Для многих простых веществ известны их аллотропные формы существования: углерод — в форме графита и алмаза, фосфор белый и красный и т.д. В настоящее время известно около 400 аллотропных видоизменений простых веществ. 2. Многообразие органических веществ. Органических веществ в настоящее время известно более 15 миллионов, в то время как неорганических веществ насчитывается несколько сотен тысяч. Многообразие органических веществ объясняется следующим:
|
|||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 2957; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.115.120 (0.004 с.) |
 2SO3
2SO3  H2SO4.
H2SO4.