
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ідеальний газ. Рівняння Менделєєва-Клапейрона. Ізопроцеси в газахСтр 1 из 5Следующая ⇒
Ідеальний газ – це теооретична модель газа, в якій не враховується взаємодія частинок газу (середня кінетична енергія частинок набагато більша енергії взаємодії). В ідеальному газі молекули, в більшості випадків, вважаються матеріальними точками, які мають тільки кінетичну енергію. Тому внутрішня енергія ідеального газу, тобто енергія всіх частинок, з яких складається даний газ, представляється як сума їх кінетичних енергій. В реальному газі внутрішня енергія складається з кінетичної і потенціальної енергій молекул. Розрізняють класичний і квантовий ідеальний газ – їх поведінка описується різними статистиками. Нами розглядається тут класичний ідеальний газ, що описується статистикою Максвелла-Больцмана. Стан системи (сукупності тіл) виражається в загальному вигляді як:
Стан класичного ідеального газу описує рівняння Менделєєва-Клапейрона:
де p - тиск, V - об’єм, m - маса газу, m - молекулярна маса газу, R - універсальна газова стала (R =8,31 Дж/моль×К)). Т - температура в К. Кількість речовини n - це фізична величина, що дорівнює числу структурних елементів, які складають систему.
Один моль – відповідно кількість речовини, в якій знаходиться стільки ж молекул, скільки їх в 0,012 кг ізотопу 6С12. Це – стала Авогадро. NA»6.02×1023 1/моль. Перехід системи з одного рівноважного стану в інший називається процесом. В залежності від умов протікання розрізняють: р = const - ізобарний процес; T = const - ізотермічний процес; V = const - ізохорний процес. Процес, що відбувається без обміну енєргією з зовнішнім середовищем, називається адіабатним. Оскільки
(див. рівняння стану ідеального газу)
де k - стала Больцмана (k»1,38×10-23 Дж/К), то:
де n - концентрація молекул
Задача: На рис. 31 показано ізотерми для двох різних газів, що мають однакову температуру і масу. Визначити, яка ізотерма відповідає газу, що має меншу молярну масу m.
Розв’язок:
1) Розглянемо на різних ізотермах два стани – А і В, яким відповідає однаковий об’єм V¢ і запишемо рівняння Менделєєва-Клапейрона для цих станів: а) б) 2) Розділивши почленно рівняння (а) на (б), отримаємо:
3) Поскільки p 1 < p 2, то m 2 < m 1. Значить, ізотерма 2 відповідає газу, що має меншу молярну масу.
Ізотерма виражається формулою
Значить, чим більше ця константа, тим дальше від початку координат pV вона розташована. А її величина має різні значення при різних m, m, Т.
Основне рівняння МКТ
Це рівняння зв’язує макро- і мікропараметри газу, тобто тиск і середню енергію молекул, або температуру і середню енергію молекул. Розглянемо дію молекул, що знаходяться всередині куба, на його стінку. За другим законом Ньютона: 1) 2) Кількість молекул, що передають свій імпульс стінці площею DS за час Dt при ударі:
3) Зміна імпульсу однієї молекули:
4) Зміна імпульсу N молекул:
5) Із 2-ї та 4-ї формул:
Оскільки: 6) 7) Після підстановки отримаємо: 8) 9)
зв’язок між середньою кінетичною енергією молекули і температурою. Температура є мірою середньої кінетичної енергії молекул речовини і характеризує ступінь нагрітості тіла. Якщо молекули складаються з декількох атомів, їх середня енергія враховує не лише поступальний рух, але і обертовий та (в деяких випадках) коливний рух молекул.
|
||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.19.251 (0.006 с.) |
 .
.
 Кіломоль – це кількість речовини, в якій знаходиться стільки ж молекул, скільки їх в 12 кг ізотопу
Кіломоль – це кількість речовини, в якій знаходиться стільки ж молекул, скільки їх в 12 кг ізотопу  .
. ,
,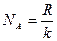

 ,
, .
.
 ,
, .
. .
. .
.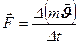 ;
; .
. .
. .
. .
. ;
;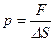 .
. ;
; .
. - основне рівняння МКТ.
- основне рівняння МКТ. - рівняння стану ідеального газу.
- рівняння стану ідеального газу.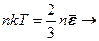
 -
-


