
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связь между абсолютной температурой и кинетической энергией поступательного движения молекул
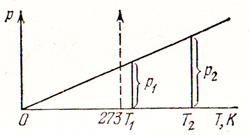
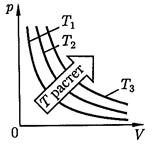
На рисунке 4 приведен закон Шарля в координатах давление р – абсолютная температура Т.
Из подобия треугольников следует: Между давлением p и его абсолютной температурой Т существует прямая пропорциональная зависимость (рисунок 4). Но и между давлением p и средне-кинетической энергией поступательного движения молекул
где Среднее значение кинетической энергии поступательного движения молекул не зависит от рода газа, а определяется только его абсолютной температурой.
 в основное уравнение молекулярно-кинетической теории, получим: в основное уравнение молекулярно-кинетической теории, получим:
. Давление газа не зависит от рода газа, а определяется только концентрацией молекул no и абсолютной температурой газа Т. Поскольку для данной температуры средние значения энергии поступательного движения молекул различных газов одинаковы, можно записать: При одинаковой температуре средние квадратические скорости молекул обратно пропорциональны корням квадратным из масс молекул. Контрольные вопросы: 1. Расскажите об опыте по определению зависимости давления газа от температуры и результатах этого опыта. 2. Изложите закон Шарля. Что такое температурный коэффициент давления? 3. Как температура газа связана с кинетической энергией молекул? 4. Как давление газа связано с его абсолютной температурой?
Уравнение Клапейрона - Менделеева. Закон Дальтона За единицу количества вещества в системе СИ принят 1 моль. Строго говоря, 1 моль – это количество вещества системы, содержащей столько же элементов (молекул, атомов, ионов и т.п.), сколько содержится атомов в массе 0,012 кг изотопа углерода Вместе с тем, при решении задач удобнее применять следующее определение моля: молем (грамм - молекулой) называется количество вещества, масса которого в граммах равна его относительной молекулярной массе. Моль газа обладает двумя свойствами:
2. 1 моль любого газа при нормальных условиях занимает объём 22,4 дм3.
Нормальными условиями являются: температура Давление газа:
При постоянной массе газа число молекул газа N неизменно, поэтому Д.И. Менделеев объединил уравнение Клапейрона с законом Авогадро, применив молярный объем газов
Общее число молекул газа где g - число молей в массе газа m. Число молей газа g также равно массе всего газа
 . Отсюда: . Отсюда:   - -
- уравнение Клапейрона - Менделеева. Уравнение Клапейрона-Менделеева определяет соотношение давления, объёма и абсолютной температуры любой массы любого идеального газа. Плотность газа:
Закон Дальтона: если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, то эта смесь газов оказывает на стенки сосуда давление, равное сумме давлений, производимых каждым газом в отдельности, если бы он один занимал весь сосуд.
Число Лошмидта – это число молекул, содержащихся в 1 м3 любого газа при нормальных условиях
Контрольные вопросы:
1. Что такое моль газа? Какими свойствами он обладает? 2. Изложите уравнение Клапейрона-Менделеева. Какие параметры газа оно связывает? 3. Изложите закон Дальтона. 4. По какой формуле можно вычислить плотность газа? 5. Что такое число Лошмидта?
Изопроцессы и их графики Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами (от греческого "изос" - равный, одинаковый). Для определенной массы газа:
 , ,
тогда Давление газа прямо пропорционально его абсолютной температуре. Закон Шарля (рисунок 4). Линии на графике называются изохорами. Изобарический (изобарный) процесс - процесс в газе, который происходит при постоянной массе и неизменном давлении (от греческого "барос" - тяжесть.)
Изотермический процесс – процесс в газе, который происходит при постоянной массе и неизменной температуре. Т=const, тогда:
 . Отсюда: . Отсюда:  , или: , или:
давление газа обратно пропорционально его объёму - закон Бойля-Мариотта (рисунок 6), из которого следует, что:
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 803; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.86.155 (0.011 с.) |
 от абсолютной температуры T.
от абсолютной температуры T.
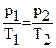
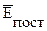 тоже существует прямая пропорциональная зависимость. Это означает, что энергия
тоже существует прямая пропорциональная зависимость. Это означает, что энергия  прямо пропорциональна абсолютной температуре газа T.
прямо пропорциональна абсолютной температуре газа T.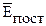
 ,
,
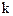 - постоянная Больцмана.
- постоянная Больцмана. 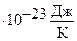 ..
..


 .
.

 (закон Авогадро).
(закон Авогадро). 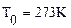 (t = 0°С) и давление
(t = 0°С) и давление 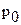 =105 Па.
=105 Па.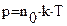 ;
; 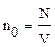 , где N - число молекул в объеме
, где N - число молекул в объеме 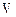 .
.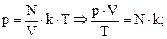
 - постоянная Больцмана.
- постоянная Больцмана. - уравнение Клапейрона, в котором B – газовая постоянная величина, различная для разных газов.
- уравнение Клапейрона, в котором B – газовая постоянная величина, различная для разных газов. , который одинаков для различных газов (при постоянных значениях p и Т):
, который одинаков для различных газов (при постоянных значениях p и Т): , где:
, где:  - универсальная газовая постоянная.
- универсальная газовая постоянная.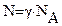 ,
,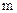 , деленной на массу 1 моля газа
, деленной на массу 1 моля газа 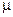 :
: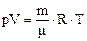
 .
.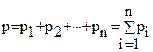 , где
, где  – парциальное давление.
– парциальное давление. :
: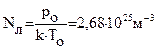
 =
=  Поскольку газ имеет три основных параметра: давление p, объем V и абсолютная температура T, то соответственно существуют и три изопроцесса.
Поскольку газ имеет три основных параметра: давление p, объем V и абсолютная температура T, то соответственно существуют и три изопроцесса.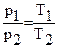
 , или
, или 
 ,
, 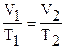 или Объем газа прямо пропорционален его абсолютной температуре. Закон Гей-Люссака ( рисунок 5 ).
или Объем газа прямо пропорционален его абсолютной температуре. Закон Гей-Люссака ( рисунок 5 ).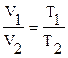


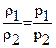 , где
, где  плотность газа.
плотность газа.


