
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатные состояния вещества и фазовые переходы
Агрегатные состояния вещества – это состояния одного и того же вещества (например: воды, железа, серы и т.д.) переходы между которыми сопровождаются скачкообразными изменениями плотности и других основных физических свойств. Агрегатными состояниями одного и того же вещества являются: газ, жидкость и твердое тело. Иногда к агрегатным состояниям причисляют еще и плазму. В современной физике вместо понятия агрегатное состояние пользуются более широким понятием фаза. Область, в которой вещество однородно по всем физическим и химическим свойствам, называется фазой состояния этого вещества Фазовый переход (фазовое превращение) – скачкообразное изменение физических свойств при непрерывном изменении внешних параметров (температуры, давления и т.д.). Значение температуры, давления или других внешних параметров при котором происходит фазовый переход, называется точкой перехода. Свойства паров. Влажность воздуха. Парообразование Переход вещества из жидкого состояния в газообразное состояние называется парообразованием. Переход вещества из газообразного состояние в жидкое – конденсацией. Парообразование, которое происходит только со свободной поверхности жидкости, граничащей с газом или вакуумом, называется испарением. Для превращения жидкости в пар нужно увеличить внутреннюю энергию молекул жидкости. Это осуществляется подведением теплоты. Теплота парообразования: Опыт показывает, что уровень жидкости в герметически закрытом сосуде со временем не меняется. Это означает, что в таком сосуде испарение компенсируется конденсацией пара. Число молекул, вылетевших из жидкости, равно числу молекул вернувшихся в жидкость. Такое равновесие называется динамическим. Пар, который находится в состоянии динамического равновесия со своей жидкостью, называется насыщающим паром. Законы для идеального газа к насыщающим парам неприемлемы. К не насыщающему пару можно применить законы для идеального газа лишь в тех случаях, когда пар далек от насыщения. Влажность воздуха. Точка росы. Способы определения влажности С поверхностей океанов, морей, озер и рек непрерывно происходит испарение воды. Поэтому в атмосфере Земли всегда есть водяной пар. В течение года испаряется около 4×1014 тонн воды, и ¼ этой воды выпадает потом на сушу.
Величина, характеризующая содержание водяных паров в атмосфере Земли, называется влажностью воздуха. Следует различать абсолютную и относительную влажность воздуха. Абсолютная влажность воздуха измеряется плотностью водяного пара В науке и технике более важно знать степень влажности воздуха, которая оценивается относительной влажностью воздуха B. Относительная влажность воздуха измеряется числом, показывающим, сколько процентов составляет абсолютная влажность воздуха Значения Температура, при которой воздух в процессе своего охлаждения становится насыщенным водяным паром, называется точкой росы. Пример:
  = 0,0094 кг/м3 при 210С = 0,0094 кг/м3 при 210С
Если температура воздуха упадет до 100С, а Для превращения пара в жидкость нужны центры конденсации. Ими могут быть пылинки и отдельные ионы. Чистый от пыли воздух может охладиться ниже точки росы, а находившийся в нем пар конденсироваться не будет. Такой пар называется пересыщенным. Приборы для определения влажности воздуха 1.
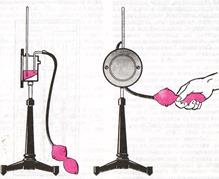
2. Психрометр (от греческого “психриа” – холод) содержит два одинаковых термометра (Рисунок 23). Шарик одного – сухой, а другой – влажный. За счет испарения влаги влажный термометр показывает меньшую температуру, чем сухой. По показаниям 2-х термометров с помощью таблиц определяют относительную влажность воздуха.
Контрольные вопросы: 1. Что такое агрегатное состояние вещества, и какие агрегатные состояния вещества Вам известны? 2. Что такое фазовый переход? 3. Что такое парообразование, конденсация и испарение? 4. Что такое насыщающий пар? 5. Как вычислить теплоту парообразования? 6. Что такое влажность воздуха? 7. Расскажите об абсолютной и относительной влажности воздуха. 8. Какие Вы знаете приборы для определения влажности воздуха и как ими пользоваться? Кипение. Вторым видом порообразования является кипение. Парообразование, которое происходит в объеме всей жидкости и при постоянной температуре, называется кипением. Температурой кипения жидкости называется такая температура, при которой давление насыщающих паров этой жидкости равно внешнему давлению на ее поверхности. При уменьшении внешнего давления температура кипения понижается, а при увеличении давления – повышается. Температура кипения жидкости при нормальном атмосферном давлении (1,013 ×105 Если из жидкости удалить растворенный в ней газ (например, продолжительным кипячением), то можно нагреть эту жидкость выше температуры ее кипения. Такую жидкость называют перегретой. Уравнение теплового баланса при парообразовании и конденсации. Выясним, какое количество теплоты

Теплоту Теплоту Таким образом, Контрольные вопросы: 1. Что такое кипение и температура кипения? 2. Как зависит температура кипения от давления и концентрации растворенного в жидкости вещества? 3. Как составить уравнение теплового баланса при парообразовании и конденсации? 4. Что такое перегретая жидкость?
Характеристика жидкого состояния вещества.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 3510; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.162.87 (0.018 с.) |
 , где m – масса жидкости, r – удельная теплота парообразования, зависящая от температуры.
, где m – масса жидкости, r – удельная теплота парообразования, зависящая от температуры. , находящегося в воздухе, или его давлением
, находящегося в воздухе, или его давлением  .
. , насыщающего воздух при имеющейся у него температуре.
, насыщающего воздух при имеющейся у него температуре. 
 и
и 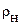 при данной температуре можно найти в справочнике.
при данной температуре можно найти в справочнике.

 =const, то т.к. при 100С
=const, то т.к. при 100С  =100 C является точкой росы.
=100 C является точкой росы.
 ) называется точкой кипения. Температура кипения раствора всегда выше, чем температура кипения растворителя и увеличивается с возрастанием концентрации раствора.
) называется точкой кипения. Температура кипения раствора всегда выше, чем температура кипения растворителя и увеличивается с возрастанием концентрации раствора.
 должна получить жидкость, находящаяся при температуре
должна получить жидкость, находящаяся при температуре 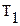 , для превращения в пар с помощью кипения (рисунок 24).
, для превращения в пар с помощью кипения (рисунок 24). , нужную для нагревания жидкости до температуры кипения, можно найти по формуле:
, нужную для нагревания жидкости до температуры кипения, можно найти по формуле: 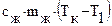 , где:
, где: 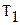 – исходная температура жидкости,
– исходная температура жидкости, 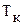 – температура кипения,
– температура кипения,  – масса жидкости,
– масса жидкости,  – удельная теплоемкость жидкости.
– удельная теплоемкость жидкости. , необходимую для превращения жидкости в пар при температуре кипения, можно рассчитать по формуле:
, необходимую для превращения жидкости в пар при температуре кипения, можно рассчитать по формуле:  =
=  , где r – удельная теплота парообразования.
, где r – удельная теплота парообразования.


