
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория электролиза. Прикладное значение процессов электролиза. Закон Фарадея ⇐ ПредыдущаяСтр 6 из 6
2. Какая степень окисления для свинца наиболее устойчива при 298 К в системе: PbO2(к) + Pb(к) = 2PbO(к). Ответ мотивировать термодинамическим расчётом.
Уравнение реакции: PbO2(к) + Pb(к) = 2PbO(к) Вычислим изменение энергии Гиббса. DG0 = 2DG0(PbO) – DG0(PbO2) = 2 × (–189,1) – (–218,3) = –159,9 кДж. DG0 реакции отрицательна, реакция идет в прямом направлении. Значит, степень окисления свинца +2 термодинамически более устойчива.
3. При сгорании 4,3 г углеводорода
При сгорании углеводорода водород переходит полностью в воду, углерод — в CO2. Обозначим органическое вещество – CxHy. Запишем уравнение реакции. CxHy + (x + y/4)O2 = xCO2 + y/2H2O Молярная масса CxHy = 12x + y, г/моль Молярная масса CO2 = 44x, г/моль. Молярная масса H2O = 9y, г/моль. Составляем уравнение: 4,3 × 44x = 13,2 × (12x + y); 189,2x = 158,4x + 13,2y 30,8x = 13,2y y = 2,333x Попробуем найти целочисленные коэффициенты. 2y = 4,667x 3y = 7x Простейшая формула вещества C3H7. M(C3H7) = 43 г/моль. Найдем молярную массу углеводорода. M = D(H2) × M(H2) = 43 × 2 = 86 г/моль, т. е. в 2 раза больше простейшей формулы. Таким образом, формула вещества C6H14. Экзаменационный билет №19 Электрохимическая коррозия металлов. Метод защиты.
2. Определите изменение внутренней энергии при испарении 32 г метанола при температуре кипения 65,70С, если удельная теплота испарения равна 1,104 кДж/г При испарении происходит увеличение потенциальной энергии взаимодействия молекул испарившейся части жидкости, т. е. изменение внутренней энергии. DU = Q = rисп × m, где DU — изменение внутренней энергии при испарении, Q — теплота испарения, rисп — удельная теплота испарения, m — масса вещества. DU = 1,104 · 32 = 35,33 кДж. На каком основании хром и сера расположены в одной периодической системы? Почему они размещены в разных подгруппах? Сколько вакантных 3d–орбиталей содержат возбужденные атомы этих элементов? Хром и сера содержат по 6 валентных электронов, поэтому расположены в 6 группе. S: 1s2 2s22p6 3s23p4 Cr: 1s2 2s22p6 3s23p63d5 4s1 В то же время у серы заполняется p-подуровень внешнего слоя, а у хрома — d-подуровень предвнешнего слоя. Поэтому они расположены в разных подгруппах. S*: 1s2 2s22p6 3s23p33d1
Возбужденный атом серы имеет 4 вакантные d-орбитали. Cr*: 1s2 2s22p6 3s23p63d5 4s1 Возбужденный атом хрома не имеет вакантных d-орбиталей. Экзаменационный билет №20 1. Характеристика свойств
2. При взаимодействии метана и сероводорода образуется CS2(г) и H2(г). Вычислите изменение энтальпии и энтропии процесса в стандартных условиях. Определите ориентировочную температуру начала процесса Уравнение реакции: CH4(г) + 2H2S(г) = CS2(г) + 4H2(г) Найдем DH0 по следствию из закона Гесса. DH0 = DH0(CS2, г) – DH0(CH4, г) – 2DH0(H2S, г) DH0(CS2, г) = 88,7 кДж/моль DH0(CH4, г) = –74,85 кДж/моль DH0(H2S, г) = –21,0 кДж/моль DH0 = 88,7 – (–74,85) – 2 · (–21,0) = 205,55 кДж Найдем DS0. DS0 = S0(CS2, г) + 4S0(H2, г) – S0(CH4, г) – 2S0(H2S, г) S0(CS2, г) = 151,0 Дж/моль×К S0(H2, г) = 130,52 кДж/моль S0(CH4, г) = 186,19 кДж/моль S0(H2S, г) = 205,7 кДж/моль DS0 = 151,0 + 4 · 130,52 – 186,19 – 2 · 205,7 = 75,49 Дж/К. DG0 = DH0 – TDS0 В состоянии равновесия DG0 = 0. DH0 = TDS0 T = DH0 / DS0 = 205,55 / 0,07549 = 2722,9 К. Ориентировочная температура начала реакции 2723 К. 3. Энергия активации реакции O3(г) + NO(г) ® O2(г) + NO2(г) равна 10 кДж/моль. Каково значение температурного коэффициента процесса в интервале температур 300…310 К? Процесс подчиняется правилу Вант – Гоффа Уравнение реакции: O3(г) + NO(г) ® O2(г) + NO2(г) Энергия активации связана с константами скорости процесса при двух температурах:
По условию T1 = 300 К; T2 = 310 К
Известно, что отношение скоростей (и констант скоростей) при двух температурах связано с температурным коэффициентом скорости g:
Вычисляем g.
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 246; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.231.155 (0.007 с.) |
 образовалось 13,2 г CO2. Плотность пара углеводорода по водороду равна 43. Выведите молекулярную формулу вещества.
образовалось 13,2 г CO2. Плотность пара углеводорода по водороду равна 43. Выведите молекулярную формулу вещества.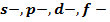 элементов и их соединений: комплексообразующих, кислотно-основных, окислительно-восстановительных
элементов и их соединений: комплексообразующих, кислотно-основных, окислительно-восстановительных
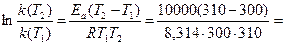 0,1293
0,1293 1,1381.
1,1381.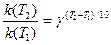
 1,1381.
1,1381.


