
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции, влияние концентрационного фактора на скорость. Кинетическое уравнение процесса.
2. Какие металлы (Fe, Ag, Ca) будут разрушаться в атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ обоснуйте термодинамическим расчётом. Разрушение металлов в атмосфере влажного воздуха, насыщенного диоксидом углерода, может идти по схеме: Fe + H2O + CO2 = FeCO3 + H2 Рассчитаем DG0 процесса. DG0 = DG0(FeCO3) – DG0(H2O, ж) – DG0(CO2) = = –665,1 – (–237,24) – (–394,88) = –32,98 кДж. DG0 < 0, разрушение железа по данной схеме возможно. 2Ag + H2O + CO2 = Ag2CO3 + H2 Рассчитаем DG0 процесса. DG0 = DG0(Ag2CO3) – DG0(H2O, ж) – DG0(CO2) = = –437,2 – (–237,24) – (–394,88) = 194,92 кДж. DG0 > 0, разрушение серебра по данной схеме невозможно. Ca + H2O + CO2 = CaCO3 + H2 Рассчитаем DG0 процесса. DG0 = DG0(CaCO3) – DG0(H2O, ж) – DG0(CO2) = = –1127,7 – (–237,24) – (–394,88) = –495,58 кДж. DG0 < 0, разрушение кальция по данной схеме возможно. 3. Медь покрыта оловом. При нарушении покрытия возникает гальванический элемент: Схема гальванического элемента:
Анодный процесс: Sn0 – 2e– ® Sn2+ Катодный процесс: 2H+ + 2e– ® H2 Запишем значения стандартных окислительно-восстановительных потенциалов. E0(Cu2+/Cu) = +0,345 В E0(Sn2+/Sn) = –0,136 В Согласно законам Фарадея, масса (объем) вещества, выделяющегося на электроде, равна: m = M × I × t / (n × F), или V = VM × I × t / (n × F) где n – число передаваемых в полуреакции электронов, M – молярная масса, VM – молярный объем, F – число Фарадея, I – сила тока (А), t – время электролиза (с). Вычисляем массу олова, окисленного на аноде: m(Sn) = M(Sn) · I × t / (n × F) = = 118,71 · 7,5 · 25 · 60 / (2 · 96487) = 6,92 г. Вычисляем объем водорода, выделившегося на катоде. V(H2) = VM(H2) · I × t / (n × F) = = 22,4 · 7,5 · 25 · 60 / (2 · 96487) = 1,31 л. Экзаменационный билет №9 Температурная зависимость скорости процесса. Правило Вант-Гоффа, уравнение Аррениуса, энергия активации. Катализ.
2. Чему равно значение pH раствора CH3COOH, в 1 литре которого содержится 6 г кислоты, а Kд = 1,8·10–5 CH3COOH — слабая кислота, частично диссоциирующая в растворе: CH3COOH D CH3COO– + H+ Для слабых кислот [H+] = Вычислим молярную концентрацию кислоты. c = Вычисляем концентрацию ионов водорода. [H+] = pH = –lg [H+] = –lg 1,34·10–3 = 2,87. За 10 минут из раствора нитрата платины ток силой 5 А выделил 1,517 г Pt. Определите эквивалентную массу платины. Какой газ и в каком количестве при этом выделяется на аноде, приведите схему электролиза и процессы
Согласно законам Фарадея, масса (объем) вещества, выделяющегося на электроде, равна: m = MЭ × I × t / F, или V = VЭ × I × t / F MЭ – молярная масса эквивалента, VЭ – молярный объем эквивалента, F – число Фарадея, I – сила тока (А), t – время электролиза (с). По условию m = 1,517 г; I = 5 A; t = 10 · 60 = 600 с. Вычисляем молярную массу эквивалента платины. MЭ = m · F / (I · t) = 1,517 · 96487 / (5 · 600) = 48,79 г/моль. Молярная масса платины 195,1 г/моль. Значит, валентность платины в нитрате равна 195,1 / 48,79 = 4. Катодный процесс: Pt4+ + 4e– ® Pt0. Нитрат-ионы на аноде не разряжаются. Вместо них окисляются молекулы воды: 2H2O – 4e– ® O2 + 4H+ Вычисляем объем кислорода, учитывая, что молярный объем эквивалента кислорода равен 5,6 л/моль. V(O2) = 5,6 · 5 · 600 / 96487 = 0,174 л. Схема электролиза: Pt(NO3)4 + 2H2O = Pt + O2 + 4HNO3 Экзаменационный билет №10
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 276; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.190.101 (0.005 с.) |
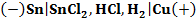 , который даёт ток силой
, который даёт ток силой  . Какая масса олова окисляется и сколько литров
. Какая масса олова окисляется и сколько литров  выделяется на катоде за 25 минут?
выделяется на катоде за 25 минут?
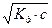 .
.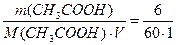 = 0,1 моль/л.
= 0,1 моль/л. = 1,34·10–3 моль/л.
= 1,34·10–3 моль/л.


