
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация комплексных соединений.
Константа нестойкости В водных растворах комплексные соединения диссоциируют в две стадии. Первая стадия протекает по типу сильных электролитов, т.е. идет процесс полной диссоциации на внутреннюю и внешнюю сферу: K[Ag(CN)2] = K+ + [Ag(CN)2]- По второй стадии комплексный ион диссоциирует как слабый электролит обратимо, ступенчато и для каждой ступени есть своя ступенчатая константа: [Ag(CN)2]- Û [AgCN] + CN- К1 [AgCN] ÛAg+ + CN- К2 Суммарный процесс диссоциации комплексного иона можно представить схемой: [Ag(CN)2]- Û Ag+ + 2CN- Кн К равновесному процессу диссоциации комплексного иона применим закон действующих масс. Общая константа диссоциации комплексного иона запишется:
Практически пользуются общей константой, называемой константой нестойкости Кн, которая равна произведению промежуточных ступенчатых констант диссоциации комплексного иона Кн = К1×К2. Константой нестойкости называется отношение произведения концентраций продуктов диссоциации комплексного иона в соответствующих степенях к равновесной концентрации неионизированных комплексных ионов. Причем чем меньше константа нестойкости, тем прочнее комплексный ион. Величина, обратная константе нестойкости, называется константой устойчивости, или константой образования, Куст. = 1/Кн. Значения констант нестойкости комплексных ионов и их показатели даются в справочниках (см. список рекомендуемой литературы), некоторые приведены в табл. IV. Показатель константы нестойкости равен десятичному логарифму константы, взятому с обратным знаком: рКн = -lgКн Следует обратить внимание, что сравнивать прочность комплексов по величинам констант нестойкости можно только для однотипных комплексных ионов, т.е. дающих при диссоциации одинаковое число ионов. Например: а) [Ag(NH3)2]+, Кн = 5,8×10-8, рКн = 7,24 [Ag(CN)2]-, Кн = 1,4×10-20, рКн = 19,85, т.к. константа нестойкости цианида намного меньше, чем аммиаката, то можно говорить о его большей прочности: б) [Cu(NH3)4]2+, Кн = 9,3×10-13, рКн = 12,03; [Zn(NH3)4]2+, Кн = 2,0×10-9, рКн = 8,70. Из двух аммиаков прочнее комплексный ион меди, т.к. его константа нестойкости меньше. Зная величины констант нестойкости можно рассчитать концентрации ионов, входящих в состав внутренней сферы, судить о возможном направлении реакции при открытии ионов, о выборе реагентов для разрушения комплексных ионов.
Решение типовых задач Задача 1. Вычислить равновесную концентрацию иона меди Cu2+ и степень диссоциации комплексного иона в 0,01 М растворе [Cu(NH3)4]SO4, Кн = 9,3×10-13. Решение. Запишем уравнение диссоциации комплексного иона: [Cu(NH3)4]2+ Û Cu2+ + 4NH3 Обозначим равновесную концентрацию иона меди [Cu2+] = х моль/л, тогда равновесные концентрации остальных частиц равны [NH3] = 4x моль/л, [Cu(NH3)
256х5 = 9,3×10-14;
получаем [Cu2+] = 8,2×10-4 моль/л.
Задача 2. В каком из 0,1 молярных растворов комплексных солей дицианоаргентата (1) калия и хлорида диамминсеребра (1) концентрация ионов серебра больше и во сколько раз? Решение. Запишем уравнения диссоциации комплексных ионов [Ag(NH3)2]+ и [Ag(CN)2]-: [Ag(NH3)2]+ Û Ag+ + 2NH3; [Ag(CN)2]- Û Ag+ + 2СN-. На основании этих равновесий запишем выражения констант нестойкости:
По таблице IV находим величины констант нестойкости: Кн/ = 5,8×10-8, Кн// = 1,4×10-20. Сравнивая константы, т.к. комплексные ионы однотипные, делаем вывод, что концентрация ионов серебра в дицианоаргентате калия меньше, чем в хлориде диамминсеребра. Для того, чтобы ответить на вопрос «во сколько раз концентрация ионов серебра в одном растворе больше, чем в другом?», можно провести последовательные вычисления концентрации ионов серебра для каждого из комплексных ионов, как в задаче 1.
Рассмотрим 2-ой путь решения. Все обозначения и преобразования сделаем, как в задаче 1, обозначив для аммиаката концентрации одним штрихом, а для цианида – двумя штрихами:
0,1 - х/ ≈ 0,1 и 0,1 - х// ≈ 0,1, т.к. степени диссоциации комплексных ионов малы.
Выразим х/ и х//: Разделив х/ на х//, получим:
Задача 3. Вычислите равновесную концентрацию ионов ртути в 0,1 М растворе K2[HgJ4], содержащем 0,01 М KJ, Кн = 1,48×10-30.
Решение. Запишем уравнение процесса диссоциации комплексного иона [HgJ4]2-: [HgJ4]2- Û Hg2+ + 4J- константа нестойкости ионов ртути равна: Выражение для концентрации ионов ртути запишется:
Подставим равновесные концентрации комплексного иона [HgJ4-2] = 0,1 моль/л и ионов иода [J-] = 0,01 моль/л, пренебрегая той малой частью, которая образуется при диссоциации комплексного иона, в выражение (1) и проведем вычисление концентрации ионов ртути в растворе: [Hg2+] = Задача 4. Произойдет ли разрушение комплекса, если к 0,02 М раствору K2[HgJ4] прилить равный объем 0,02 М раствора нитрата свинца? Решение. Комплексный ион будет разрушаться, если будет выполняться условие [Pb2+] × [J-]2 ≥ ПР (PbJ2). При этом ионы иода будут связываться в осадок, что вызовет смещение равновесия диссоциации комплексного иона вправо до полного его разрушения. Найдем концентрацию [Pb2+] и [HgJ4]-2 в растворе после смешивания. Концентрации уменьшаются в 2 раза и соответственно равны: [Pb2+] = 0,01 моль/л, [HgJ4-2] = 0,01 моль/л. Комплексный ион [HgJ4]-2 диссоциирует по уравнению: [HgJ4]-2 Û Hg2+ + 4J- константа нестойкости равна: обозначив концентрацию распавшихся комплексных ионов через х моль/л, тогда равновесные концентрации ионов будут равны: [Hg2+] = х моль/л; [J-] = 4х моль/л; [HgJ42-] = (0,01-х) ≈ 0,01 моль/л, т.к. х << 0,01. Подставляем значения равновесных концентраций в выражение константы нестойкости и вычисляем х:
Т.к. за х мы обозначили концентрацию продиссоциировавшей части комплексного иона, то [J-] = 4х = 4×1,4×10-7 = 5,6×10-7 (моль/л). Находим произведение концентраций ионов свинца и йода в растворе: [Pb2+] × [J-]2 = 10-2× (5,6×10-7)2 = 31,4×10-16 = 3,1×10-15. По таблице II находим произведение растворимости йодида свинца: ПР(PbJ2) = 1,1×10-9. Так как 3,1×10-15 < 1,1×10-9, то осадок не выпадает и комплексный ион не разрушается. Задача 5. Вычислить растворимость бромида серебра (в моль/л) в 1 М растворе аммиака. Решение. При растворении бромида серебра в растворе аммиака протекают следующие процессы: AgBr↓ Û Ag+ + Br- + 2NH3 Û [Ag(NH3)2]+ Суммарное уравнение процесса растворения: AgBr + 2NH3 Û [Ag (NH3)2]+ + Br–. Для данного процесса запишем константу равновесия:
Умножив числитель и знаменатель на равновесную концентрацию ионов серебра [Ag+], получим после преобразований:
Вычислим Кр, взяв из таблиц значения ПР и Кн:
Обозначим равновесную концентрацию ионов брома [Br-] = Р моль/л (т.к. она равна растворимости бромида серебра), тогда [Ag(NH3)2+] = Р моль/л, а равновесная концентрация аммиака 1-2 Р ≈ 1, т.к. Р <<1. Подставляем эти значения в выражение константы равновесия: Задача 6. Сколько миллилитров 1М раствора аммиака следует взять для полного растворения 0,1 г бромида серебра? Решение. Растворимость бромида серебра вычисляем, как в задаче 5.
Вычислив количество вещества бромида серебра:
рассчитываем объем 1М раствора аммиака:
Задача 7. Сколько моль/л аммиака необходимо добавить к 0,02 М раствору нитрата серебра, чтобы понизить равновесную концентрацию ионов серебра до 1×10-7 моль/л? Решение. Запишем общую схему диссоциации комплексного иона: [Ag (NH3)2]+ Û Ag+ + 2NH3. Константа нестойкости его запишется:
По условию концентрация ионов серебра [Ag+] = 1×10-7 моль/л, а исходная концентрация ионов серебра в растворе AgNO3 равна [Ag+]исх. = [Ag (NH3)2+] = [Ag+]исх. - [Ag+] = 2×10-2 - 1×10-7 ≈ 2×10-2 (моль/л). Находим равновесную концентрацию аммиака:
Т.к. часть аммиака расходуется на образование комплекса и равна удвоенной концентрации ионов серебра, то общая концентрация аммиака равна: [NH3]исх. = [NH3] + 2[Ag+]исх. = 1,08×10-1 + 2×2×10-2 = 1,48×10-1 (моль/л).
6.5. Использование реакций комплексообразования В анализе Многие комплексные соединения обладают целым рядом свойств, таких как характерная окраска, высокая прочность, малая растворимость, открывающих широкие возможности использования процессов комплексообразования для различных целей анализа: открытие ионов, повышение избирательности реакций, разделение групп, маскировка и демаскировка, растворение осадков, концентрирование, а также в различных химических и физических методах количественного анализа. 1. Открытие отдельных ионов. Ион калия можно открыть по образованию в нейтральной среде кристаллического осадка ярко – желтого цвета: 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]↓ + 2NaCl Ион Fe3+ открывают по образованию осадка гексацианоферрата (II) железа (III) (берлинская лазурь), имеющего ярко – синий цвет: 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ + 12KCl Ион Fe2+ открывают по образованию осадка гексацианоферрата (III) железа (II) (турнбулева синь), имеющего темно-синий цвет: 3FeSO4 + 2K3[Fe(CN)6] = Fe 3[Fe(CN)6]2↓ + 3K2SO4 Ионы Cu2+ c K4[Fe(CN)6] образуют в нейтральных или слабокислых растворах гексацианоферрат(II) меди – осадок красного цвета: 2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6]↓ + 2K2SO4 Ион Zn2+ с K4[Fe(CN)6] дает осадок белого цвета – гексацианоферрат (II) калия-цинка: 3ZnSO4 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2↓ + 3K2SO4 Ионы Cu2+ с избытком водного раствора аммиака дают раствор ярко-синего цвета. Цвет раствору придает сульфат тетраамминмеди (II): CuSO4 + 4NH3 = [Cu(NH3)4]SO4 Ионы CNS- можно обнаружить по образованию с ионами Fe3+ комплексного соединения [Fe(CNS)3], имеющего красный цвет. 2. Для разделения ионов. Ионы Cu2+, Co2+, Ni2+ можно отделить от ионов Fe2+, Fe3+, Bi3+, Mn2+, Mg2+ действием концентрированного раствора аммиака при нагревании. При этом ионы Cu2+, Co2+, Ni2+ переходят в раствор в виде комплексных аммиакатов: [Cu(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+, а катионы V группы оседают в виде гидроксидов белого или бурого цвета.
По систематическому ходу анализа катионов I - III групп ионы кальция рекомендуется открывать, переводя их предварительно, действием сульфата аммония в раствор, в виде непрочного комплексного иона [Cа(SO4)2]2-, который затем легко разрушается действием щавелевокислого аммония (NH4)2C2O4 (образуется осадок CaC2O4) или спиртом, или ацетоном (образуется осадок CаSO4). 3.Для маскировки и демаскировки. Во многих случаях комплексообразование используют для маскировки мешающих ходу анализа ионов. Для этой цели подбираются соединения, связывающие мешающие ионы в прочные бесцветные соединения. Например, ионы Fe3+ мешают обнаружению ионов Co2+ с помощью тиоцианата аммония NH4CNS. Катион кобальта Co2+ дает с этим реагентом соединение синего цвета: Co2+ + 4CNS- = [Co(CNS)4]2-, а катион Fe3+ - соединение [Fe(CNS)3] интенсивно красного цвета, которое делает незаметным синее окрашивание. Ионы железа (III) маскируют добавлением в анализируемый раствор одного из реагентов, содержащих фторид-ионы, фосфат-ионы, оксалат-ионы, тартрат-ионы, с которыми они образуют бесцветные прочные комплексные ионы: [FeF6]3-, [Fe(PO4)2]3-, [Fe(C2O4)3]3-, [Fe(C4H4O6)3]3-. Эти комплексные ионы настолько прочные, что даже чувствительные реагенты на Fe3+ не обнаруживают их в растворе, комплексное соединение не образуется, что дает возможность наблюдать синее окрашивание, свидетельствующее о наличии ионов кобальта, и, таким образом, обнаруживать их в растворе в присутствии ионов железа. Для открытия ионов Cd2+ в виде желтого осадка сульфида кадмия CdS в присутствии ионов Cu2+ (дает с ионом S2- осадок CuS черного цвета) ионы меди маскируют тиомочевинной CS(NH2)2. Ионы меди связываются в прочный комплекс, черного осадка не образуется, что дает возможность наблюдать осадок желтого цвета и, таким образом, обнаруживать ионы кадмия в присутствии ионов меди. Ион меди в этом случае можно связать и с помощью цианид-ионов в прочный комплекс. Образующийся при этом комплексный ион [Cd(NH)4]2- мало устойчив, и концентрация ионов Cd2+ в растворе оказывается достаточной для образования осадка сульфида кадмия. В некоторых случаях необходимо провести процесс, обратный маскировке, т.е. осуществить демаскирование. Наличие анионов фтора в растворе (фторид-ион связывает Fe3+ в бесцветный прочный комплекс [FeF6]3-) не позволяет провести обнаружение самих ионов Fe3+. Вводя ионы алюминия, образующие еще более прочные комплексы с фторид-ионом [AlF6]3-, чем ионы Fe3+, можно демаскировать ион Fe3+ и провести его обнаружение одной из характерных реакций: Fe3+ + 3CNS- = [Fe(CNS)3]. 4. Растворение малорастворимых соединений. Процесс комплексообразования позволяет осуществить перевод в раствор соединений, практически нерастворимых в воде, в кислотах и щелочах. Осадок AgCl в кислых средах не растворяется, но может быть растворен в растворе аммиака. При этом образуется комплексный ион [Ag(NH3)2]+: AgCl↓ + 2NH4OH = [Ag(NH3)2]Cl + 2H2O Нерастворимые соли ртути (II), серебра, железа (II) можно растворить в избытке электролита с одноименным ионом:
HgI2↓ + 2I- = [HgI4]2-; AgCN↓ + CN- = [Ag(CN)2]-; Fe(CN)2↓ + 4CN- = [Fe(CN)6]4-. Используя процесс комплексообразования, можно разделить достаточно сложные смеси соединений, нерастворимых в воде и кислотах. Например, если на смесь AgBr и AgI подействовать аммиаком, то в осадке остается иодид серебра, а бромид растворяется с образованием аммиаката серебра [Ag(NH3)2]Br. Иодид серебра, в свою очередь, можно перевести в раствор, используя цианид-ионы, при этом образуется комплексный ион [Ag(CN)2]-. Даже металлическое серебро и золото при доступе кислорода растворяются в цианидах щелочных металлов с образованием комплексных ионов: 4Au + 8NaCN + O2 + 2H2O = 4Na[Au(CN)2] + 4NaOH Цианидные комплексы достаточно прочные, что делает возможным процесс их образования даже при очень малых концентрациях в растворе ионов комплексообразователей. Поэтому в аналитической практике широко используется образование комплексных соединений цианидов для растворения многих нерастворимых сульфидов, оксидов, гидроксидов: CuS, ZnO, HgO, NiO, Ni(OH)2, Co(OH)2 и др.: HgO↓ + 4CN– + H2O = [Hg(CN)4]2- + 2OH– Процесс комплексообразования может оказывать помехи при открытии ионов. Например, в присутствии тартратов (соли винной кислоты H2C4H4O6) при добавлении к раствору, содержащему ионы Al3+ ионов OH– осадок Al(OH)3 не образуется. Это объясняется образованием прочного комплексного иона алюминия с тартратом [Al(C4H4O6)3]3-, который не разлагается щелочью. Подобно этому, невозможно открытие традиционными реактивами ионов Fe3+, если в растворе одновременно присутствуют ионы, связывающие ион Fe3+ в прочный комплекс. В этих случаях необходимо предварительно удалить мешающие ходу анализа ионы, или замаскировать их, связав в еще более прочный комплекс, или разрушить имеющиеся в растворе комплексные соединения, подобрав для этой цели соответствующие реагенты. 5. Подбор реагентов, разрушающих комплексные ионы. В тех случаях, когда это необходимо, комплексные соединения можно разрушить, при этом возможно выпадение осадка, что послужит аналитическим сигналом присутствия искомого иона. Для осуществления разрушения комплексов необходимо подобрать соответствующие реагенты, учитывая равновесные процессы, имеющие место при диссоциации комплексных ионов. Рассмотрим процессы разрушения комплексного иона аммиаката серебра, осуществляемые при открытии ионов серебра в ходе анализа второй аналитической группы. Вторая аналитическая группа осаждается из исследуемого раствора в виде хлоридов (AgCl, PbCl2, Hg2Cl2). При обработке этого осадка раствором аммиака ионы серебра переходят в раствор в виде комплексной соли: AgCl↓ + 2NH3 = [Ag(NH3)2]Cl Механизм разрушения можно представить в виде следующих схем: а) разрушающий реагент – кислота (например, азотная)
↑↓ + Ag+ AgCl↓
+ 2[NH4]+ (HNO3) 2H+ б) разрушающий реагент – ионы йода (например, KJ) [Ag(NH3)]Cl →[Ag(NH3)]+ + Cl- ↑↓
+ J– AgJ↓ В первом случае (а) введение ионов водорода способствует связыванию одного из продуктов диссоциации комплексного иона серебра в прочный комплексный ион [NH4]+, при этом равновесие вторичной диссоциации смещается вправо, в растворе накапливаются ионы серебра Ag+, ионное произведение [Ag+][Cl-] достигает величины произведения растворимости (ПР = 1,78×10-10), что проявляется внешним эффектом – выпадением белого осадка AgCl↓. Во втором случае (б) при добавлении к раствору комплексной соли серебра ионов I– выпадает осадок AgI↓ желтого цвета. Почему? Произведение растворимости иодида серебра ПРAgI =8,3×10-17 говорит о меньшей растворимости иодида серебра по сравнению с хлоридом серебра ПРAgCl = 1,78×10-10. Концентрации ионов серебра, образующихся при диссоциации комплексного иона [Ag(NH3)2]+, недостаточно для образования осадка AgCl, но вполне достаточно для образования осадка AgI. Рассмотрим еще один пример подбора реагентов для разрушения комплексных ионов. Даны растворы двух комплексов серебра [Ag(NH3)2]+ и [Ag(CN)2]-. Если к пробам из первой (1) и второй (2) пробирок добавить раствор хлорида калия, то осадок не выпадает, при добавлении раствора иодида калия осадок желтого цвета AgI↓ выпадет только в пробе первого раствора, а во второй – нет, а при добавлении раствора сероводородной воды H2S осадок черного цвета Ag2S↓ выпадает и в первой и во второй пробах: а) раствор KCl б) раствор KJ
Комплексный ион цианида серебра прочнее, чем аммиакат (KH [Ag (CN)2]- = 1,4×10-20, KH [Ag (NH3)2]+ = 5,8×10-8) и поэтому его труднее разрушить. Сравнение растворимостей осадков позволяет продолжить ответ на вопрос, почему H2S разрушает оба комплекса, KI – только аммиакат, а KCl не разрушает ни того, ни другого: Р (Ag2S) = 2,4×10-17 моль/л; Р (AgJ) = 9,2×10-9 моль/л; Р (AgCl) = 1,3×10-5 моль/л. Таким образом, в зависимости от прочности комплексного иона необходимо подбирать такой ион осадитель, чтобы ионное произведение в растворе достигло произведения растворимости. В общем случае разрушение комплексного иона происходит, если при действии какого-либо реагента в качестве продуктов реакции образуются малорастворимые соединения или слабые электролиты (в качестве таковых могут выступать и другие, более прочные комплексные ионы). Используя последовательно процессы образования и разрушения комплексных ионов, можно осуществлять взаимные переходы одних соединений в другие. Например: Ag+ Комплексообразование может оказывать влияние и на изменение кислотно-основных, окислительно-восстановительных свойств соединений, что также находит место в химическом анализе. Комплексообразование широко применяют в экстракционном концентрировании и разделении веществ. Например, многие катионы экстрагируются из водных растворов хлороформом в виде комплексов с анионами CNS–, Cl–, Br– и др. Экстракцию ионов из водных растворов проводят обычно, используя способность многих органических лигандов избирательно образовывать комплексные соединения. Органические реактивы применяют для обнаружения и количественного определения микроэлементов (Cu, Zn, Co, Ni, Mn и др.) в растительных объектах, почве. Широкое применение находят процессы комплексообразования в количественном анализе.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 7312; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.120.159 (0.075 с.) |
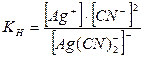 *
* ] = (0,1 – х) моль/л ≈ 0,1 моль/л, т.к. константа диссоциации комплексного иона достаточно мала, т.е. можно говорить о его малой диссоциации. Запишем выражение для константы нестойкости, проведем соответствующие подстановки и преобразования:
] = (0,1 – х) моль/л ≈ 0,1 моль/л, т.к. константа диссоциации комплексного иона достаточно мала, т.е. можно говорить о его малой диссоциации. Запишем выражение для константы нестойкости, проведем соответствующие подстановки и преобразования: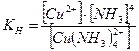 ; Кн =
; Кн = 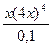 ;
;  = 9,3×10-13;
= 9,3×10-13; ,
,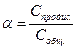 ; α =
; α = 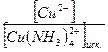 ; α =
; α =  = 8,2×10-3; α = 0,82%.
= 8,2×10-3; α = 0,82%.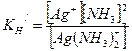 ;
; 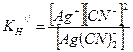 .
.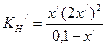 ;
; 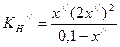 ;
; ;
; 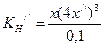 .
.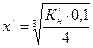 ;
; 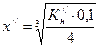 .
.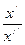 =
= 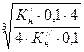 =
= 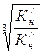 .
.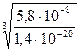 =
= 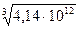 = 1,6×104 = 16000 (раз).
= 1,6×104 = 16000 (раз).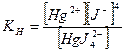 .
.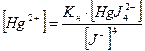 (1)
(1)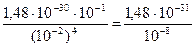 = 1,48×10-23 (моль/л)
= 1,48×10-23 (моль/л)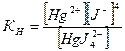 ;
;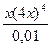 = 1,48×10-30; 256х5 = 1,48 × 10-32;
= 1,48×10-30; 256х5 = 1,48 × 10-32; = 1,4×10-7 (моль/л).
= 1,4×10-7 (моль/л).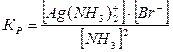
 .
.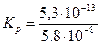 = 0,91×10-5 = 9,1×10-6.
= 0,91×10-5 = 9,1×10-6.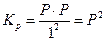 ;
; 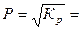
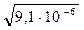 ≈ 3×10-3 (моль/л).
≈ 3×10-3 (моль/л).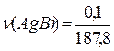 = 5,3×10-4 (моль),
= 5,3×10-4 (моль),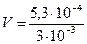 ×103 = 1,77×102 = 177 (мл).
×103 = 1,77×102 = 177 (мл).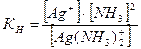 .
.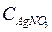 = 0,02 моль/л. Концентрация ионов серебра, связанных в комплексный ион, и концентрация этого комплексного иона равны:
= 0,02 моль/л. Концентрация ионов серебра, связанных в комплексный ион, и концентрация этого комплексного иона равны: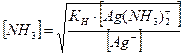
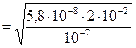 = 1,08×10-1 (моль/л).
= 1,08×10-1 (моль/л). [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl– 2NH3
2NH3 2NH3 + Ag+
2NH3 + Ag+

 в) раствор H2S
в) раствор H2S  Ag2S↓
Ag2S↓ AgCl↓
AgCl↓ 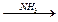 [Ag(NH3)2]+
[Ag(NH3)2]+ 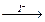 AgI↓
AgI↓  [Ag(CN)2]–
[Ag(CN)2]– 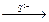 Ag2S↓
Ag2S↓


