Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ахат - ацил-коа-холестерин-ацилтрансфераза гэх — гидролаза эфиров ХС.
ЛПВП-частицы, обогащенные ХС и апо-Е, направляются в печень, где взаимодействуют с апо-В, Е-рецепторами, интернализуются и разрушаются. Таким образом, апо-Е выступает в роли вектора, направляющего частицы ЛПВП в печень для окисления содержащегося в них ХС. Доказано, что ХС ЛПВП - предпочтительный субстрат для образования в гепатоцитах желчных кислот. Взаимодействие ЛПВП с гепатоцитами, по существу, завершает процесс «обратного» транспорта ХС в организме. Таким образом, ЛПВП активно забирают ХС из ГМК, фибробластов, макрофагов, эндотелиальных клеток и направляют его в печень для окисления и удаления из организма. Подводя итоги, можно констатировать, что существующие в норме механизмы регуляции доставки и удаления ХС достаточно эффективно поддерживают ХС гомеостаз отдельной клетки и целостного организма (рис. 6). Рис. 6. Транспорт ХС липопротеинамн различных классов из печени В периферическую клетку и обратно. В, С, Е - соответствующие Апопротеины (по А.Н. Климову, Н.Г. Никульчевой, 1995). Генетические дефекты в данных системах могут быть причиной наследственных гиперхолестеринемий или дислипопротеинемий (ДЛП), ведущих к развитию атеросклероза. Однако частота встречаемости наследственных дефектов транспорта ХС не очень высока, в то время как сам атеросклероз распространен практически среди всей человеческой популяции в развитых странах мира. Каковы могут быть причины развития атеросклероза у лиц, не имеющих каких-либо генетических аномалий? Для того чтобы попытаться ответить на этот вопрос, необходимо уточнить, какие именно ЛП могут быть отнесены к т.н. «атерогенным», способным вызывать ДЛП и атеросклероз. Патологические ЛП 1. Бета-ЛПОНП. При некоторых нарушениях ЛП обмена в крови у человека и некоторых животных обнаруживаются бета-ЛПОНП или флотирующие бета-ЛП. В частности, бета-ЛПОНП появляются у экспериментальных кроликов, содержащихся на высокохолестериновой диете, а также у человека при III-м типе ДЛП.
Это - самостоятельная фракция ЛП, близкая по свойствам к ЛП промежуточной плотности, но отличающаяся от последних большей насыщенностью ХС, апо-Е-1 и путями катаболизма. Эти ЛП не превращаются в ЛПНП под действием печеночной липазы, как нормальные ЛП промежуточной плотности. Предполагается, что в результате структурных изменений они утрачивают сродство к этому ферменту и поэтому длительно циркулируют в крови. На макрофагах имеются специфические рецепторы к бета-ЛПОНП, в результате взаимодействия с которыми происходит их проникновение в клетку, однако этот процесс не регулируется по механизму обратной связи, поэтому макрофаги трансформируются в пенистые клетки, характерные для атеросклеротического процесса.
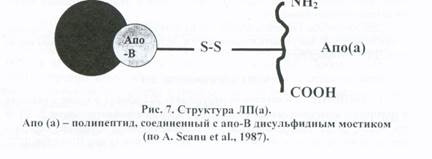
2. ЛПВПхс. Эта фракция ЛПВП появляется у экспериментальных кроликов, находящихся на ХС диете, а также у людей, потребляющих пищу, богатую 3. Разновидность ЛП, обозначаемая как ЛП-Х. Эти ЛП появляются в крови при заболеваниях печени, сопровождающихся застоем желчи и желтухой. 4. Липопротеин(а), ЛП(а), в англоязычной литературе - Lp(a). ЛП(а) - На долю апо(а) приходится 20% массы белка, на долю апо-В - около 65% и на долю необычного для ЛП белка - альбумина - около 15%. Обнаружено близкое структурное сходство апо(а) с плазминогеном - одним из факторов свертывания крови. В настоящее время точно не установлены места синтеза и катаболизма ЛП(а). Частичная деградация этих ЛП происходит путем их связывания с апо-В, Е-рецепторами.
Один из наиболее важных аспектов изучения этих ЛП - их роль в развитии атеросклероза. На основании эпидемиологических исследований удалось установить четкую связь между повышенной концентрацией ЛП(а) в крови и развитием коронарного атеросклероза с инфарктом миокарда. Повышенный уровень ЛП(а) определяется более чем у половины пациентов, перенесших инфаркт миокарда. Особенно высок уровень этого ЛП у больных, перенесших инсульт. Считается, что 20-30 мг/дл - предельная концентрация ЛП(а) для здорового человека, превышение этого уровня рассматривается как патология. Важно то, что повышенный уровень ЛП(а) в крови практически не снижается при применении известных в настоящее время гиполипидемических препаратов. ЛП(а) обнаружены в местах поражения сосудов, причем отложения апо(а) располагаются, главным образом, внеклеточно и в участках скопления фибриногена, что подтверждает связь ЛП(а) со свертывающей системой крови. Атерогенность ЛП(а) может быть обусловлена следующими факторами: • Апо(а), соединенный с апо-В, задерживает деградацию и удаление • Апо(а), конкурируя с плазминогеном за места связывания на фибрине, • ЛП(а) или очищенный апо(а) стимулирует рост ГМК аорты человека в Популяционные исследования, проведенные в различных регионах мира показали, что повышение уровня ЛП(а) в крови представляет собой самостоятельный и независимый фактор риска ИБС - наиболее частого и тяжелого клинического проявления атеросклероза.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 140; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.246.254 (0.01 с.) |