
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулы, составляющие тело, находятся в состоянии непрерывного беспорядочного (хаотического) движения.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество. В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела). В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел. В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе. Закономерности броуновского движения. Важную роль в подтверждении справедливости молекулярно-кинетической теории сыграли опыты французского физика Ж. Перрена по изучению количественных закономерностей броуновского движения, выполненные в 1908—1911 гг. Эти опыты были поставлены после того, как А. Эйнштейн в 1905 г. на основе молекулярно-кинетической теории разработал теорию броуновского движения. А.Эйнштейн доказал, что при хаотическом движении броуновской частицы ее смещение от начального положения должно подчиняться закону:
где Наблюдения Перрена полностью подтвердили этот теоретический результат. Регистрируя положения броуновской частицы через равные промежутки времени, Перрен увидел, что движение броуновской частицы весьма запутанно, беспорядочно, а ее смещение от начального положения пропорционально именно корню квадратному из времени.
10.3 Размеры и масса молекул, количество вещества
Молекула – это наименьшая частица вещества, сохраняющая все его химические свойства. Различают молекулу в физическом смысле (физическую молекулу), которую можно уподобить упругому шарику, и химическую молекулу, выраженную формулой атомного состава. Молекулы не всех веществ можно рассматривать как физические, например, молекулы веществ с ионной связью (в частности, NaCl – повареная соль). Это важно, когда рассматриваются соударения молекул или их тепловое движение. Поэтому в формулировке основных положений МКТ чаще всего используют термин «частица». Размеры молекул очень малы. Если представить молекулу в виде малого шарика, то его радиус имеет порядок величины 10-8 см =10-10 м. Молекулы состоят из атомов. Частицы, образующие атомы - электроны и ядра. Принято считать, что электрон имеет радиус порядка величины 10-11см = 10-13 м, а ядра атомов имеют радиусы примерно 10-12 ÷ 10-13 см = 10-14 ÷10-15 м. Используя атомистическую теорию строения вещества, Д. Дальтон разработал простой способ определения относительных масс атомов. Он предложил за единицу массы атомов принять массу одного атома водорода. Массу атома любого другого элемента можно найти, сравнив массу водорода с массой вещества, вступившего в химическую реакцию соединения этого элемента с водородом. В качестве единичной атомной массы mатпринимается 1/12 массы атома ядра изотопа углерода
Относительная молекулярная масса, или относительная масса молекулы, есть отношение массы молекулы к единичной атомной массе:
Аналогично определяют и относительную атомную массу. Абсолютные значения атомных масс по порядку величины заключаются в пределах 10 –25 ÷ 10 –27 кг, а относительные атомные массы в пределах 1÷102. Пределы относительных молекулярных масс mr от 1 до 105. Количество вещества. Количество вещества характеризуется числом его структурных элементов. В СИ оно выражается в молях. Моль является основной единицей измерения, так же как метр и секунда. Моль равен количеству вещества рассматриваемой системы, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода Понятие моля относится к числу структурных элементов вещества. Поэтому нужно говорить: «моль молекул», «моль атомов», «моль электронов» и т.п. Таким образом, моль любого вещества содержит одинаковое число структурных элементов. Это число называется постоянной Авогадро или числом Авогадро:
Отсюда следует:
Молярная масса – масса одного моля молекул вещества:
Её определяют через относительную массу молекулы:
Число молей молекул n связано с числом молекул N некоторого вещества формулой:
где
Модель идеального газа
Первым шагом на пути построения физической теории может быть создание мысленной модели объекта. Любая мысленная модель реального объекта обязательно является упрощением действительности и поэтому имеет определенные границы применимости, в пределах которых она может с успехом использоваться для описания известных свойств и предсказания новых, ранее неизвестных следствий теории. Примером модели, использованной для теоретического объяснения свойств газов, может служить модель идеального газа. М.В.Ломоносов считал, что вещества состоят из корпускул, находящихся во вращательном движении, температура тела связана с вращательным движением этих корпускул. Английский физик Д.Джоуль в 1852 г. предложил более точную модель, приписав молекулам газа поступательное движение. При этом он считал, что скорости всех молекул одинаковы. На основе этих предположений он теоретически вывел закон Бойля - Мариотта, вычислил скорость теплового движения молекул, определил значение абсолютного нуля. В 1857 г. немецкий физик Р. Клаузиус, используя модель идеального газа, впервые систематически изложил кинетическую теорию газов. Он ввел понятие о средних величинах, длине свободного пробега молекул, вычислил давление газа на стенки сосуда и среднюю длину пути между двумя столкновениями молекул. Идеальным Клаузиус назвал газ, удовлетворяющий следующим условиям: · объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится; · время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями (т. е. временем свободного пробега молекулы); · молекулы взаимодействуют между собой только при непосредственном соприкосновении, при этом они отталкиваются; · силы притяжения между молекулами идеального газа ничтожно малы и ими можно пренебречь.
Исходя из этих положений, Клаузиус смог вывести все свойства идеального газа и установить соотношения между его микроскопическими и макроскопическими параметрами. Микроскопическими параметрами газа называют индивидуальные характеристики молекул. К их числу относятся масса молекулы, ее скорость, импульс и кинетическая энергия поступательного движения. Параметры газа как физического тела называются макроскопическими. К ним относятся температура, объем и давление газа. Одной из важнейших задач молекулярно-кинетической теории было установление связи между макроскопическими и микроскопическими параметрами газа.
Лекция 11 Молекулярно-кинетическая теория идеального газа
11.1 Основное уравнение молекулярно-кинетической теории. 11.2 Молекулярно-кинетический смысл температуры. 11.3 Распределение молекул по скоростям и энергиям. 11.4 Средняя длина свободного пробега молекул.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 517; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.126.5 (0.019 с.) |
 (10.1)
(10.1)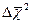 — средний квадрат смещения броуновской частицы за время Δt, b – постоянная, зависящая от формы и размеров броуновской частицы, NA – постоянная Авогадро, Т – абсолютная температура.
— средний квадрат смещения броуновской частицы за время Δt, b – постоянная, зависящая от формы и размеров броуновской частицы, NA – постоянная Авогадро, Т – абсолютная температура.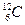 :
: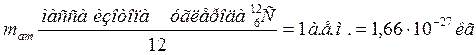 (10.2)
(10.2)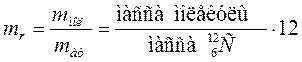 (10.3)
(10.3)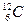 .
.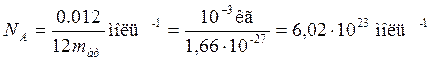 (10.4)
(10.4) (10.5)
(10.5)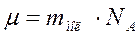
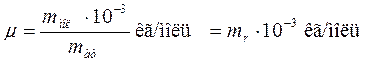 (10.6)
(10.6)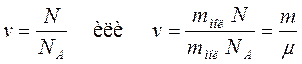 , (10.6)
, (10.6)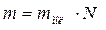 – масса вещества.
– масса вещества.


