
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Львівський коледж державного університету інформаційно-комунікаційних технологій
КОНСПЕКТ ЛЕКЦІЙ «Електроматеріали» Склав викладач: К.ф.-м.н. Трач І.Б. м. Львів 2015р.
До основних понять, термінів, визначень хімії належать: 1. Атом – це складна мікроструктура, що складається з позитивно зарядженого ядра і негативно заряджених електронів, які перебувають у постійному русі і їх рух описується законами квантової механіки. В ядрі атомів містяться частинки, які називаються нуклонами і які перебувають в двох станах – протона і нейтрона. Зважаючи на це, в хімію введенні поняття нуклонне і протонне число. 2. Нуклонне число – це загальне число нуклонів в ядрі атома, тобто сума протонів (Z) і нейтронів (N). Нуклонне число позначають арабськими числами зверху ліворуч від символу елемента, наприклад 3. Протонне число – це кількість протонів в ядрі атома. Позначають протонне число арабськими числами знизу ліворуч від символу елемента, наприклад: 4. Хімічний елемент – це тип атомів із строго певним протонним числом. Хімічні елементи позначають відповідними символами, які є міжнародними. Атоми деяких елементів можуть містити в ядрі різну кількість нейтронів за однієї і тієї самої кількості протонів. У зв’язку з цим введено поняття: ізотопи. 5. Ізотопи – це атоми хімічного елемента, що відрізняються між собою числом нейтронів в ядрі, а відтак і нуклонним числом. Наприклад: Хімічні властивості елементів визначаються, в основному, протонним числом, тому хімічні властивості ізотопів незначно відрізняються між собою. 6. Молекула – це найменша частинка речовини, яка є носієм основних її властивостей. Отже, молекула – складова частина всіх речовин навколишнього світу. Залежно від типу атомів, які, сполучаючись, утворюють молекули, розрізняють речовини: прості і складні. 7. Проста речовина – це така, молекули якої утворені атомами одного елемента. Назву простої речовини записують з малої букви, наприклад натрій (Na), калій (К), хлор (Сl2)
8. Складна речовина – це така, молекули якої утворені атомами різних елементів. Назву складної речовини також записують з малої букви, наприклад: вода (Н2О), сульфатна кислота (H2SO4). Деякі хімічні елементи можуть сполучатись між собою, утворювати декілька простих речовин. У зв’язку з чим у хімію введено поняття: алотропія та алотропи. 9. Алотропія – це властивість хімічних елементів утворювати декілька простих речовин, які відрізняються кількістю атомів у молекулі, а утворені прості речовини називаються алотропами. Наприклад: O2, O3; S8, S6, S4, S2. Алотропи, маючи різну кількість атомів у молекулі, відрізняються між собою будовою молекули, а значить, і властивостями. Під час хімічних реакцій відбуваються складні, різнопланові процеси, які, з метою спрощення, можна звести до приймання і віддачі електронів. У зв’язку з цим введено поняття: іон. 10. Іон – електронодефіцитний або електрононадлишковий атом або група атомів. Отже, іон – це заряджена частинка. Якщо атом або група атомів віддає електрони, то іон має заряд (+), якщо приймає – (-). Заряд іона позначають зверху праворуч від його символу арабськими числами із знаком (+) або (-) після числа, наприклад: Заряд 1 прийнято не писати, а лише його знак (+) або (-) Атоми елементів мають певну масу, яка дуже мала, виражається у межах 1,67*10-27-3,4*10-25кг. Оперувати такими надзвичайно малими числами незручно. Тому замість абсолютної маси атомів прийнято користуватись відносними величинами. За відносну одиницю маси атомів прийнята атомарна одиниця маси (а.о.м.) 11. Атомарна одиниця маси – це 1/12 частина маси ізотопу атома елемента Вуглецю 12. Атомна маса елемента – це маса атома елемента, виражена в а.о.м. Так, атомна маса атома Кисню 15,9994. це означає, що атом елемента Кисню важчий від 1/12 маси атома Вуглецю
13. Молекулярна маса речовини – це маса молекули цієї речовини, виражена в а.о.м., дорівнює сумі атомних мас елементів, що входять до складу молекули. Відтак молекулярна маса речовини є також величиною відносною, безрозмірною. Так, молекулярна маса води дорівнює 15,99994+2*1,0079=31,0148 Наступною, дуже важливою одиницею, яку широко використовують в хімічних розрахунках, є моль. 14. Моль – це одиниця кількості речовини, являє собою таку кількість цієї речовини, яка містить стільки структурних одиниць (молекул, атомів, іонів, електронів), скільки атомів міститься в 12 г ізотопу Вуглецю Видатний італійський фізик і хімік Авогадро експериментально визначив, що 2 г ізотопу Вуглецю Для практичних розрахунків необхідно знати, яку масу має моль молекул, атомів. Тому введене поняття мольна (молярна) маса. 15. Мольна (молярна) маса – це маса одного моля, виражена в масових одиницях. Позначають буквою М, виражають у г/моль, кг/моль. Наприклад: МО=15,9994 г/моль, МО2=31,9988 г/моль, МН=1,0079 г/моль, МН2= 2,0158 г/моль. Речовини реагують між собою не довільно, а в строго певних (еквівалентних) відношеннях. У зв’язку з цим у хімію введенні поняття: хімічний еквівалент елемента і речовини. За еталон прийнято 1 моль атомів Водню. 16. Хімічний еквівалент елемента – це така його кількість, яка реагує (взаємодіє) з 1 молем атомів елемента Водню або заміщає 1 моль його атомів у хімічній реакції. Розмірність – частики моля елемента. Приклади 1. 2Н2+О2=2Н2О 2. Н2+О2=Н2О2 3. Zn+2HCl=ZnCl2+H2 У першій реакції хімічний еквівалент елемента Кисню дорівнює 0,5 моля елемента Кисню, у другій – 1,0 моль елемента Кисню. Хімічний еквівалент елемента Цинку дорівнює 0,5 моля елемента Цинку. 17. Хімічний еквівалент речовини – це така її кількість, яка взаємодіє в хімічній реакції з одним молем атомів елемента Водню або одним еквівалентом іншої речовини. Приклади: 1. H2+Cl2 =2HCl 2. NaOH+H2SO4=NaHSO4+H2O 3. 2NaOH+H2SO4=Na2SO4+2H2O У реакції (1) хімічний еквівалент речовини хлору дорівнює 0,5 моля речовини хлору; в реакції (2) хімічний еквівалент речовини H2SO4 дорівнює 1,0 моль речовини H2SO4, в реакції (3) – 0,5 моля речовини H2SO4. отже розмірність хімічного еквівалента – частки моля. Таким чином поняття хімічний еквівалент елемента чи речовини прямо зв’язаний з реакцією, в якій бере участь цей елемент чи речовина. Тому говорити про хімічний еквівалент без вказівки, в якій реакції бере участь цей елемент чи речовина, не можна. Хімічний еквівалент визначає мольні співвідношення між реагуючими речовинами. В інженерних розрахунках здебільшого оперують (користуються) масовими величинами. У зв’язку з тим введені поняття еквівалентна маса елемента і сполуки. 18. Еквівалентна маса елемента в речовині – це маса одного хімічного еквівалента елемента в речовині. Позначають Е, виражають в г/екв, кг/екв. Еквівалентну масу елемента в речовині (Еел) визначають за формулою
Де М – мольна маса елемента, г\моль В – ступінь окиснення елемента (без знака). 19. Еквівалентна маса речовини – це маса одного хімічного еквівалента сполуки. Визначають еквівалентну масу сполуки (Есп) за формулою
Де М – мольна маса елемента, г\моль В, n – коефіцієнти, які залежать від природи речовини і реакції, в якій речовина бере участь. Як відомо, є чотири класи неорганічних сполук: оксиди, гідроксиди, кислоти і солі. Отже, для кожного класу сполук значення величини В і n буде інше.
|
||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.244 (0.014 с.) |


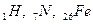
 - Протій,
- Протій,  - Дейтерій,
- Дейтерій,  - Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:
- Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:  ,
,  ,
,  .
.
 . Абсолютна маса атома ізотопу Вуглецю
. Абсолютна маса атома ізотопу Вуглецю 




