
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Державний університет телекомунікаційСтр 1 из 13Следующая ⇒
ДЕРЖАВНИЙ УНІВЕРСИТЕТ ТЕЛЕКОМУНІКАЦІЙ
ЛЬВІВСЬКИЙ КОЛЕДЖ ДЕРЖАВНОГО УНІВЕРСИТЕТУ ІНФОРМАЦІЙНО-КОМУНІКАЦІЙНИХ ТЕХНОЛОГІЙ
КОНСПЕКТ ЛЕКЦІЙ «Електроматеріали» Склав викладач: К.ф.-м.н. Трач І.Б. м. Львів 2015р.
До основних понять, термінів, визначень хімії належать: 1. Атом – це складна мікроструктура, що складається з позитивно зарядженого ядра і негативно заряджених електронів, які перебувають у постійному русі і їх рух описується законами квантової механіки. В ядрі атомів містяться частинки, які називаються нуклонами і які перебувають в двох станах – протона і нейтрона. Зважаючи на це, в хімію введенні поняття нуклонне і протонне число. 2. Нуклонне число – це загальне число нуклонів в ядрі атома, тобто сума протонів (Z) і нейтронів (N). Нуклонне число позначають арабськими числами зверху ліворуч від символу елемента, наприклад 3. Протонне число – це кількість протонів в ядрі атома. Позначають протонне число арабськими числами знизу ліворуч від символу елемента, наприклад: 4. Хімічний елемент – це тип атомів із строго певним протонним числом. Хімічні елементи позначають відповідними символами, які є міжнародними. Атоми деяких елементів можуть містити в ядрі різну кількість нейтронів за однієї і тієї самої кількості протонів. У зв’язку з цим введено поняття: ізотопи. 5. Ізотопи – це атоми хімічного елемента, що відрізняються між собою числом нейтронів в ядрі, а відтак і нуклонним числом. Наприклад: Хімічні властивості елементів визначаються, в основному, протонним числом, тому хімічні властивості ізотопів незначно відрізняються між собою. 6. Молекула – це найменша частинка речовини, яка є носієм основних її властивостей. Отже, молекула – складова частина всіх речовин навколишнього світу. Залежно від типу атомів, які, сполучаючись, утворюють молекули, розрізняють речовини: прості і складні.
7. Проста речовина – це така, молекули якої утворені атомами одного елемента. Назву простої речовини записують з малої букви, наприклад натрій (Na), калій (К), хлор (Сl2) 8. Складна речовина – це така, молекули якої утворені атомами різних елементів. Назву складної речовини також записують з малої букви, наприклад: вода (Н2О), сульфатна кислота (H2SO4). Деякі хімічні елементи можуть сполучатись між собою, утворювати декілька простих речовин. У зв’язку з чим у хімію введено поняття: алотропія та алотропи. 9. Алотропія – це властивість хімічних елементів утворювати декілька простих речовин, які відрізняються кількістю атомів у молекулі, а утворені прості речовини називаються алотропами. Наприклад: O2, O3; S8, S6, S4, S2. Алотропи, маючи різну кількість атомів у молекулі, відрізняються між собою будовою молекули, а значить, і властивостями. Під час хімічних реакцій відбуваються складні, різнопланові процеси, які, з метою спрощення, можна звести до приймання і віддачі електронів. У зв’язку з цим введено поняття: іон. 10. Іон – електронодефіцитний або електрононадлишковий атом або група атомів. Отже, іон – це заряджена частинка. Якщо атом або група атомів віддає електрони, то іон має заряд (+), якщо приймає – (-). Заряд іона позначають зверху праворуч від його символу арабськими числами із знаком (+) або (-) після числа, наприклад: Заряд 1 прийнято не писати, а лише його знак (+) або (-) Атоми елементів мають певну масу, яка дуже мала, виражається у межах 1,67*10-27-3,4*10-25кг. Оперувати такими надзвичайно малими числами незручно. Тому замість абсолютної маси атомів прийнято користуватись відносними величинами. За відносну одиницю маси атомів прийнята атомарна одиниця маси (а.о.м.) 11. Атомарна одиниця маси – це 1/12 частина маси ізотопу атома елемента Вуглецю
12. Атомна маса елемента – це маса атома елемента, виражена в а.о.м. Так, атомна маса атома Кисню 15,9994. це означає, що атом елемента Кисню важчий від 1/12 маси атома Вуглецю 13. Молекулярна маса речовини – це маса молекули цієї речовини, виражена в а.о.м., дорівнює сумі атомних мас елементів, що входять до складу молекули. Відтак молекулярна маса речовини є також величиною відносною, безрозмірною. Так, молекулярна маса води дорівнює 15,99994+2*1,0079=31,0148 Наступною, дуже важливою одиницею, яку широко використовують в хімічних розрахунках, є моль. 14. Моль – це одиниця кількості речовини, являє собою таку кількість цієї речовини, яка містить стільки структурних одиниць (молекул, атомів, іонів, електронів), скільки атомів міститься в 12 г ізотопу Вуглецю Видатний італійський фізик і хімік Авогадро експериментально визначив, що 2 г ізотопу Вуглецю Для практичних розрахунків необхідно знати, яку масу має моль молекул, атомів. Тому введене поняття мольна (молярна) маса. 15. Мольна (молярна) маса – це маса одного моля, виражена в масових одиницях. Позначають буквою М, виражають у г/моль, кг/моль. Наприклад: МО=15,9994 г/моль, МО2=31,9988 г/моль, МН=1,0079 г/моль, МН2= 2,0158 г/моль. Речовини реагують між собою не довільно, а в строго певних (еквівалентних) відношеннях. У зв’язку з цим у хімію введенні поняття: хімічний еквівалент елемента і речовини. За еталон прийнято 1 моль атомів Водню. 16. Хімічний еквівалент елемента – це така його кількість, яка реагує (взаємодіє) з 1 молем атомів елемента Водню або заміщає 1 моль його атомів у хімічній реакції. Розмірність – частики моля елемента. Приклади 1. 2Н2+О2=2Н2О 2. Н2+О2=Н2О2 3. Zn+2HCl=ZnCl2+H2 У першій реакції хімічний еквівалент елемента Кисню дорівнює 0,5 моля елемента Кисню, у другій – 1,0 моль елемента Кисню. Хімічний еквівалент елемента Цинку дорівнює 0,5 моля елемента Цинку. 17. Хімічний еквівалент речовини – це така її кількість, яка взаємодіє в хімічній реакції з одним молем атомів елемента Водню або одним еквівалентом іншої речовини. Приклади: 1. H2+Cl2 =2HCl 2. NaOH+H2SO4=NaHSO4+H2O 3. 2NaOH+H2SO4=Na2SO4+2H2O У реакції (1) хімічний еквівалент речовини хлору дорівнює 0,5 моля речовини хлору; в реакції (2) хімічний еквівалент речовини H2SO4 дорівнює 1,0 моль речовини H2SO4, в реакції (3) – 0,5 моля речовини H2SO4. отже розмірність хімічного еквівалента – частки моля. Таким чином поняття хімічний еквівалент елемента чи речовини прямо зв’язаний з реакцією, в якій бере участь цей елемент чи речовина. Тому говорити про хімічний еквівалент без вказівки, в якій реакції бере участь цей елемент чи речовина, не можна. Хімічний еквівалент визначає мольні співвідношення між реагуючими речовинами. В інженерних розрахунках здебільшого оперують (користуються) масовими величинами. У зв’язку з тим введені поняття еквівалентна маса елемента і сполуки. 18. Еквівалентна маса елемента в речовині – це маса одного хімічного еквівалента елемента в речовині. Позначають Е, виражають в г/екв, кг/екв. Еквівалентну масу елемента в речовині (Еел) визначають за формулою
Де М – мольна маса елемента, г\моль
В – ступінь окиснення елемента (без знака). 19. Еквівалентна маса речовини – це маса одного хімічного еквівалента сполуки. Визначають еквівалентну масу сполуки (Есп) за формулою
Де М – мольна маса елемента, г\моль В, n – коефіцієнти, які залежать від природи речовини і реакції, в якій речовина бере участь. Як відомо, є чотири класи неорганічних сполук: оксиди, гідроксиди, кислоти і солі. Отже, для кожного класу сполук значення величини В і n буде інше.
Види хімічного зв'язку Хімічний зв'язок – це сукупність сил, що діють між атомами чи групою атомів. Внаслідок дії цих сил утворюються молекули. При обговоренні хімічного зв'язку зазвичай користуються терміном “валентність”. Дане поняття означає міру здатності елемента до утворення хімічного зв'язку. Хімічний зв'язок здійснюється в основному за рахунок так званих валентних електронів. Описати хімічний зв'язок – це означає з'ясувати, як розподіляється електронна щільність у молекулі. Розглянемо основні види зв'язків, за рахунок яких відбувається об'єднання атомів у молекули. Ковалентний зв'язок характеризується утворенням стійких електронних пар з електронів, які раніше належали до окремих атомів, котрі входять до складу молекул. Електрони, рухаючись молекулярними орбітами, найбільш часто розташовуються між ядрами, де створюється начебто надлишок негативного заряду, що сприяє зближенню атомів (рис. 1.1).
Якщо ж двоатомна молекула складається з атомів різних елементів, то електронна пара може бути зміщена до одного з атомів. У таких випадках ковалентний зв'язок називають полярним, а молекули з полярним зв'язком, у яких центри позитивних і негативних зарядів не збігаються, - полярними чи дипольними (рис.1.1, б). Дипольна молекула характеризується величиною електричного дипольного момента m, вимірюваного в Кл×м
де q - абсолютне значення заряду; l - відстань між центрами позитивного і негативного зарядів. Багатоатомні молекули також можуть бути неполярними – при симетричному розташуванні зарядів або полярними – при асиметричному. Приклади нейтральних (неполярних) і дипольних (полярних) молекул наведені на рис. 1.2 (а, б) відповідно. Як приклад речовин з полярним ковалентним зв'язком, можна навести молекули типу H2O, H2S, N2O5 і всіх кислот.
Речовини, утворені молекулами з ковалентним зв'язком, характеризуються високою твердістю. Вони є тугоплавкі й хімічно інертні, що пояснюється міцністю ковалентного зв'язку і його спрямованістю.
Іонний зв'язок спричинюється силами електростатичного притягання між позитивними і негативними іонами. Як приклади іонних сполук можна навести елементи, що дуже відрізняються за властивостями, наприклад типові метали і типові неметали. На рис. 1.3 показано іонний зв'язок на прикладі іонних кристалів хлористого цезію CsCl і титанату барію BaTiО3. Молекули речовини з іонним зв'язком є полярні. До речовин з іонним зв'язком належать більшість солей і деякі оксиди (Cu2O, ZnО, CdО, Fe2O3, NiО і ін.). Іонні сполуки за механічною міцністю і хімічною стійкістю поступаються речовинам, утвореним за допомогою ковалентного зв'язку, тому що іонний зв’язок є менш міцний, ніж ковалентний.
Отже, металевий зв'язок визначається водночас наявністю ковалентного зв'язку між нейтральними молекулами та електростатичним притяганням між іонами і вільними електронами, що в підсумку забезпечує монолітність і міцність металу. Завдяки наявності вільних електронів метали мають високу електро- і теплопровідність. Висока пластичність металів пояснюється відсутністю спрямова-ності металевого зв'язку. Міжмолекулярний зв'язок, чи зв'язок Ван-дер-Ваальса, спостерігається у низці речовин між молекулами з ковалентним характером усередині молекулярної взаємодії. Наявність міжмолекулярного притягання в цьому разі є можлива при погодженому русі валентних електронів у сусідніх молекулах (рис. 1.4, б). Тоді сили притягання валентних електронів ядром сусідньої молекули стають сильніше за сили взаємного відштовхування електронних оболонок цих молекул. Речовини з молекулярним характером зв'язку мають низькі температури плавлення (наприклад, у парафіна tпл = 50 – 52 оС). Це свідчить про те, що зв'язок Ван-дер-Ваальса є дуже слабкий.
Кристалічна будова речовини У твердих речовинах атоми і молекули розташовано в геометрично правильному порядку або в хаотичнім безладді. Відповідно до цього речовини, що мають геометрично упорядковане розташування атомів чи молекул, називають кристалічними, а речовини з хаотичним розташуванням атомів або молекул – аморфними.
Кристалічні решітки можна класифікувати як за виглядом часток, що їх утворюють, так і за формою елементарної комірки. Геометрично можливі 14 видів просторових решіток, що є основою шістьох систем кристалічних решіток (триклинна, моноклінна, ромбічна, гексагональна, тетрагональна, кубічна). Елементарні комірки деяких кристалічних систем подано на рис. 1.5, а співвідношення між їхніми осьовими кутами й осьовими одиницями наведені в табл. 1.1. Найважливішими параметрами кристала є розміри елементарної комірки; їх визначають як рівноважні відстані в напрямку характеристичних осей між центрами часток, що займають сусідні вузли решітки, і називають сталими решітки. Розміщення часток у просторових решітках здійснюється у такий спосіб, щоб забезпечити максимально можливу для даного типу кристала енергію їхнього зв'язку, а також енергетичну однорідність у цілому. Таблиця 1.1. Просторові решітки кристалічних систем.
Для часток сферичної форми найбільш сприятливим часто стає таке їх розміщення, при якому кожна сфера перебуває в зіткненні з найбільшим числом найближчих сусідів. Подібні просторові утворення називаються структурами найщільнішого упакування. У залежності від вигляду часток, що вони утворюють кристалічні решітки, розрізнюють атомні, іонні, металеві й молекулярні кристалічні решітки. У вузлах атомних решіток перебувають нейтральні атоми, що вони сполучені один з одним ковалентним зв'язком. Прикладами кристалів цього типу можуть слугувати алмаз, кремній, германій, сіре олово, а також кристали складних речовин, таких, як кварц, карбід кремнію, сульфід цинку, нітрид алюмінію. У вузлах іонних решіток розташовуються, чергуючись, позитивні й негативні іони. Вони сполучені один з одним іонним зв'язком. Прикладами кристалів, у яких переважує іонний тип зв'язку, можуть бути NaCl, Ca2, KF. Багато іонних кристалів належать до класу діелектриків. У вузлах металевих решіток розташовано позитивні іони, у проміжках між якими перебувають вільні електрони. Утворюються металеві решітки за допомогою металевого зв'язку. Стабільність кристала забезпечується силами притягання між позитивними іонами й електронним газом. Прикладами таких кристалів є метали та їхні сплави. За енергією кристалічних решіток метали займають проміжне становище між кристалами з атомними решітками і молекулярними решітками. Щільність більшості металів є значна, що свідчить про доволі щільну структуру металевих кристалів. З іншого боку, такі властивості металів, як високі ковкість і тягучість, указують на відсутність твердості в металевих решітках: їхні площини відносно легко зсуваються одна щодо іншої. У вузлах молекулярних решіток перебувають молекули. Такі решітки утворюються за рахунок ковалентного та іонного зв'язків. Молекули органічних сполук (полімерів) можуть мати витягнуту форму у вигляді зиґзаґоподібних скручених ланцюжків, сітчасту чи складну просторову форму. Аморфні речовини. Внутрішня побудова аморфних речовин характеризується безладним розташуванням атомів і молекул, тобто в них є відсутня кристалічна побудова. Вони поділяються на дві великі групи: а) прості аморфні речовини - низькомолекулярні рідини, неорганічні стекла, плавлений кварц; б) високополімерні сполуки - каучук, гуми, органічне скло, смоли. Аморфно-кристалічні речовини. Деякі речовини можуть перебувати як у кристалічному, так і в аморфному стані. Так, оксид кремнію SiО2 зустрічається в природі у вигляді кристалів кварцу, а також в аморфному стані у вигляді мінералу – опалу. Аморфний стан речовини є менш стійким, ніж кристалічний, тому є можливий спонтанний перехід речовини з аморфного стану в кристалічний. Прикладом такого перетворення є розстеклування - спонтанна кристалізація скла при підвищених температурах або тиску. У зв'язку з утворенням дрібних кристаликів скло змінює свої оптичні властивості і перетворюється на аморфно-кристалічний матеріал, який називається ситалом. Анізотропія кристалів Навіть найбільш упорядкована з розглянутих кристалічних решіток (кубічна) не має абсолютної просторової симетрії. Тому і властивості кристалів (електричні, магнітні, механічні, хімічні) залежать від напрямку, в якому вони розглядаються. Таку неоднаковість властивостей кристала в різних напрямках називають анізотропією. Якщо кристалічне тіло складається з одного великого кристала, тобто є монокристалічним, то воно має анізотропію властивостей. Ступінь анізотропії може бути значною. Наприклад, дослідження монокристала міді засвідчили, що межа міцності на розтягання змінюється від 120 до 360 МПа, а відносне подовження при розтяганні – від 10 до 55 %. Анізотропія кристалічних тіл виявляється тим сильніше, чим менше ступінь симетрії їхніх кристалічних решіток. Якщо тіло складається з великої кількості кристалів, тобто є полікристалічним, то за рахунок усереднення властивостей окремих кристалів властивості тіла в цілому не залежать від напрямку. Такий стан називають квазіізотропією. Анізотропія кристалів має важливе значення. За допомогою спеціальної обробки можуть бути отримані текстуровані матеріали з орієнтованим розташуванням кристалів, у яких виявляється анізотропія. Цю особливість можна використовувати, наприклад для виготовлення текстурованої сталі крупнокристалічної побудови, ребра кристалів якої розташовано паралельно напрямку прокатки. При намагнічуванні магнітні властивості сталі за напрямком прокаткування є вище, ніж за іншими напрямками. Властивості аморфних тіл не залежать від обраного напрямку, тобто аморфні тіла ізотропні. Наприклад, кристал кварцу, якщо його розплавити, після охолодження утворить так званий плавлений кварц, що він має властивості, цілком однакові в усіх напрямках і при цьому вони надто відрізняються від властивостей кристалічного кварцу. Поліморфізм (алотропія). Багато речовин, у залежності від умов кристалізації, можуть мати різні форми кристалічних решіток. Здатність речовини мати різні форми кристалічних решіток називають поліморфізмом, або алотропією. Поліморфні перетворення відбуваються головним чином під впливом температури, хоча не виключено вплив і інших факторів – зміни тиску, наявності сторонніх домішок. Сутність поліморфізму полягає в тому, що за певних температур у твердій речовині виникають нові центри кристалізації, в процесі зростання яких утворяться нові решітки. Різні поліморфні форми речовини називають модифікаціями і позначають початковими буквами грецького алфавіту (a, b, c, d тощо). Поліморфні перетворення відбуваються в кобальті, залізі, олові, титані, селені, фосфорі тощо. При зміні кристалічної структури змінюються і властивості речовини. Найбільш яскравим прикладом поліморфних перетворень є модифікації вуглецю. Графіт, що має гексагональну кристалічну решітку – м'який і крихкий матеріал, добре проводить електричний струм. Алмаз, кристалічна решітка якого складається з двох гранецентрованих кристалічних решіток, зсунутих одна відносно одної на 1/4 сталої кристалічної решітки a, є найтвердішою речовиною. Зонна теорія твердих тіл
При конденсації газоподібної речовини в рідину, а потім утворенні кристалічних решіток твердого тіла всі наявні в даному типі атомів електронні рівні (як заповнені, так і незаповнені електронами) дещо зміщуються внаслідок впливу сусідніх атомів один на одного. Таким чином, з окремих енергетичних рівнів відокремлених атомів у твердому тілі утвориться смуга, називана зоною енергетичних рівнів (рис. 1.9, б).
Розглянемо енергетичну діаграму вуглецю (рис. 1.10.). Його електронна формула: 1s22s22p2. В окремих атомах вуглецю 4 валентних електрони розміщуються по два на рівнях 2s та 2р. При зближенні атомів рівні розщеплюються на зони ємністю 2 та 6 електронів. При зближенні до відстані аг утворюється одна об'єднана не повністю заповнена зона ємністю 8 електронів на атом. Таке тіло (графіт) проводить електричний струм. Якщо міжатомна відстань зменшується до аа, то об'єднана зона розщеплюється на дві: кожна ємністю 4 електрони на атом. Ці зони розділені великою забороненою зоною (~ 5,3 еВ) і 4 валентних електрони розміщу-ються у нижній (валентній) зоні, заповнюючи її цілковито, а верхня зона є вільна, тобто таке тіло (алмаз) не має вільних електронів і є діелектриком. Висновки зонної теорії. Характер енергетичного спектра металевих провідників, напівпровідників та діелектриків є різний. У провідниках валентна зона заповнена або частково, або повністю і перекривається зоною провідності. У напівпровідниках та діелектриках зона провідності та валентна зона розділені забороненою зоною, а валентна зона заповнена повністю. Формально до діелектриків відносять речовини, які мають заборонену зону більш за 3 еВ. Діелектриками називають матеріали, в яких в енергетичному спектрі зона провідності та валентна зона розділяються забороненою зоною шириною не менше за 3 еВ. Тому теплові коливання атомів не можуть звільнити валентні електрони і вони мають дуже малу електронну провідність (рис. 1.11, а).
Напівпровідниками називають матеріали, які в енергетичному спектрі мають заповнену валентну зону та незаповнену зону провідності. Ці зони розділені забороненою зоною шириною від 0,1 до 3 еВ. Тому теплові коливання атомів можуть додати деяким електронам енергію, достатню, щоб стати вільними. Ось чому провідність напівпровідників надто залежить від зовнішніх факторів: температури, випромінювання, електричного поля та т.п. (рис.1.11, б). Провідниками називають матеріали в енергетичному спектрі яких валентна зона та зона провідності перекриваються, тому електрони у провідниках є вільні і вони добре проводять електричний струм (рис. 1.11, в). При температурі наближеній до абсолютного нуля, напівпровідники набувають властивостей діелектриків, тобто їхня електропровідність дорівнює нулю.
Пасивні діелектрики Полімерні вуглеводні. Полістирол - твердий прозорий матеріал. Є неполярним діелектриком, має високі електроізоляційні властивості. Полістирол – термопластичний діелектрик, який розм'якшується за температури 110¼120°С. Недоліками полістиролу є крихкість при знижених температурах, схильність до утворення поверхневих тріщин, мала стійкість до дії розчинників (зокрема до бензолу, толуолу, чотирихлористому вуглецю) і невисока нагрівостійкість. Крихкість і схильність до розтріскування значною мірою усунуті в ударостійких полістиролах, що являють собою суміш полістиролу з синтетичними каучуками. Ударостійкі полістироли відрізняються підвищеними значеннями ударної в'язкості і діелектричної проникності. Інші параметри практично залишаються на тому ж рівні, що й у звичайних видів полістиролу. У техніці полістирол застосовують головним чином як високочастотну ізоляцію. Ударостійкий полістирол застосовують для виготовлення каркасів індуктивних котушок, основ і ізоляторів для електровимірювальних приладів, корпусів радіоприймачів, телевізорів тощо. Поліетилен - неполярний, термопластичний діелектрик білого чи світло-сірого кольору, одержуваний внаслідок реакції полімеризації газу етилену. Поліетилен практично не є гігроскопічний, гнучкий. Електроізоляційні властивості поліетилену посідають такий самий високий рівень, що й полістирол. Завдяки високим електроізоляційним властивостям поліетилен знайшов широке застосування при виготовленні деталей радіотехнічної апаратури, електроізоляційних плівок, його використовують як ізоляцію в різних проводах і кабелях (радіочастотних, монтажних, наземних і підводних телефонних і ін.). Поліетилен застосовують при порівняно невисоких напругах. Поліпропілен - це лінійний неполярний полімер, одержуваний з газу пропілену СН2 = СН×СН3. Електроізоляційні властивості поліпропілену є аналогічні властивостям поліетилену. Однак поліпропілен є більш холодостійкий і гнучкий, ніж поліетилен. З поліпропілену можуть бути виготовлені плівки, волокна, тканини і фасонні вироби методом лиття під тиском. Поліпропілен можна застосовувати як комбінований паперово-плівковий діелектрик у силових конденсаторах, як плівковий діелектрик в обмотувальних проводах тощо. Полівінілхлорид -лінійний термопластичний полімер, отриманий у результаті полімеризації газоподібного мономера - вінілхлориду H2C=H-С1. Полівінілхлорид полярний діелектрик, що зумовлено асиметрією побудови його молекул через наявність атомів хлору. Внаслідок полярної побудови полівінілхлорид має знижені електричні властивості порівняно з неполярними полімерами, але відрізняється більшою стабільністю параметрів при зміні частоти, його питомий опір майже не змінюється при підвищенні температури аж до 90°С. Поряд з полівінілхлориддом (вініпластом) в електроізоляційній техніці широко застосовують пластифікований полівінілхлорид (пластикат). Пластикат має велику еластичність, більш високу холодостійкість (до -50°С), чим непластифікований полівінілхлорид. Його недоліком є значна залежність питомого об'ємного опору від температури. Полівінілхлоридний пластикат застосовують для виготовлення плівок, ізоляційних стрічок, трубок, монтажних і телефонних проводів тощо. При впливі електричної дуги полівінілхлорид виділяє велику кількість газоподібних продуктів, що сприяє гасінню дуги. Ця властивість використовується в так званих стріляючих розрядниках. Поліметилметакрилат (органічне скло, плексиглас) - це прозорий безбарвний матеріал, одержуваний внаслідок полімеризації ефірів метакрилової кислоти. Це полярний термопластичний діелектрик з малою гігроскопічністю і значною хімічною стійкістю. Органічне скло легко піддається механічній обробці і зварюється в спеціальних пристроях за температури 140¼150 °С із застосуванням тиску на поверхні приблизно 0,5¼1 МПа, склеюється полярними розчинниками. Застосовують органічне скло для виготовлення корпусів приладів, шкал, лінз тощо. Властивість виділяти при впливі електричної дуги велику кількість газів (С, Н2, пари H2O, CO2) додає органічному склу якості дугогасного матеріалу, тому його застосовують у розрядниках високої напруги, де потрібне швидке гасіння виниклої дуги. Фторорганічні полімери. Розглянемо політетрафторетилен, який одержують шляхом полімеризації тетрафторетилену F2C = CF2 і який має побудову молекули
Фторопласт-4 - білий чи сіруватий матеріал з більш високою щільністю, ніж щільність звичайних органічних полімерів. За електроізоляційними властивостями фторопласт-4 є кращим з відомих діелектриків. За хімічною стійкістю він перевищує благородні метали, що дозволило широко використовувати його при виготовленні ізоляції, яка працює в агресивних середовищах. Він зовсім негорючий, практично негігроскопічний, не змочується водою й іншими рідинами. До недоліків політетрафторетилену можна віднести його малу твердість і холодоплинність. Крім того, він має малу радіаційну стійкість і стійкість в зоні електричної дуги. Фторопласт-4 можна використовувати як пластичну масу, з нього виготовляють різні фасонні вироби: листи, гнучкі плівки, ізоляцію для монтажних проводів і кабельних виробів, у конденсаторному виробництві тощо. Широкому вживанню фторопласта-4 перешкоджає його висока вартість і складність технології. Ця обставина змусила розробити ряд різновидів фторопласта-4. Політрифторхлоретилен є полімером трифторхлоретилена F2С = CFCl, відомого за назвою фторопласт-3. Заміна в елементарній ланці одного атома фтору атомом хлору викликає з’яву дипольного моменту, через що фторопласт-3 стає полярним і має значні діелектричні втрати порівняно з фторопластом-4. Нагрівостійкість його є нижча, ніж у фторопласта-4 і становить 125 °С, нижня межа робочої температури становить -195°С. Технологія одержання фторопласта-3 простіше, він дешевше, ніж фторопласт-4, застосовується при виробництві низькочастотних кабелів. Компаунди Компаунди -це електроізоляційні матеріали, що складаються із суміші різних смол, бітумів, олій тощо. У момент застосування компаунди являють собою рідини, що поступово твердіють, перетворюючись на монолітний твердий діелектрик. Найбільшого поширення дістали синтетичні компаунди (епоксидні, кремнійорганічні, поліефірні тощо). До складу компаундів, крім основи, входять зазвичай наповнювачі та пластифікатори. Епоксидні компаунди являють собою продукти модифікації епоксидних смол. Вони відрізняються доброю адгезією до металів, кераміки, пластмас і до волокнистої ізоляції. Вони мають підвищену механічну міцність і малу об'ємну усадку (0,5¼2,5 %), що є важливе у виробництві напівпровідникових приладів і інтегральних схем. Епоксидні компаунди застосовують також як заливальні сполуки для створення литої ізоляції в різних типах трансформаторів, котрі працюють у складних умовах, блоків опорів тощо. Застосування такої ізоляції надає можливість вилучити громіздкі порцелянові й металеві деталі, які застосовувалися раніше для герметизації цих пристроїв. Асортимент епоксидних компаундів сьогодні є надто широкий. Так, у виробництві напівпровідникових приладів та інтегральних схем для герметизації кристалів з р - n -переходами широко застосовують епоксиднополіефірні, епоксидно-тиоколеві, епоксидно-каучукові й епоксиднокремнійорганічні компаунди. Неполярні плівки. Полістирольну плівку (ПС) одержують методом видавлювання розм'якшеного (при 140¼160 °С) полістиролу з одночасним розтяганням у подовжньому і поперечному напрямках. Промисловість випускає полістирольні плівки двох марок: ППСА - для конденсаторів і ППСБ - для кабелів і загальнопромислового застосування. Недоліком цієї плівки є порівняно невис
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.175.113 (0.097 с.) |



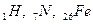
 - Протій,
- Протій,  - Дейтерій,
- Дейтерій,  - Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:
- Тритій. В ядрі Протію нейтронів немає; в ядрі Дейтерію – 1; в ядрі Тритію – 2 нейтрони. Для кальцію відомі три ізотопи:  ,
,  ,
,  .
.
 . Абсолютна маса атома ізотопу Вуглецю
. Абсолютна маса атома ізотопу Вуглецю 

 Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1, а). У неполярних молекулах центри позитивних та негативних зарядів збігаються.
Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1, а). У неполярних молекулах центри позитивних та негативних зарядів збігаються. m = ql, (1.1)
m = ql, (1.1)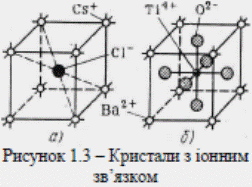 Донорно-акцепторний зв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs.
Донорно-акцепторний зв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs. Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а).
Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а). Кристалічні речовини. Більшість твердих речовин має кристалічну побудову. Кожна речовина зазвичай утворює кристали цілком певної форми. Зовнішня форма кристала відбиває його внутрішню побудову й зумовлена геометрично правильним розташуванням атомів чи молекул, що вони утворюють кристал. Це розташування атомів можна подати у вигляді просторових кристалічних решіток, що вони складаються з численної кількості сполучених одна з одною елементарних кристалічних комірок.
Кристалічні речовини. Більшість твердих речовин має кристалічну побудову. Кожна речовина зазвичай утворює кристали цілком певної форми. Зовнішня форма кристала відбиває його внутрішню побудову й зумовлена геометрично правильним розташуванням атомів чи молекул, що вони утворюють кристал. Це розташування атомів можна подати у вигляді просторових кристалічних решіток, що вони складаються з численної кількості сполучених одна з одною елементарних кристалічних комірок.
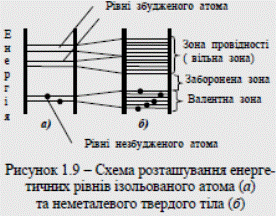 Усі тіла, в залежності від їхньої електропровідності за постійної напруги поділяють на діелектрики, провідники і напівпровідники. Різницю між ними можна показати за допомогою енергетичних діаграм зонної теорії твердих тіл. Як відомо з дослідження спектрів різних речовин у газоподібних станах, коли атоми відстоять один від одного на великих відстанях, для кожної речовини є характерні цілком певні спектральні лінії. Це свідчить про наявність певних енергетичних рівнів (станів) для різних атомів. Частина цих рівнів заповнена при нормальному, незбудженому стані атома, на інших рівнях електрони можуть перебувати лише тоді, коли атом підлягає зовнішньому енергетичному впливу, тобто коли він збуджений. Прагнучи до стійкого стану, атом випромінює надлишок енергії в момент переходу зі збуджених рівнів на рівні, де його енергія є мінімальна. Це можна проілюструвати енергетичною діаграмою атома, наведеною на рис. 1.9, а.
Усі тіла, в залежності від їхньої електропровідності за постійної напруги поділяють на діелектрики, провідники і напівпровідники. Різницю між ними можна показати за допомогою енергетичних діаграм зонної теорії твердих тіл. Як відомо з дослідження спектрів різних речовин у газоподібних станах, коли атоми відстоять один від одного на великих відстанях, для кожної речовини є характерні цілком певні спектральні лінії. Це свідчить про наявність певних енергетичних рівнів (станів) для різних атомів. Частина цих рівнів заповнена при нормальному, незбудженому стані атома, на інших рівнях електрони можуть перебувати лише тоді, коли атом підлягає зовнішньому енергетичному впливу, тобто коли він збуджений. Прагнучи до стійкого стану, атом випромінює надлишок енергії в момент переходу зі збуджених рівнів на рівні, де його енергія є мінімальна. Це можна проілюструвати енергетичною діаграмою атома, наведеною на рис. 1.9, а. Найверхню із заповнених електронами зон називають валентною. Ця зона відповідає енергетичним рівням електронів зовнішньої оболонки атомів. Найближчу до неї вільну від електронів зону називають зоною провідності. Зона, яка розділяє валентну зону та зону провідності, - заборонена зона. Щоб валентний електрон зробити вільним, треба прикласти до нього енергію, більшу за ширину забороненої зони.
Найверхню із заповнених електронами зон називають валентною. Ця зона відповідає енергетичним рівням електронів зовнішньої оболонки атомів. Найближчу до неї вільну від електронів зону називають зоною провідності. Зона, яка розділяє валентну зону та зону провідності, - заборонена зона. Щоб валентний електрон зробити вільним, треба прикласти до нього енергію, більшу за ширину забороненої зони.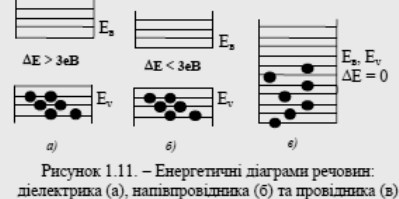
 Через симетричне розташування атомів у молекулах політетрафторетилен є неполярний. Цей матеріал відомий за назвою фторопласт-4. Цифра 4 вказує на число атомів фтору в молекулі мономера. Фторопласт-4 має надто високу для органічної речовини нагрівостійкість (порядку +250 °С), що зумовлено великою енергією зв'язку між вуглецем та фтором і екрану ючим впливом атомів фтору на зв’язок між атомами вуглецю.
Через симетричне розташування атомів у молекулах політетрафторетилен є неполярний. Цей матеріал відомий за назвою фторопласт-4. Цифра 4 вказує на число атомів фтору в молекулі мономера. Фторопласт-4 має надто високу для органічної речовини нагрівостійкість (порядку +250 °С), що зумовлено великою енергією зв'язку між вуглецем та фтором і екрану ючим впливом атомів фтору на зв’язок між атомами вуглецю.


