
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электроды с твёрдой мембраной
Мембрана это монокристалл или прессованная таблетка из малорастворимой соли, в которой один из элементов обладает высокой подвижностью. Мембранная пластинка разделяет внутренний раствор (in), содержащий стандартный раствор, с постоянной концентрацией определяющего вещества, и наружный раствор (out), с изменяющейся концентрацией определяющего вещества. Наиболее распространённы сульфидные Me Пример: Мембрана на основе Ag2S. В кристалле Ag2S ионы Ag+ обладают высокой подвижностью и при этом способны: проводить электрический ток внутри кристалла и выходить из кристалла в окружающий раствор. При этом ионы S2- будут оставаться внутри кристаллической структуры. При погружении электрода в раствор, содержащий Ag+ по обе стороны мембраны, на границах возникает обратимый процесс выхода ионов Ag+ из мембраны: Ag2S↔AgS
Потенциал, возникший на границе раздела фаз, является граничным потенциалом, он описывается уравнением Нернста для стороны in: для стороны out: jin и jout – некий постоянный потенциал зависящий от состояния мембраны; a(Ag+)in и a(Ag+)out – соответственно активность Ag+ в растворе; a(Ag+)мембр – активность Ag+ внутри мембраны. Разница граничных потенциалов по разные стороны мембраны являться трансмембранным потенциалом, который можно определить, погрузив два электрода сравнения по разные стороны мембраны (рис. 22). E = Eout – Ein Т. к. состояние поверхности с обеих сторон мембраны одинаково, то величины j и a(Ag+) соответственно равны и трансмембранный потенциал равен:
Конструктивно электрод сделан так, что внутренняя концентрация ионов Ag+ неизменна, т.е. a(Ag+)in = const, поэтому потенциал электрода зависит только от концентрации Ag+ во внешнем растворе и равен:
Электрод с мембраной из Ag2S используется для определения сульфид ионов. При наличии в растворе ионов S 2- примембранная концентрация Ag+ во внешнем растворе, исходя из уравнения диссоциации Ag2S и ПРAg
Ag2S ↔ 2Ag+ + S2- ПРAg равна:
Подставив значения [Ag+] в уравнение Нернста, получим:
учитывая, что ПРAg
Пример: Электрод, на основе Ag2S в матрицу которого включен сульфид другого металла (например, CdS) Его потенциал зависит и от концентрации в растворе включённых катионов. Электродными процессами в этом случае являются выход из мембраны ионов Ag+ и процесс растворения Ag2S и CdS: Ag2S ↔ 2Ag+ + S2- CdS ↔ Cd2+ + S2-. Исходя из ПР Ag
Концентрация
то концентрация иона S2- в растворе исходя из ПРCdS равна:
Подставим уравнение (2) уравнение (1) тогда получим:
Подставим полученное значение концентрации ионов Ag+ уравнение (3) в уравнение Нернста, тогда:
Т.к. ПРAg
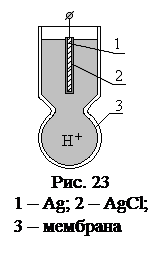
Стеклянные электроды Стеклянный электрод состоит из хлорсеребряного электрода, помещенного в стеклянную трубку с шариком (мембраной) из специального стекла с высоким содержанием щелочных компонентов и наполненного раствором HCl с концентрацией Н+ 0,1 моль/л (рис. 23). Перед применением стеклянный электрод вымачивают в воде. При вымачивании происходит образование гидратированного геля на поверхности мембраны, за счёт обмена щелочных ионов, входящих в структуру стекла на ионы водорода присутствующие в растворе:
Учитывая, что равновесие реакции (I) смещено вправо, поверхность мембраны при вымачивании практически полностью представляет собой слой гидратированного геля (геля кремнистой кислоты) (II). Ионы Н+ могут обратимо десорбироваться с поверхности геля (III), при этом поверхность стекла будет заряжаться отрицательно, за счёт анионов кремнистой кислоты.
Чем выше концентрация ионов Н+ в растворе, тем меньше будет величина отрицательного заряда на поверхности мембраны, и, следовательно тем большим будет величина граничного потенциала на поверхности мембраны и наоборот.
При погружении в растворы индифферентных электродов по разные стороны мембраны можно измерить трансмембранный потенциал. Величина трансмембранного потенциала представляет собой разность граничных потенциалов по разные стороны мембраны Е=Еout-Ein, он описывается уравнением Нернста: E=E0 + 0,059·lg Т. к. конструктивно [ H+ ] in =const; то потенциал стеклянного электрода равен: E=E Т. к. - lg [ H+ ] =рН, то: E=E Линейная зависимость потенциала стеклянного электрода от рН наблюдается в интервале от 0¸12-13 рН. В более щелочных средах начинает преобладать процесс абсорбции щелочных металлов на поверхности мембраны и нарушается зависимости потенциала от рН.
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 233; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.107.241 (0.007 с.) |
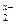 Sx (Mex+ = Ag+, Cu2+, Pb2+, Cd2+) и фторидные (LaF3) мембраны.
Sx (Mex+ = Ag+, Cu2+, Pb2+, Cd2+) и фторидные (LaF3) мембраны. +Ag+
+Ag+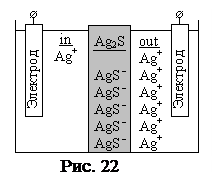 Поверхность мембраны при этом заряжается отрицательно, возникает двойной электронный слой (рис. 22), препятствующий дальнейшему растворению мембраны, т.е. наступает состояние равновесия. При возрастании СAg
Поверхность мембраны при этом заряжается отрицательно, возникает двойной электронный слой (рис. 22), препятствующий дальнейшему растворению мембраны, т.е. наступает состояние равновесия. При возрастании СAg  процесс смещается влево, т.е. тормозится, при этом уменьшается отрицательный заряд на поверхности мембраны.
процесс смещается влево, т.е. тормозится, при этом уменьшается отрицательный заряд на поверхности мембраны.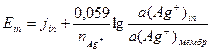 ;
; , где
, где
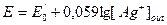
 S
S .
.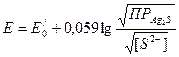 ;
; , тогда потенциал электродана основе Ag2S равен:
, тогда потенциал электродана основе Ag2S равен: .
. . (1)
. (1)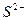 зависит и от концентрации
зависит и от концентрации  в растворе, а она определяется ПРCdS. Т. к.
в растворе, а она определяется ПРCdS. Т. к.
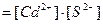 ,
,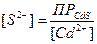 (2)
(2)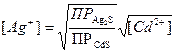 . (3)
. (3)
 получим потенциал электрода на основе мембраны из Ag2S с включением CdS.
получим потенциал электрода на основе мембраны из Ag2S с включением CdS.
 (I)
(I) (II).
(II).
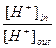 ;
; + 0,059·lg [ H+ ] out
+ 0,059·lg [ H+ ] out


