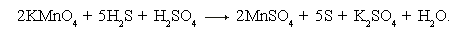Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Донской казачий государственный институт пищевых технологий и экономикиСтр 1 из 6Следующая ⇒
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное Учреждение высшего образования «Московский государственный университет технологий и управления имени К.Г. Разумовского (Первый казачий университет)» Донской казачий государственный институт пищевых технологий и экономики (филиал) ФГБОУ ВО «МГУТУ имени К.Г.Разумовского (ПКУ)»
Н.П. Вассель НЕОРГАНИЧЕСКАЯ ХИМИЯ Лабораторный практикум
Ростов-на-Дону
Печатается по решению кафедры химии и биологии ДКГИПТиЭ (филиала) МГУТУ в г. Ростове-на-Дону Протокол № 8 от 22.04.2016г
Н.П. Вассель Неорганическая химия. Лабораторный практикум. Ростов-на-Дону: электронная версия, 2016. – 29с. Лабораторный практикум предназначается для студентов бакалавриата по направлениям подготовки: 19.03.02. 19.03.04, 38.03.07.
Лабораторная работа 1. Ионные реакции обмена Ионы в растворе появляются в результате электролитической диссоциации (распад молекул па ионы под действием полярных молекул растворителя). Вещества, подвергающиеся электролитической диссоциации и проводящие электрический ток, называются электролитами. Вещества, не подвергающиеся электролитической диссоциации и не проводящие электрический ток, называются неэлектролитами. Экспериментальная часть Опыт 1. Получение малорастворимых веществ.
а) В одну пробирку внесите 5—6 капель сульфата меди, в другую — хлорида железа (III). Добавьте в обе пробирки по 5—6 капель 2 н. раствора гидроксида натрия. Наблюдение. Укажите цвет полученного осадка. Вывод. Объясните, почему протекает данная реакция. б) К 5—6 каплям раствора нитрата (хлорида) бария добавьте несколько капель 2 н. раствора серной кислоты. Наблюдение: Вывод: в) К 2—3 каплям раствора нитрата серебра добавьте 2—3 капли раствора хлорида натрия. Наблюдение: Вывод: г) К раствору нитрата свинца прилейте раствор иодида калия. Наблюдение: Вывод: Приведите уравнения реакции в молекулярном, ионном полном и сокращенном виде. Опыт 2. Реакции с образованием газов а) К 10-15 каплям раствора карбоната натрия добавьте несколько капель 2 н. раствора серной кислоты. Наблюдение: Вывод: б) В пробирку поместите 2 микрошпателя хлорида аммония (сухая соль) и добавьте 5—6 капель 2 н. раствора гидроксида натрия. Определите по запаху, какой газ выделяется. Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Опыт 3. Реакции с образованием малодиссоциирующих веществ а) Поместите в пробирку 2 микрошпателя ацетата натрия (сухая соль) и добавьте 10—15 капель раствора соляной кислоты (2 и.). Определите позапаху, какое соединение получилось. Наблюдение: Вывод: б) Реакция нейтрализации. Налейте в пробирку воды на одну треть ее объема. Добавьте 2 капли индикатора метилового оранжевого. Какова реакция среды в пробирке? В какой цвет окрасился индикатор? Добавьте туда же несколько капель серной кислоты. Как изменился цвет индикатора? Прибавляйте в пробирку по капле 2 н. раствор гидроксида натрия до тех пор, пока среда раствора в пробирке не станет нейтральной. Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Опыт 4. Реакции с образованием комплексных соединений В двух пробирках получите осадок гидроксида цинка. Раствор каких веществ надо взять для этой цели? В одну из пробирок с осадком налейте избыток раствора гидроксида натрия, в другую — раствор кислоты. Что происходит с осадком в обеих пробирках?
Наблюдение: Вывод: Приведите уравнения реакций в молекулярном, ионном полном и сокращенном виде. Лабораторная работа 2. Гидролиз солей Гидролиз солей Гидролизом называют реакции взаимодействия вещества с водой, приводящие к образованию слабодиссоциирующих веществ: слабых кислот или оснований, кислых или основных солей. Реакции гидролиза солей тоже относятся к реакциям ионного обмена. Эти реакции протекают за счет обмена между ионами растворимой соли и полярным растворителем – водой, молекула которой является диполем Н+– ОН–. Результат гидролиза можно расценивать как нарушение равновесия диссоциации молекул воды за счет связывания либо ионов водорода либо ионов гидроксидной группы с ионом слабого электролита.. Рассмотрим важнейшие случаи гидролиза солей. 1. Соли образованные сильным основанием и слабой кислотой, т.е. соли типа KCN, CH3COONa, Na2CO3, K2CO3, Na2S, CaS, Na2SO3 и т.п. KCN + HOH CN-– + HOH Продукты реакции: KOH – щелочь, хорошо диссоциирующая в водном растворе, а HCN – кислота слабая (α= 0,001), распадающаяся на ионы лишь в очень малой степени. Раствор приобретает щелочную реакцию, т.е. pH > 7. Соли, содержащие многозарядные ионы, гидролизуются по стадиям: На первой стадии образуется кислая соль: Na2CO3+ HOH CO32-+HOH На второй стадии образуются молекулы кислоты: NaHCO3 + НOH HCO3-+HOH Считают, что при стандартных условиях и умеренном разбавлении раствора гидролиз солей протекает по первой стадии. 2. Соли образованные слабым основанием и сильной кислотой. Сюда относятся NH4Cl, NH4NO3, ZnCl2, CuSO4, Mn(NO3)2, AlCl3 и др. В этом случае в процессе гидролиза главную роль играет катион соли. Анион же последней не связывает водородных ионов воды и практически в реакции гидролиза не участвует NH4Cl + HOH NH4 ++ HOH Продукты реакции: NH4OH – основание слабое, малодиссоциирующее; HCl– кислота сильная, распадается на ионы в высокой степени. Вследствие этого раствор приобретает кислую реакцию, т.е. pH < 7. Как и в предыдущем случае, соли многозарядных ионов гидролизуются по стадиям. На первой стадии образуются основная соль: Mn(NO3)2 + HOH Mn2+ + HOH На второй стадии образуются молекулы основания: MnOHNO3 + HOH MgnOH+ + HOH Как правило, вторая стадия гидролиза незначительна. 3. Соли образованные слабым основанием и слабой кислотой. Сюда можно отнести такие соли, как NH4CN, CH3COONH4. В этом случае в гидролизе участвуют и катионы, и анионы; они связывают и водородные, и гидроксид-ионы воды, образуя слабые электролиты (слабые кислоты и слабые основания). Соли этого типа полностью разлагаются водой: NH4CN + HOH NH4+ + CN– + HOH Соли многозарядных ионов гидролизуются ступенчато: Первая стадия: (NH4)2 S + HOH NH4++ HOH S2– + HOH Вторая стадия: NH4HS + HOH НS– + HOH Вторая стадия гидролиза незначительна. Реакция раствора соли может быть либо слабо кислой (если основание, образовавшееся в результате гидролиза, является более слабым, чем кислота), либо слабо щелочной (если основание окажется более сильным, чем кислота), либо будет нейтральной (если основание и кислота проявляют одинаковую силу). При повышении температуры раствора гидролиз соли сильно возрастает, это связано с тем, что при нагревании возрастает степень диссоциации воды. Это усиливает взаимодействие ионов H+ и OH– с ионами соли.
Необратимому гидролизу с образованием нерастворимых в воде гидроксидов (или гидроксосолей) и выделением газа подвергаются сульфиды и карбонаты некоторых металлов (Cr3+, Al3+, Fe3+, Co2+, Cd2+, Zn2+, Mn2+, Ni2+ и др.). Например: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S; 2CdCO3 + H2O = (CdOH)2CO3↓ + CO2; Cr2(CO3)3 + 3H2O = 2Cr(OH)3↓ + 3CO2. 4. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются: NaCl, KJ, Na2SO4, Ba(NO3)2 и т. д. Изучив теоретический материал, приступают к экспериментальной части. Экспериментальная часть Опыт 1. Реакции среды растворов различных средних солей В шесть пробирок добавьте по одному микрошпателю солей: в первую – ацетата натрия CH3COONa, во вторую – хлорида алюминия AlCl3, в третью – силиката натрия Na2SiO3, в четвертую – карбоната аммония (NH4)2CO3, в пятую – хлорида калия KCl. Одну из пробирок оставьте в качестве контрольной. Во все пробирки на 1/3 объема налейте дистиллированной воды и по 5 капель лакмуса. Размешайте раствор в каждой пробирке стеклянной палочкой. Наблюдения: Вывод: Напишите уравнение гидролиза солей в ионно-молекулярном виде. Опыт 2. Особые случаи полного (необратимого) гидролиза В две пробирки налейте по 1 мл хлорида алюминия. В одну из пробирок добавьте такой же объем раствора сульфида аммония, в другую – раствора карбоната натрия. Наблюдают в обеих пробирках выпадение осадка гидроксида алюминия, сопровождающееся в первом случае выделением газообразного сероводорода (отметьте запах), во втором – пузырьков диоксида углерода. Наблюдения: Вывод: Напишите молекулярные и ионные уравнения реакций. Лабораторная работа 3. Химическая кинетика и равновесие Экспериментальная часть Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ. Эту зависимость изучим на примере реакции: Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O Приготовить в 4-х пробирках растворы различной концентрации
К каждому раствору добавить поочередно по 1 капле 2н. раствора серной кислоты, перемешивая. Отметить по секундомеру время появления мути.
Полученные результаты записать в таблицу, вычислив относительную скорость. Построить график зависимости скорости реакции от концентрации. Наблюдения: Лабораторная работа 4. Окислительно-восстановительные реакции Степень окисления Для характеристики состояния атома в молекуле используют понятие «степень окисления».
Для определения степени окисления существуют следующие правила.
• Некоторые элементы во всех сложных веществах имеют постоянную степень окисления: Рассмотрим несколько примеров расчета степеней окисления различных атомов в молекулах сложных веществ. • Определить степень окисления марганца в соединении Mn2O7. • Определить степень окисления хрома в дихромате калия К2Сr2O7. • Определить степень окисления хрома в молекуле Cr2(SO4)3. 4 .2. Окислительно-восстановительные реакции (ОВР)
Изменение степени окисления связано с переходом электронов от одних атомов к другим.
Метод электронных уравнений Пример. Ответ. • Видно, что степень окисления изменилась у марганца и серы: марганец был +7, стал +2, сера была –2, стала 0. • Отражаем эти изменения степени окисления в электронных уравнениях и определяем элемент-окислитель и элемент-восстановитель:
Слева от электронных уравнений проводим вертикальную черту и проставляем коэффициенты, соответствующие числу электронов, отданных восстановителем и принятых окислителем. Множители перед вертикальной чертой «5» и «2» и есть основные коэффициенты перед окислителем и восстановителем. • Переносим найденные основные коэффициенты при восстановителе и окислителе в заданную схему реакции:
• Находим коэффициенты при других реагирующих веществах в следующем порядке: металлы, кислотные остатки (или неметаллы), водород, кислород. • Правильность подбора коэффициентов проверяем равенством атомов кислорода в обеих частях уравнения: 2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + 5S + K2SO4 + 8H2O. Обычно этот метод применим для уравнивания ОВР, протекающих между газообразными, твердыми или жидкими веществами без их электролитической диссоциации. Если реакция протекает в растворе используют метод ионно-электронный или метод полуреакций.
Опыт 1. Влияние среды на продукты ОВР а) Налить в пробирку 10 капель перманганата калия, подкислить 5 каплями серной кислоты и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: б) Налить в пробирку 10 капель перманганата калия, создать щелочную среду добавив 5 капель гидроксида натрия и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: в) Налить в пробирку 10 капель перманганата калия и добавить один микрошпатель сульфита натрия. Наблюдения: Вывод: Составить уравнение реакции, уравнять методом электронного (электронно-ионного) баланса. Опыт 2. Окислительные свойства дихромат иона а) Налить в пробирку 10 капель дихромата калия, подкислить 5 каплями серной кислоты и добавить один микрошпатель сульфата железа (II). Наблюдения: Вывод: б) Налить в пробирку 10 капель дихромата калия, подкислить 5 каплями серной кислоты и добавить 5 капель иодида калия. Наблюдения: Вывод: Составить уравнение реакции, уравнять методом электронного (электронно-ионного) баланса. Литература 1. Коровин Н.В. Общая химия — М: Академия, 2011. 2. Гельфман М.И. Неорганическая химия. -С.Пб., Лань. 2007 3. Вассель Н.П. Неорганическая химия: Учебно-методическое пособие. Курс лекций. Ростов н/Д, 2001 4. Вассель Н.П. Комплексные соединения: Учебно-методическое пособие. Ростов н/Д, 2001. 5. Вассель Н.П. Химическая кинетика и равновесие: Методические указания по выполнению лабораторных работ. Ростов н/Д, 2001. 6. Вассель Н.П. Гидролиз солей: Методические указания по выполнению лабораторных работ. Ростов н/Д, 2001.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное Учреждение высшего образования «Московский государственный университет технологий и управления имени К.Г. Разумовского (Первый казачий университет)» Донской казачий государственный институт пищевых технологий и экономики (филиал) ФГБОУ ВО «МГУТУ имени К.Г.Разумовского (ПКУ)»
Н.П. Вассель НЕОРГАНИЧЕСКАЯ ХИМИЯ Лабораторный практикум
Ростов-на-Дону
Печатается по решению кафедры химии и биологии ДКГИПТиЭ (филиала) МГУТУ в г. Ростове-на-Дону Протокол № 8 от 22.04.2016г
Н.П. Вассель Неорганическая химия. Лабораторный практикум. Ростов-на-Дону: электронная версия, 2016. – 29с. Лабораторный практикум предназначается для студентов бакалавриата по направлениям подготовки: 19.03.02. 19.03.04, 38.03.07.
Лабораторная работа 1. Ионные реакции обмена Ионы в растворе появляются в результате электролитической диссоциации (распад молекул па ионы под действием полярных молекул растворителя). Вещества, подвергающиеся электролитической диссоциации и проводящие электрический ток, называются электролитами. Вещества, не подвергающиеся электролитической диссоциации и не проводящие электрический ток, называются неэлектролитами.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.62.103 (0.084 с.) |
 HCN + KOH
HCN + KOH .
. степень окисления водорода равна –1, а в пероксидах
степень окисления водорода равна –1, а в пероксидах  – степень окисления кислорода –1.
– степень окисления кислорода –1. равен –6, а так как молекула Cr2(SO4)3 электронейтральна, то на два атома хрома приходится суммарный заряд +6, а на один атом +3 (что и является его степенью окисления).
равен –6, а так как молекула Cr2(SO4)3 электронейтральна, то на два атома хрома приходится суммарный заряд +6, а на один атом +3 (что и является его степенью окисления).