
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Деградація енергії при протіканні необоротних процесів в ізольованих системах
Всі реально протікаючи процеси – необоротні, і в кожному випадку безповоротність є причиною зниження досконалості процесу. Це відбувається не через втрату енергії, а через пониження її якості, оскільки в необоротних процесах енергія не зникає, а знецінюється. Так, наприклад, дроселювання робочого тіла, не змінює його енергії (iн=iк), а знижує її придатність до здійснення роботи при використовуванні в теплообмінниках. Таким чином, кожне необоротне явище – це причина безповоротної втрати енергії. Оскільки всяка безповоротність приводить до зменшення корисної роботи, тоді збільшення ентропії ізольованої системи через безповоротність протікаючих в ній термодинамічних процесів може служити мірою втрати максимально корисної роботи lmax, Дж/кг, яку могла б здійснити система при протіканні в ній оборотних термодинамічних процесів. При необоротних термодинамічних процесах втрачена робота мимовільно перетворюється на теплоту, яка також мимовільно переходить до тіл з більш низькою температурою, збільшуючи їх ентропію (а отже, і системи) на значення Тоді, згідно рівнянню (5.7) необхідне перетворення роботи в теплоту
де Т0 – нижча температура в ізольованій системі (при аналізі термодинамічних процесів за таку температуру приймають температуру навколишнього середовища), К
Вираження (8.1), що характеризує втрату максимальної роботи (працездатності) через безповоротність, носить назву рівняння Гюї – Стодоли. Тоді фактично корисна робота l0, Дж/кг, з урахуванням рівняння (8.1) виражатиметься рівнянням
Максимально можливу роботу, яку може вчинити система, що складається з джерела енергії і навколишнього середовища, називають ексергією е, Дж/кг (е=lmax). У найзагальнішому значенні ексергія речовини є максимальна робота, яку вона може вчинити в оборотному процесі з навколишнім середовищем як джерело дармової теплоти, якщо в кінці цього процесу всі види матерії, що беруть участь в ньому, переходять в полягання термодинамічної рівноваги зі всіма компонентами навколишнього середовища.
Ексергія ділиться на два основні вида: ексергія видів енергії, що не характеризуються ентропією, для яких вона дорівнює самій енергії Е, Дж/кг, е=Е (механічна, електрична і ін.), і ексергія видів енергії, що характеризуються ентропією (внутрішня енергія, енергія випромінювання, термомеханічна, нульова). Ексергія останніх видів енергії підрозділяється на ексергию речовини в замкнутому об'ємі, эксергию потоку речовини і ексергию потоку енергії. Ексергія речовини в замкнутому об'ємі складається з термомеханіческої і нульової. Ексергія потоку енергії складається з эксергиї теплового потоку і эксергиї випромінювання. Ексергія речовини в замкнутому об'їм еv, Дж/кг, розглядається в закритих системах. Визначимо термомеханічну ексергію речовини в замкнутому об'ємі, тобто максимальну роботу яку може здійснити речовина з початковими параметрами p, v, T, u, i, s при оборотному процесі в рівновагу з навколишнім середовищем, коли його параметри матимуть значення p0, v0, T0, u0, i0, s0. Для того, щоб речовина перейшла в рівновагу з навколишнім середовищем, необхідно змінити його внутрішню енергію за рахунок підведення (або відведення) до нього теплоти або за рахунок здійснення ним роботи, оскільки відповідно до першого закону термодинаміки
У оборотному процесі підводу теплоти до речовини або відведення від нього теплоти в оточуючу середовище відбувається при постійній температурі, рівній температурі навколишнього середовища Т0, тобто
Тоді ексергія речовини в замкнутому об'ємі буде рівна роботі за вирахуванням роботи, що затрачується речовиною на подолання їм тиску навколишнього середовища, т.е
де
і отже ev є параметром стану речовини і середовища – ексергичною функцією. Для визначення термомеханіческої ексергії потоку речовини е, Дж/кг, вимагається знайти її максимальну роботу при оборотному переході від даного стану, що характеризується параметрами p, v, T, u, i, s до рівноважного стану з середовищем, тобто з параметрами p0, v0, T0, u0, i0, s0. Очевидно, ексергія потоку речовини відрізняється від ексергії речовини в замкнутому об'ємі на величину роботи, пов'язаної з переміщенням потоку. Для кінцевої зміни стану ця робота буде рівна роботі за вирахуванням роботи, що витрачається на подолання тиску середовища
Зазвичай в розрахунках визначають різницю величин Δev і Δe в двох станах системи.
Ексергія теплового потоку eq, Дж/кг,
де У окремому випадку при T=idem і
Функція має універсальне значення: вона придатна для оцінки максимальної працездатності в кругових і розімкнених термодинамічних процесах. Можна довести, що частинна похідна термомеханічної ексергії потоку по ентальпії при постійному тиску рівна τе, тобто
Оскільки
тобто зміна ексергії потоку робочого тіла в ізобарному процесі рівна ексергії eq пов'язаного з цим процесом теплового потоку. Отже, у всіх процесах теплообміну, що протікають при постійному тиску, ексергію теплового потоку можна обчислювати по різниці ексергій потоку речовини Δе. Це значно спрощує розрахунки, коли точний розрахунок безпосередньо eq є трудомістким, як, наприклад, при змінній температурі. Ексергія випромінювання eε її визначається максимальною роботою, яка може бути здійснена в оборотному процесі приведення цього випромінювання в стан рівноваги з навколишнім середовищем (при Т0). Її обчислюють за рівнянням
де ε – ступінь чорноти поверхні; С0 – коефіцієнт випромінювання абсолютно чорного тіла, Вт/(м2 К4).
Ексергічні діаграми стану
Ексергічні діаграми широко застосовуються при термодинамічному аналізі енерготехнологічних схем: з них безпосередньо визначаються величини е, еq і їх складові для різних речовин і їх сумішей, значення τе при заданих значеннях Т і Т0, а також наочно і просто проводяться рішення відповідних задач. Серед відомих ексергічних діаграм найбільше поширення набули наступні: is- і Ts-діаграми з лініями e=idem і ei-діаграма.
Завдання на самостійну роботу:
1. Ізохорний, ізобарний, ізотермічний, адиабатный процеси. на діаграмі T – s; 2. Цикл Карно; 3. Зміна ентропії ідеального газу при постійній теплоємності.
Питання для самоперевірки:
1. У чому полягає основна властивість діаграми T – s? 2. Як зображаються основні термодинамічні процеси на діаграмі T – s? 3. Як визначити Δu, Δi, l, q на діаграмі T – s? 4. Графічне зображення циклу Карно на діаграмі T – s? 5. Що таке эксергія? 6. Рівняння Гюї – Стодоли?
Лекція 7 Тема: Ексергічній аналіз. Ексергічні баланси енергохіміко-технологічних систем (ЕХТС) План лекції:
7.1.Методи термодинамічного аналізу ЕХТС; 7.1.1.Ентропійний метод (метод циклів) термодинамічного аналізу; 7.1.2. Енергетичний метод термодинамічного аналізу ЕХТС; 7.2. Ексергічні баланси энергохіміко-технологічних систем (ЕХТС); 7.3. Види ексергічних втрат; 7.4. Вторинні енергоресурси хімічної технології.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 177; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.109.141 (0.015 с.) |
 , Дж/(кг К).
, Дж/(кг К). , Дж/кг, можна записати у вигляді
, Дж/кг, можна записати у вигляді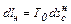 (6.1)
(6.1) (6.2)
(6.2)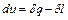
 .
. (6.3)
(6.3) ,
, (6.4)
(6.4) . (6.5)
. (6.5) (6.6)
(6.6) називається ексергичною температурною функцією.
називається ексергичною температурною функцією.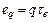 (6.7)
(6.7)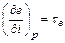 (6.8)
(6.8) або,
або,  то з рівнянь (6.6) і (6.7) витікає, що
то з рівнянь (6.6) і (6.7) витікає, що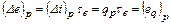 , (6.9)
, (6.9) (6.10)
(6.10)


