
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізичні та хімічні властивості синильної кислоти. ⇐ ПредыдущаяСтр 8 из 8
Синильна кислота – розчин ціаністого водню HCN в воді. У зв'язаному вигляді ціанистий водень (амигдалін) вміщується в кісточках мигдалю, персиків, абрикосів, слив та вишень (0,8-3,5 % за масою); амигдалін розщеплюється на виноградний цукор, бензальдегід і вільну синильну кислоту. Ціанистий водень знайдено у спектрах зірок. Синильна кислота - продукт промислового синтезу; у світі її виробляється більше 0,5 млн т/рік. Вона використовується для отримання ціанистих солей, виготовлення сорбентів для екстракції золота і інших благородних металів з руди, синтетичних волокон, пластичних мас, оргскла, стимуляторів росту рослин, гербіцидів, добрив довготривалої дії, для одержання ціанідів лужних і лужноземельних металів. Використання HCN як бойової отруйної речовини було заборонено в результаті укладених міжнародних договорів. Безводна синильна кислота - безкольорова рідина з запахом гіркого мигдалю. При температурі 233 К кристалічна HCN має щільність 0,925 г/см3. Динамічна в'язкість безводної HCN (μ) при температурі 278 К складає 2,323·10-4 Па·с. Теплопровідність ціанистого водню при температури 273 К дорівнює 11,05.103 Дж/(м.град.с). Коефіцієнт дифузії ціанистого водню в повітрі при 273 К складає 0,173 см2/с. У водневому середовищі цей показник дорівнює 1,565, а в СО2- 0,117 (при 273,1 К і 0,101 МПа). Значення термохімічних констант для ціанистого водню і синильної кислоти наведено нижче: Теплота плавлення, кДж/моль, при 259 К 7,197 Теплота випарювання при 258,1 К 27,926 кДж/моль. Теплота утворення ціанистого водню (газ) при 291 К 128,449 кДж/моль. Теплота утворення синильної кислоти (рідина) при 291 К 100,416 кДж/моль Енергія розриву зв'язків для дисоціації HCN = СН+ + N- (8.1) дорівнює 933,7 кДж/моль. Константа швидкості розпаду HCN у середовищі аргону в інтервалі 2200-2700 К відповідає рівнянню К= 9,5·10-8·ехр(-11 7000/RT). (8.2) Суміш пари синильної кислоти і повітря може вибухати; за силою вибуху ця суміш перевершує тротил Температура самозапалювання випарів синильної кислоти складає 811 К. Теплота згоряння ціанистого водню в атмосфері кисню дорівнює 642,66-663,16 кДж/моль, при цьому максимальна температура горіння (приблизно 3243 К) сягає при 10-18 %-му об'ємному вмісті HCN. При розкладанні ціанистого водню без повітря температура наближається до 2800 К, а основними продуктами розпаду є азот і водень (47,5 і 48,7 % об'ємних відповідно).
Швидкість спалювання синильної кислоти в повітрі складає 0,55 м/с, а для горіння в чистому кисні ця величина становить 5,4 м/с. Ціанистий водень з ΝО2 утворює параціан (CN)2 і при температурі 688 К, мольному співвідношенні HCN:NО2 =10,1 вихід (CN)2 може сягати 72,5 %. Ціанистий водень змішується необмежено з водою, зі спиртами, ефірами, ацетонітрилом, мурашиною кислотою, нітрометаном. Синильна кислота є слабкою кислотою. Радикал - С = N витісняють такі сполуки, як фенол, борна кислота, оксид вуглецю (IV). При температурі 298 К константа дисоціації HCN складає 7,2·10-10, при 291 К - 4,79·10-10. Зріджений ціанистий водень - стабільна речовина, але водяні розчини синильної кислоти менш стійкі. Так, синильна кислота з масовою концентрацією 10% Н2О починає полімеризуватися при нагріванні в інтервалі температур 323-333 К. Тому кількість Н2О у продукційній кислоті не рекомендується підтримувати більше 2-5 %. У промислових умовах полімеризація HCN усувається добавленням кислот H2SО4, HC1, Н3РО4. HCN - отрутна речовина, що діє в першу чергу на легені (затримує окислювальні й ферментативні процеси, перешкоджає перенесенню кисню гемоглобіном, паралізує дихальні центри). Концентрація пари HCN близько 0,01 мг/м3 не впливає на людину, але вже при концентрації 0,06-0,07 мг/м3 наступає миттєва смерть. Гранично припустима концентрація HCN у повітрі робочих приміщень складає 0,03 мг/м3. У присутності оксиду вуглецю (II) токсичний вплив HCN збільшується. Отруєння ціанідами може бути як при вдиханні, так і при попаданні HCN або ціанідів в організм, а також — у кров через порізи і рани, через шкіру. Симптомами отруєння є подразнення слизистої оболонки очей, верхніх дихальних шляхів, головна біль, нудота, блювота, серцебиття, задишка. 2.Хімічні методи збагачення природних фосфоритів Хімічне збагачення є одним з видів технологічних процесів, спрямованих на підвищення вмісту Р2О5 у фосфатах за рахунок вилучення з них тих чи інших елементів або сполук. Так, наприклад, мікрозернисті фосфорити басейнів Каратау і, частково, Чілісай (Казахстан), а також фосфорити деяких українських родовищ є важкозбагачуваними механічними способами через тонке проростання мінералів. Себто такі фосфорити містять пелітоморфні
включення карбонатних (в т.ч., MgCO3), силіцидних та інших компонентів сполучених з фосфатом різними формами зв'язків (Пеліти (від грец. рelòs - глина) - уламкові гірничі породи, що складаються більше, аніж на 50% з частинок менших за 0,01 мм). Тому навіть при дуже тонкому помелу (-0,15 мм) не досягається достатньо повне розкриття полімінеральних зростків, що перешкоджає одержаню мономінеральних фракцій. В той же час переробка знемагнених високомагнезіальних фосфоритів традиційними кислотними методами у ЕФК і мінеральні добрива має значні труднощі і навіть іноді неможлива - неприпустимо зменшується коефіцієнт кислотного розкладання, а отриману ЕФК неможливо упарювати до концентрації 50% Р2О5 і вище. У зв'язку з цим споживачі-переробники фосфатної сировини пред'являють виробникам фосфатних концентратів досить жорсткі обмеження за вмістом MgO - для високосортних фосфоритів не більше 0,7%. До речі, імпортовані в Україну середземноморські фосфоритні концентрати містять забагато MgO - 1,3-1,7%. З апробованих способів знемагнення фосфоритних концентратів заслуговує уваги технологія обробки фосфоритів слабкими розчинами сульфатної або нітратної кислот, сірчастим газом (SO2), хлором. При невеликій кислотності рідкої фази суспензій (рН=2-4,5) швидкість розкладу карбонатів кальцію і магнію суттєво вища, аніж фосфатів. При цьому має місце деяке розкриття мінералів і після поділу продукту розкладання на розчин, що містить сполуки магнію (передається на утилізацію), і на збагачений знемагнений фосфорит. Останній ефективно збагачується гравітаційними й флотаційними способами за рахунок виділення "розкритих" з мінералів речовин (SiO2 та ін.), що не розчинюються при кислотній обробці. Хімічні методи збагачення дозволяють залучити до виробництва непридатних для прямої кислотної переробки високомагнезиальні апатити і фосфорити, в яких відношення MgO: Р2О5 досягає 30-40%. В той же час як сульфатно-, так нітратнокислотне знемагничення не позбавлене технологічних недоліків. Так, сульфатнокислотною обробкою, при збільшенні в фосфатному концентраті Р2О5 навіть до 28,5-29,6%, вміст MgO дуже важко зменшити до регламентних 0,7% і нижче. Через труднощі в реалізації фільтрації і промивання виділений знемагнений нітратнокислотним способом концентрат містить значну кількість домішок нітратів, які негативно проявляють себе при переробці концентрату в ЕФК. Проте нітратнокислотний розклад може бути ефективним при залученні до переробки, до прикладу, апатит-ільменітових стремигородських руд з виділенням титанового концентрату, цирконію, стронцію, рідкісноземельних елементів. Хімічне збагачення фосфоритів з великим вмістом карбонатів досить ефективно здійснюється і циркулюючим розчином сульфату амонію, до якого додаються сульфатна і фосфатна кислоти (з нормами, розрахованими на зв'язування СаО в CaSO4 i MgO - у вигляді мономагнійфосфату):
За цим способом не виключено, що деяка частина фторгідроксидкарбонатапатиту зі складу фосфоритів теж може прореагувати з розчином NH4HSO4(0,5(NH4)2SO4+0,5H2SO4), позбавившись від конституційного карбонату і збільшивши частку засвоюваного Р2О5:
Процеси хімічного збагачення доцільно комбінувати з механічними методами збагачення фосфоритів з їхньою наступною переробкою у добрива - це надасть можливість покращити якість продукції, утилізувати корисні компоненти, що паралельно вилучаються в циклі збагачення (наприклад, сполуки магнію) і запобігти скиданню кислих відходів. Показовий приклад реалізації цього принципу - технологія добрива - суперфосу.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 201; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.213.209 (0.006 с.) |
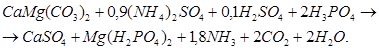 (3.1)
(3.1)
 (3.2)
(3.2)


