
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обучающихся по специальности 8.090520
"Холодильные машины и установки"
Под редакцией профессора В.А. Наера
Одесса - 2002
Составитель – Лось Валерий Иосифович доцент кафедры криогенной техники Рецензент – Наер Вячеслав Андреевич доктор технических наук, профессор, заведующий кафедрой «Криогенная техника»
Конспект лекций по дисциплине «Криогенная техника» включает темы, связанные с особенностями поведения веществ при низких температурах, методами достижения низких температур, расчётом и анализом циклов криогенных установок, а также с теоретическими основами разделения смесей. Основная цель состояла в сжатом изложении основных направлений криогенной техники для студентов, специализирующихся в области умеренного холода, но желающих составить представление об этой области низкотемпературной техники. В конспекте излагается третье начало термодинамики и рассматриваются особенности поведения тел вблизи абсолютного нуля. При изложении раздела, посвящённого методам достижения низких температур, использован материал, обобщённый и достаточно полно изложенный в учебнике Архарова А.М., Марфениной и Микулина Е.И «Криогенные системы». Разделы, связанные с рассмотрением циклов криогенных установок и теоретических основ разделения смесей, изложены таким образом, чтобы студент получил основное представление о методах сжижения и разделения газовых смесей. Для углублённого изучения, рассматриваемых в конспекте вопросов, приведен список соответствующей литературы.
Конспект лекций по дисциплине «Криогенная техника» для студентов специальности 8.090520 «Холодильные машины и установки» рассмотрен на заседании кафедры «Криогенная техника» (протокол № 2 от 10 октября 2002 года) и утверждён методической комиссией института низкотемпературной техники.
Председатель методической комиссии доктор технических наук, профессор Е.С.Авдеев
о г л а в л е н и е
Введение.................................................................................................................................................................................... 3 1. ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ....................................................................................................................... 3 2. МЕТОДЫ ДОСТИЖЕНИЯ НИЗКИХ ТЕМПЕРАТУР.............................................................................................. 3
2.1. ПРОЦЕССЫ, СОПРОВОЖДАЮЩИЕСЯ ПОНИЖЕНИЕМ........................................................................... 3 ТЕМПЕРАТУРЫ В АДИАБАТНЫХ УСЛОВИЯХ..................................................................................................... 3 2.2. ИЗМЕНЕНИЕ ОСНОВНЫХ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ПРИ СЖАТИИ РЕАЛЬНОГО ГАЗА 3 2.3. ДРОССЕЛИРОВАНИЕ................................................................................................................................................. 3 2.4. ПРОЦЕСС U = CONST.................................................................................................................................................. 3 2.5. РАВНОВЕСНОЕ АДИАБАТНОЕ РАСШИРЕНИЕ ГАЗА................................................................................ 3 2.6. ВЫХЛОП ИЛИ СВОБОДНЫЙ ВЫПУСК ГАЗА ИЗ БАЛЛОНА............................................................ 3 ПРОЦЕСС ВПУСКА............................................................................................................................................................... 3 2.7. ПРОЦЕССЫ В АДИАБАТНОЙ СИСТЕМЕ С ПЕРЕМЕННОЙ МАCСОЙ................................................. 3 2.8. РАСШИРЕНИЕ ГАЗА В АДИАБАТНОЙ ВИХРЕВОЙ ТРУБЕ РАНКА—ХИЛША................................ 3 2.9. ПРОЦЕССЫ ВОЛНОВОГО РАСШИРЕНИЯ ГАЗА............................................................................................ 3 2.10. ОТКАЧКА ПАРОВ КИПЯЩЕЙ ЖИДКОСТИ.................................................................................................... 3 2.11. ПРОЦЕССЫ ОХЛАЖДЕНИЯ С ИСПОЛЬЗОВАНИЕМ РАБОЧЕЙ СРЕДЫ В ТВЕРДОМ СОСТОЯНИИ 3 2.12. ПРОЦЕССЫ ОХЛАЖДЕНИЯ, ОСНОВАННЫЕ НА ИСПОЛЬЗОВАНИИ СВОЙСТВ 4He и 3He.. 3 2.13. РАЗЛИЧНЫЕ ПРОЦЕССЫ ОХЛАЖДЕНИЯ.................................................................................................... 3 3. ЦИКЛЫ КРИОГЕННЫХ УСТАНОВОК...................................................................................................................... 3 3.1. ЦИКЛ С ОДНОКРАТНЫМ ДРОССЕЛИРОВАНИЕМ....................................................................................... 3 3.2. ПОТЕРИ ХОЛОДА В ЦИКЛАХ КРИОГЕННЫХ УСТАНОВОК.................................................................. 3 3.3. ЦИКЛ С ОДНОКРАТНЫМ ДРОССЕЛИРОВАНИЕМ И.................................................................................. 3 ПРОМЕЖУТОЧНЫМ ОХЛАЖДЕНИЕМ..................................................................................................................... 3 3.4. ДЕТАНДЕРНЫЕ ЦИКЛЫ........................................................................................................................................... 3 3.5. ДЕТАНДЕРНЫЙ ЦИКЛ СРЕДНЕГО ДАВЛЕНИЯ............................................................................................ 3 3.6. ДЕТАНДЕРНЫЙ ЦИКЛ ВЫСОКОГО ДАВЛЕНИЯ.......................................................................................... 3 3.7. ДЕТАНДЕРНЫЙ ЦИКЛ НИЗКОГО ДАВЛЕНИЯ............................................................................................... 3
3.8. Газовые криогенные циклы....................................................................................................................... 3 4. Теоретические основы разделения смесей....................................................................................... 3 4.1. Термодинамические диаграммы смесей...................................................................................... 3 4.2. Теоретические основы процесса ректификации.................................................................. 3 4.3. Методы расчета процесса ректификации..................................................................................... 3 литература.............................................................................................................................................................................. 3
Введение
Криогенная техника – самая молодая отрасль холодильной техники. Развитие криогенной техники тесно связано с прогрессом новых отраслей промышленности. Интенсивное развитие криогенной техники в значительной степени обязано широкому использованию продуктов разделения воздуха, природного газа и различных газовых смесей в химической, металлургической и других отраслях промышленности. В настоящее время в значительных масштабах используются температуры жидкого водорода (20,4 К). Всё большее значение приобретают температуры жидкого гелия (4,2 К) в практической радиотехнике, в радиоэлектронике. Значительное количество воздухоразделительных и газоразделительных установок находится в эксплуатации. Установки такого рода отличаются большой энергоёмкостью. Поэтому серьёзное значение имеет использование методов анализа энергетической эффективности процессов и определения оптимальных режимов работы установок. Достаточное внимание в криогенной технике уделяется вопросам теплообмена и разделения, так как эти процессы, играя существенную роль в технике глубокого охлаждения, часто определяют конструктивное и аппаратурное решение всей установки. Курс лекций содержит изложение термодинамических основ криогенной техники, достаточно подробное рассмотрение методов получения низких температур. Должное внимание уделяется расчёту и анализу теоретических и действительных циклов криогенных установок, анализу процессов разделения смесей. Основное внимание при этом уделено основному промышленному методу разделения смесей – ректификации. Изучение этого вопроса завершается рассмотрением методов расчёта числа теоретических тарелок. ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ
Открытие третьего начала термодинамики связано с нахождением химического сродства—величины, характеризующей способность различных веществ химически реагировать другс другом. Эта величина определяется работой химических сил при реакции. Первое и второе начала термодинамики позволяют вычислить химическое сродство только с точностью до некоторой неопределенной функции. Чтобы определить эту функцию, нужны в дополнение к обоим началам термодинамики новые опытные данные о свойствах тел. Поэтому Нернстом были предприняты широкие экспериментальные исследования поведения веществ при низкой температуре. В результате этих исследований и было сформулировано третье начало термодинамики: по мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах перестает зависеть от каких-либо термодинамических параметров состояния и в пределе (T =0 К) принимает одну и ту же для всех систем универсальную постоянную величину, которую можно принять равной нулю.
Общность этого утверждения состоит в том, что, во-первых, оно относится к любой равновесной системе и, во-вторых, что при Т
или
где х— любойтермодинамический параметр.
Предельное значение энтропии, поскольку оно одно и то же для всех систем, не имеет какого-либо физического смысла и поэтому полагается равным нулю. Как показывает статистическое рассмотрение этого вопроса, энтропия, по своему существу, определена с точностью до произвольной постоянной (подобно, например, электростатическому потенциалу системы зарядов в какой-либо точке поля). Таким образом, нет смысла вводить некую «абсолютную энтропию», как это делал Планк и некоторые другие ученые. Постоянство энтропии (S Существует ряд веществ (некоторые сплавы, глицерин, СО, NO и др.), для которых Как показал тщательный анализ, это кажущееся противоречие с третьим началом связано с «замораживанием» некоторых веществ в метастабильных или неравновесных состояниях, в которых при низкой температуре эти вещества могут находиться длительное время (несколько дней или недель), прежде чем придут в стабильные равновесные состояния. Когда измерения были проведены с большими промежутками времени, то оказалось, что разность энтропии В настоящее время справедливость третьего начала обоснована для всех термодинамически равновесных систем.
Из третьего начала непосредственно следует недостижимость температуры 0 К.
Действительно, охлаждение системы осуществляется повторением следующих другза другом процессов адиабатного расширения (при котором понижается температура) и изотермического сжатия (при котором уменьшается энтропия). По третьему началу при изотермических процессах, когда температура приближается к 0 К, энтропия перестает изменяться при сжатии. Поэтому состояние с S=0 за конечное число указанных процессов недостижимо, а следовательно, недостижим и 0 К, так как согласно тому же началу состояние с T =0 К совпадает с состоянием S=0. К температуре 0 К можно лишь асимптотически приближаться.
Это следствие третьего начала по своему содержанию эквивалентно третьему началу, т. е. если третье начало неверно, то можно достичь температуры 0 К, и если можно достичь 0 К, то разность значений энтропии при 0 К должна быть отлична от нуля. По этой причине третьим началом термодинамики часто называют принцип недостижимости 0 К. Именно так сформулировал это начало Нернст, который не любил понятия энтропии и не употреблял его. Однако, формулировка третьего начала в виде закона о поведении энтропии при T Сказанное позволяет сформулировать следующее положение:
|
||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.117.109 (0.02 с.) |
 0 К энтропия не зависит от значения любого параметра системы. Таким образом, по третьему началу,
0 К энтропия не зависит от значения любого параметра системы. Таким образом, по третьему началу,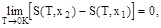 (1.1)
(1.1) (1.2)
(1.2) при T
при T 


