
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ смеси катионов III группы
Цель работы: провести качественный анализ раствора, в котором возможно присутствие ионов Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+. Сущность работы. Согласно сульфидной классификации ионы Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+ относятся к III аналитической группе. На некоторые из них есть селективные реакции, с помощью которых можно открыть конкретный ион в присутствии всех остальных, не проводя разделение. Так, ионы Fe2+, Fe3+ и Zn2+ открывают в предварительных испытаниях, действуя реагентами K3[Fe(CN)6], K4[Fe(CN)6] и дитизоном соответственно. Другие ионы, находящиеся в растворе, не мешают их обнаружению. Однако многие ионы III аналитической группы необходимо отделить друг от друга перед проведением характерных реакций. В лабораторной работе для этой цели используется пероксидный метод систематического анализа смеси катионов III группы, предполагающий использование избытка NаОH в присутствии Н2О2. Разделение с применением Н2О2 и избытка NаОН основано на различных окислительно-восстановительных свойствах катионов III группы и амфотерном характере гидроксидов Al(OH)3, Cr(OH)3 и Zn(OH)2. В ходе разделения сначала все ионы вступают в реакцию со щелочью, образуя нерастворимые гидроксиды:
Затем при добавлении избытка щелочи амфотерные гидроксиды растворяются: Cr(OH)3↓ + 3OH– = [Cr(OH)6]3– Zn(OH)2↓ + 2OH– = [Zn(OH)4]2– Al(OH)3↓ + 3OH– = [Al(OH)6]3– В результате часть катионов остается в растворе, а часть находится в осадке в виде малорастворимых гидроксидов. Затем под действием Н2О2 в щелочной среде происходит окисление гидроксидов Fe(OH)2 и Mn(OH)2 в осадке и гидроксохромита [Cr(OH)6]3– в растворе: 2Fe(OH)2↓ + Н2О2 = 2Fe(OH)3↓ Mn(OH)2↓ + Н2О2 = MnО(OH)2↓ + Н2О 2[Cr(OH)6]3– + 3Н2О2 = 2CrО42– + 8Н2О + 2ОН– В результате разделения ионов внутри III аналитической группы получаются раствор и осадок следующего состава:
При анализе раствора необходимо провести обнаружение только ионов Al3+ и Cr3+, поскольку Zn2+ открывается в предварительных испытаниях. При анализе осадка необходимо открыть только ионы Mn2+, так как наличие или отсутствие ионов Fe2+ и Fe3+ также устанавливается в ходе предварительных испытаний. Растворять осадок не надо, потому что используется характерная реакция обнаружения Mn2+ по образованию комплексного соединения H[Mn(C2O4)2] при действии раствора щавелевой кислоты на осадок MnО(OH)2.
Однако проведению этой реакции мешает Fe(OH)3. Его необходимо замаскировать до выполнения реакции на Mn2+, если по результатам предварительных испытаний в пробе обнаружены ионы Fe2+ и/или Fe3+. Маскирующим агентом является NaF, который образует с ионами Fe3+ прочные фторидные комплексы: Fe(OH)3¯ + 6NaF ® Na3[FeF6] + 3NaOH Для обнаружения отдельных ионов в лабораторной работе используют следующие характерные реакции:
Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид раствора (окраска, прозрачность). Далее используют отдельные порции исследуемого раствора для проведения предварительных испытаний и систематического хода анализа. Предварительные испытания Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной палочкой и сравнив полученную окраску с цветной шкалой. Проба на присутствие Fe2+. Ион Fe2+ открывают первым, так как он легко окисляется кислородом воздуха до Fe3+. Небольшую порцию раствора подкисляют 2 н. НСl и приливают к ней 1–2 капли раствора K3[Fe(CN)6], стараясь не перемешивать содержимое пробирки. Выпадение синего осадка Fe3[Fe(CN)6]2 свидетельствует о наличии иона Fe2+. Следует иметь в виду, что в присутствии катионов III группы осадок будет менее интенсивно окрашен.
Если основной эффект не проявился, то необходимо зафиксировать побочные эффекты, которые могут наблюдаться за счет возможного присутствия ионов Fe3+, Mn2+ и Zn2+. Проба на присутствие Fe3+. К отдельной порции исследуемого раствора, подкисленной 2 н. HCl, прибавляют несколько капель раствора K4[Fe(CN)6]. Выпадение синего осадка Fe4[Fe(CN)6]3 свидетельствует о наличии иона Fe3+. Присутствие катионов III группы несколько изменяет темно-синий цвет осадка. Следует иметь в виду, что растворы солей Fe2+ всегда содержат примесь Fe3+ за счет окисления кислородом воздуха, поэтому в отчете необходимо указать не только окраску раствора, но и ее интенсивность. Проба на присутствие Zn2+. В центр полоски фильтровальной бумаги наносят каплю раствора дитизона и каплю анализируемого раствора. Появление малиново-красного окрашивания свидетельствует о присутствии ионов Zn2+. Для сравнения полезно провести холостой опыт и модельный опыт:
Систематический ход анализа 2.1. Разделение катионов внутри группы. К 10–12 каплям анализируемого раствора прибавляют при тщательном перемешивании концентрированный раствор NaOH до щелочной реакции по индикаторной бумаге. Затем прибавляют еще 5–8 капель раствора NaOH и В результате катионы III группы оказываются разделенными: фильтрат содержит анионы 2.2 Анализ фильтрата Обнаружение Cr3+. Для установления наличия ионов Cr3+ их окисляют до При проведении реакции в отсутствии амилового спирта синяя окраска также образуется, однако она менее интенсивна и быстро исчезает. Обнаружение Al3+. В центр полоски фильтровальной бумаги наносят 1–2 капли фильтрата, затем 1 каплю раствора HCl. Помещают полоску над склянкой с концентрированным раствором аммиака и держат ее 1–2 мин в парáх аммиака. Затем на пятно наносят каплю раствора ализарина и снова держат бумагу в парáх аммиака. Пятно окрашивается в фиолетовый цвет, характерный для ализарина в аммиачной среде.
Бумагу подсушивают, наносят на пятно 1–2 капли раствора уксусной кислоты и снова подсушивают. При этом фиолетовая окраска ализарина исчезает. Если в пробе присутствуют ионы Al3+, то пятно становится розово-красным. 2.3. Анализ осадка Обнаружение Mn2+. Ионы Mn2+ открывают, действуя щавелевой кислотой на осадок MnО(OH)2. Проведению реакции мешает Fe(OH)3, поэтому его предварительно маскируют. Проведение реакции в отсутствие Fe(OH)3 К осадку после центрифугирования осторожно, по стенке пробирки пипеткой вводят 2 н. раствор Н2С2О4. В присутствии MnО(OH)2 образуется малиново-розовое комплексное соединение марганца H[Mn(C2O4)2]. Образующееся соединение неустойчиво, поэтому раствор перемешивать не следует. Проведение реакции в присутствии Fe(OH)3 К осадку добавляют несколько кристалликов NaF, а затем вводят Н2С2О4, как описано выше. Лабораторная работа № 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1909; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.240.21 (0.012 с.) |

 + NаОН, Н2О2, t °
+ NаОН, Н2О2, t °

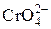 , [Al(OН)6]3– и [Zn(OН)4]2–, а осадок – гидроксиды Fe(OH)3 и MnО(OH)2.
, [Al(OН)6]3– и [Zn(OН)4]2–, а осадок – гидроксиды Fe(OH)3 и MnО(OH)2.


