
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квнз «житомирський базовий фармацевтичний коледж ім. Г. С. Протасевича»Стр 1 из 8Следующая ⇒
КВНЗ «Житомирський базовий фармацевтичний коледж ім. Г.С.Протасевича» Житомирської обласної ради НЕОРГАНІЧНА ХІМІЯ МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ТА КОНТРОЛЬНІ ЗАВДАННЯ ДЛЯ СТУДЕНТІВ ЗАОЧНОЇ ФОРМИ НАВЧАННЯ СПЕЦІАЛЬНОСТІ 226 «ФАРМАЦІЯ» Житомир 2016
Міністерство охорони здоров’я України КВНЗ «Житомирський базовий фармацевтичний коледж ім. Г.С. Протасевича» Житомирської обласної ради НЕОРГАНІЧНА ХІМІЯ МЕТОДИЧНІ РЕКОМЕНДАЦІЇ ТА КОНТРОЛЬНІ ЗАВДАННЯ ДЛЯ СТУДЕНТІВ ЗАОЧНОЇ ФОРМИ НАВЧАННЯ СПЕЦІАЛЬНОСТІ 226 «ФАРМАЦІЯ»
Житомир 2016 Затверджено ЦМК хімічних дисциплін Житомирського базового фармацевтичного коледжу ім. Г.С. Протасевича (Протокол № 1 від 31.08.2016р.)
Укладачі: Гирина Н.П. – викладач вищої кваліфікаційної категорії, викладач – методист; Туманова І.В. – викладач вищої кваліфікаційної категорії; Шелюк І.О. – викладач другої кваліфікаційної категорії, аспірант інституту фізики напівпровідників ім. В.Є.Лашкарьова НАН України. Рецензент: Кусяк Н.В. – кандидат хімічних наук, завідувач кафедри хімії природничого факультету Житомирського державного університету імені Івана Франка.
Загальні положення Даний посібник містить методичні вказівки та завдання для виконання контрольних робіт, а також до аудиторних лабораторних занять. Знання з неорганічної хімії необхідні для більш глибокого та повного засвоєння таких дисциплін як аналітична, фармацевтична хімії, фармакогнозія, фармакологія, технологія ліків. Для забезпечення міжпредметних зв’язків необхідно звертатись до Державної Фармакопеї України та інших нормативних документів. Перелік основних теоретичних питань з курсу неорганічної хімії представлений на стор. 63. Завдання курсу – формування вихідного рівня знань студентів, необхідного для успішного подальшого засвоєння професійних і практичних дисциплін, прищеплення студентам навичок хімічного мислення, уміння передбачати можливість взаємодії речовин та продуктів їх перетворення. Щодо змісту розділів програми, то він побудований з урахуванням таких провідних ідей, як: § матеріальна єдність хімічних елементів та речовин, їх генетичний зв’язок і розвиток;
§ закономірності перебігу хімічних процесів; § причинно-наслідкові зв’язки між складом, будовою, властивостями та застосуваннями речовин; § пізнаваність речовин і закономірностей хімічних реакцій; взаємозв’язок теорії і практики. Мета методичних вказівок - допомогти студентам закріпити знання з основних розділів неорганічної хімії та навчитись їх застосовувати при вивченні фармацевтичних дисциплін. Методичні вказівки складені з урахуванням специфіки заочного навчання. Вони передбачають систематичну самостійну роботу над теоретичним матеріалом згідно наведеної програми. У методичних вказівках до кожного заняття і в завдання для контрольних робіт вказані розділи програми, які необхідно засвоїти. Методичні вказівки вміщують орієнтовний перелік питань з неорганічної хімії, що виносяться на іспит. Індивідуальний варіант контрольних робіт студенту визначає викладач. Після вивчення курсу “Неорганічна хімія” студенти повинні знати: 1. Основні хімічні поняття і закони хімії, номенклатуру та класифікацію неорганічних сполук; 2. Структуру періодичної системи, періодичний закон Д.І.Менделєєва, електронну будову атома;; типи хімічних зв’язків, типи хімічних реакцій; 3. Хімічні реакції у розчинах електролітів; 4. Властивості хімічних елементів та їх сполук, біологічну роль та застосування у фармації. Студенти повинні уміти: 1. Виконувати правила техніки безпеки при роботі в лабораторії. 2. Користуватися хімічним посудом, хімічними реактивами. 3. Згідно з електронною формулою та місцем знаходження у періодичній системі давати характеристику елементу. 4. Класифікувати та називати речовини. 5. Виконувати хімічний експеримент для підтвердження фізичних та хімічних властивостей сполук, пояснювати результати дослідів, складати рівняння реакцій іонного обміну, гідролізу солей, комплексоутворення, окисно- відновних, правильно користуватися хімічною термінологією та номенклатурою. Грамотно оформляти результати практичних робіт. 6. Робити розрахунки за формулами і рівняннями. 7. Користуватися довідниковою літературою.
Студенти повинні бути поінформовані про: 1. Поширення елементів у природі України. 2. Екологічні компоненти хімічних знань. 3. Народно-господарське значення сполук елементів.
План-графік з дисципліни «Неорганічна хімія» 5.12020101 «Фармація»
І.Загальна хімія. Тема 1. Атомно-молекулярне вчення. Основні поняття хімії: хімічний елемент, атом, молекула, атомна та молекулярна маси, моль - одиниця кількості речовини, молярна маса, прості та складні речовини. Хімічні формули речовин та хімічні рівняння реакцій. Основні закони хімії: закон збереження маси, закон сталості складу, закон кратних відношень, закон Авогадро. Еквівалент та молярна маса еквівалента речовин в умовах хімічної реакції. Тема 2. Будова атома. Розвиток періодичного закону. Відкриття періодичного закону. Періодична система елементів Д.І. Менделєєва, її будова: період, група, підгрупа. Моделі атома. Сучасна квантово-механічна будова атома. Ядро атома. Характер руху електрона в атомі. Електронна хмара. Атомна орбіталь. Характеристика стану електронів в атомі за допомогою квантових чисел: головного, орбітального, магнітного та спінового. Принципи та правила, що визначають послідовність заповнення атомних орбіталей електронами: принцип найменшої енергії, принцип Паулі, правило Гунда, правило Клечковського. Електронні та електронно-графічні формули атомів елементів та їх іонів. Періодичний характер зміни властивостей атомів елементів головних та побічних підгруп у світлі теорії електронної будови атома. Вплив електронної будови атомів на властивості елементів: електронні конфігурації атомів елементів у стані спокою та в збудженому стані. Валентність. Ступінь окиснення. Енергія іонізації та енергія спорідненості до електрона. Електронегативність. Тема 5. Вода. Розчини Суть основних положень: розчин, розчинник, розчинена речовина. Вода як розчинник. Поняття про дисперсні системи. Види дисперсних систем: суспензії, емульсії, колоїдні розчини, справжні розчини. Розчинність газів, рідин, твердих речовин. Швидкість розчинення. Теплові явища при розчиненні. Гідратна теорія розчинів Д.І.Менделєєва. Насичені, ненасичені і перенасичені розчини. Способи вираження складу розчинів: масова частка речовини у розчині; молярна; молярна концентрація еквіваленту. Титр розчину. ІІ. Хімія елементів
Р – елементи. Тема 9. Елементи VI А групи Загальна характеристика атомів елементів. Оксиген та Сульфур, поширення у природі, загальна характеристика простих речовин. Кисень. Застосування. Значення кисню у природі. Водневі сполуки Оксигену. Вода, пероксиди. Значення у природі, застосування. Сульфур. Алотропія. Добування сірки. Фізичні та хімічні властивості. Сірководень: добування, фізичні та хімічні властивості. Фізіологічна дія сірководню. Сульфідна кислота, сульфіди їх властивості. Оксигеновмісні сполуки Сульфуру. Сульфур (IV) оксид: фізичні та хімічні властивості, добування. Властивості сульфітної кислоти і сульфітів. Якісні реакції на сульфіт-іон.
Тіосульфатна кислота. Натрій тіосульфат: добування, фізичні та хімічні властивості, застосування. Сульфур (VI) оксид: фізичні та хімічні властивості. Кислота сульфатна: добування, властивості концентрованої та розбавленої. Правила користування концентрованою кислотою. Сульфати, їх властивості. Якісна реакція на сульфат- іон. Біологічна роль сполук Сульфуру та Оксигену, використання їх у медицині та фармації. Тема 10. Елементи V А групи Загальна характеристика атомів елементів. Нітроген, Фосфор та Арсен, поширення у природі, загальна характеристика простих речовин. Нітроген. Азот у природі. Добування. Фізичні та хімічні властивості. Сполуки Нітрогену: амоніак, добування, фізичні та хімічні властивості, техніка безпеки та заходи першої допомоги під час роботи з ним; солі амонію, їх фізичні та хімічні властивості. Застосування амоніаку та солей амонію в медицині. Оксигеновмісні сполуки Нітрогену. Добування та властивості оксидів Нітрогену. Кислоти нітритна та нітратна, їх солі. Добування, фізичні та хімічні властивості. Техніка безпеки та заходи першої допомоги під час роботи з нітратною кислотою. Якісні реакції на нітрит- та нітрат-іони. Фосфор. Добування. Алотропія. Сполуки: фосфін, фосфор (III) оксид, фосфор (V) оксид, кислоти фосфітна та фосфатна. Добування. Фізичні та хімічні властивості. Якісні реакції на фосфат-іон. Біологічна роль сполук Нітрогену, Фосфору, використання у медицині та фармації. S-елементи. D-елементи. Тема 15. Елементи І В групи Загальна характеристика атомів елементів І В групи. Купрум, Аргентум, Аурум, поширення у природі. Властивості простих речовин. Комплексоутворення. Купрум. Фізичні та хімічні властивості сполук: оксиди, гідроксиди, солі. Добування. Якісна реакція на купрум (ІІ)-іон. Аргентум. Фізичні та хімічні властивості сполук: оксиди, гідроксиди, солі. Добування. Якісна реакція на аргентум-іон. Біологічна роль елементів. Використання у медицині та фармації сполук Купруму та Аргентуму. І семестр
Тематичний план лабораторних занять
І семестр
Неорганічна хімія Контрольна робота №____, варіант №___ Студента (ки) ___ курсу___групи фармацевтичного відділення заочної форми навчання Житомирського базового фармацевтичного коледжу ім. Г.С. Протасевича ______________________________________________ (прізвище, ім'я, по батькові)
№ залікової книжки_____________________ Домашня адреса________________________
При оформленні контрольної роботи необхідно спочатку переписати завдання, після чого дати коротку, але вичерпну відповідь на поставлені в ньому запитання. Текст питання або завдання переписується зі збереженням загальної нумерації. Контрольна робота має бути виконана акуратно, бажано залишати поля для приміток рецензента. В кінці роботи наводиться список використаної літератури, дата і особистий підпис студента. Кожна контрольна робота повинна бути вислана або особисто передана на відділення заочної форми навчання (каб. 204) у відповідності з термінами, вказаними в плані-графіку навчального процесу. Якщо виконана контрольна робота не відповідає вимогам і отримує негативну рецензію, студент повинен виправити зауваження і надіслати роботу на повторну перевірку. Без контрольної роботи взагалі або позитивної оцінки на контрольну роботу студент не може бути допущений до екзаменаційної сесії. Спеціальність:” Фармація ” (заочна форма навчання) Курс:___________________ Група:__________________ _____________________________________________ (прізвище, ім’я та по батькові) Лабораторний практикум Передмова Виконання лабораторного практикуму сприятиме: поглибленому вивченню та засвоєнню теоретичного матеріалу; формуванню практичних навичок самостійної роботи; умінню передбачати можливість взаємодії речовин та характер продуктів їх хімічних перетворень. Кінцевою метою вивчення курсу неорганічної хімії є набуття студентами компетентності, тобто здатності успішно задовольняти суспільні вимоги і потреби, виконувати завдання, здійснювати діяльність, бути професійно-освіченим фахівцем. Лабораторний журнал, студент частково заповнює вдома, розв’язує контрольні завдання. Порядок роботи в лабораторії 1. Підготуватись до лабораторного заняття (вивчити теоретичний матеріал і ознайомитись зі змістом лабораторної роботи). 2. Дотримуватись медичної форми. 3. За кожним студентом закріплюється робоче місце. 4. Дотримуватись правил безпечної роботи. 5. Ощадливо витрачати реактиви, обладнання та матеріали. 6. Сухі реактиви набирати шпателями або мікролопатками. 7. Кришки та корки від банок і склянок з реактивами класти на стіл зовнішньою поверхнею.
8. Результати лабораторної роботи записувати у лабораторний журнал. 9. Після закінчення роботи студент повинен: - лабораторний журнал дати на підпис викладачу; - прибрати своє робоче місце; - залишити лабораторію після того, як пальники всі погашені, газові і водопровідні крани перекриті, електронагрівальні прилади вимкнені. Правила безпечної роботи в лабораторії. 1. Робоче місце тримати в чистоті. 2. Ознайомитись зі змістом інструкції до лабораторної роботи. 3. Досліди виконувати послідовно. 4. Забороняється виконувати досліди, не передбачені інструкцією. 5. Не куштувати реактиви на смак! 6. Забороняється вживати їжу в лабораторії. 7. Дбайливо ставитись до обладнання лабораторії. 8. Досліди з концентрованими кислотами, пахучими, отруйними рідинами і тими, що легко загоряються, проводити у витяжній шафі. 9. При розведенні концентрованої кислоти, її необхідно вливати у воду, а не навпаки. 10. Концентровані кислоти зберігати у витяжній шафі. 11. Залишки речовин після досліду потрібно зливати або зсипати у спеціально виділений для цього посуд. 12. Відпрацьовані кислоти та луги не можна виливати у раковину. Вони повинні бути нейтралізовані або сильно розведені водою. 13. Не нюхати гази, близько нахиляючись над пробіркою (потік повітря долонею направити до себе і обережно понюхати). 14. Не слід близько нахилятися над посудом в якому проходить хімічна реакція. 15. Нагріваючи пробірку, не можна повертати отвором до себе або тих, хто поруч. 16. Легкозаймисті речовини (ефір, спирт та ін.) тримати під час дослідів далеко від відкритого полум'я. 17. Легкозаймисті речовини нагрівають на водяній бані з закритим електропідігрівом у витяжній шафі. 18. Працювати необхідно тільки зі справною апаратурою.
Надання першої допомоги при нещасних випадках. 1. При будь-яких отруєннях (опіках) потрібно звертатися до лікаря, але до його приходу необхідно надати потерпілому першу допомогу 2. При потраплянні на шкіру концентрованої кислоти, уражене місце промити: а) проточною водою (інтенсивно); б) нейтралізувати розчином натрій гідрогенкарбонату (2%); в) промити водою. При потраплянні на шкіру концентрованої сульфатної кислоти перед промиванням ушкоджене місце витерти сухим ватним тампоном. 3. При потраплянні на шкіру концентрованого лугу, місце опіку промити: а) сильним струменем води; б) нейтралізувати розчином (Н3ВО3, СН3СООН (1-2%)); в) промити водою. 4. При термічних опіках уражене місце обробити 1% розчином калій перманганату або спиртом, а потім нанести мазь від опіків. 5. При попаданні на шкіру фенолу, брому уражене місце промити спиртом або ефіром. 6. При порізах рану обробити спиртовим розчином І2 (5%) і накласти марлеву пов’язку. 7. При потраплянні на шкіру кислот, оцтової есенції, сполук Фосфору шкіру протирають розчином NaHCO3 (2 ч.л. на 1 ст. води). Цим же розчином промивають і очі. 8. При потраплянні в очі лугу, одеколону, бензину їх можна промити молоком. 9. При отруєнні газами: H2S, Cl2, Br2, NO2, CO потерпілого потрібно вивести на свіже повітря або дати вдихати розчин амоніаку, дати випити молоко і відправити до лікаря. 10. Засобом для виведення отрути є промивання шлунку (необхідно випити кілька склянок води і викликати блювання). У воду можна добавити сіль або суху гірчицю (2 ч. ложки на склянку води). 11. При отруєнні харчовими продуктами та отруйними рослинами застосовують KMnO4 (випити 2-3 л слабко-рожевого розчину). 12. При потраплянні отрутохімікатів всередину потрібно зробити 4-5 промивань шлунка (по 3-4 склянки підсоленої або з додаванням NaHCO3 води), а потім дати потерпілому проносний засіб (1 ст. ложку глауберової солі на 1 склянку води). 13. Щоб розвести кислоту або луг, що потрапили всередину, необхідно дати випити потерпілому 2-3 склянки (не більше!) води. Забороняється також нейтралізувати луг слабкою кислотою або навпаки! Необхідно дати випити розбовтані в воді яєчні білки (6 білків на 0,5 л води), желе, рисовий або вівсяний відвари. 14. При отруєнні йодом (І2) потрібно випити розведений в воді крохмаль або пшеничну муку. 15. Увага! Молоко сприяє всмоктуванню отрут, які добре в ньому розчиняються. Молоко рекомендується при отруєнні кислотами. 16. При отруєнні сполуками Арсену, Фосфору, Меркурієм необхідно негайно звернутись до лікаря. 17. Після надання першої допомоги, потерпілого, в разі необхідності, відправити до лікарні. 18. У кожній лабораторії повинна бути аптечка з таким набором матеріалів: бинти, гігроскопічна вата, лейкопластир, йод (5% спиртовий розчин), гумовий джгут, (трубка довжиною 40-50 см), піпетки, пінцет, ножиці, скляна ванночка для промивання очей, склянка для приймання ліків, калій перманганат (2% розчин), танін (5% розчин), натрійгідрогенкарбонат (1% і 5% розчини), оцтова кислота (2% розчин), боратна кислота (2% розчин), нашатирний спирт (10% розчин), мазь Вишневського, синтоміцинова мазь, гліцерин, вазелін.
Дата проведення:_____________ Лабораторна робота 1
СКЛАД ДИСПЕРСНОЇ СИСТЕМИ
ТИПИ ДИСПЕРСНИХ СИСТЕМ
СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РЕЧОВИН У РОЗЧИНАХ Масова частка – відношення маси розчиненої речовини до маси розчину(%):
де w – масова частка (%); Молярна концентрація – кількість молів розчиненої речовини, що міститься в 1дм3 розчину. Визначається як відношення кількості речовини до одиниці об’єму розчину де с– молярна концентрація (моль/дм3); n- кількість речовини (моль); V – об’єм розчину (дм3); М – молярна маса (г/моль) розчиненої речовини. Моляльна концентрація – кількість молів розчиненої речовини, що міститься в 1000г розчинника. Молярна концентрація еквівалента (нормальна концентрація) – кількість молів еквівалентів розчиненої речовини, що міститься в 1дм3 розчину:
де сN – молярна концентрація еквіваленту (моль•екв/дм3); М(екв)(реч) – молярна маса еквіваленту речовин (моль/дм3). Титр – кількість грам речовини, що міститься в 1см3 розчину (г/см3).
Формули, що виражають перехід від одного способу вираження концентрації речовини у розчині до іншого:
де Длязмішування розчинів різної концентрації:
Задача 1. Визначити масу натрій хлориду, який потрібно розчинити у воді, щоб отримати 100 см3 розчину з масовою часткою Розв’язування. Маса розчину, який необхідно приготувати, складає m=ρ·V; m=1.15 г/ см3·100 см3 = 115г. масова частка
Відповідь: 23 г
Задача 2. Необхідно приготувати 200 см3 розчину з масовою часткою сульфатної кислоти 6% (густина розчину ρ=1,04 г/ см3). Який об’єм розчину з масовою часткою Розв’язування. Маса розчину, який потрібно приготувати, дорівнює m=ρ·V; m= 1,04·200=208 (г). Визначаємо масу
Визначаємо масу 60% розчину сульфатної кислоти, у якому міститься 12,5 г сульфатної кислоти:
Об’єм 60% розчину складе:
Відповідь: 13,9 см3 об’єму розчину
Задача 3. Обчислити масу глауберової солі Розв’язування. Визначаємо масу і кількість речовини m( m(
Обчислюємо масу кристалогідрату: m( m( Відповідь: m(
Задача 4. Яку кількість потрібно взяти 40%-го розчину КОН та води, щоб отримати 160 г з масовою часткою розчину 15%. Розв’язування. Скласти пропорцію за правилом хреста: Розраховуємо масу розчину (40%) КОН: mр-ну=3+5=8(м.ч.)(15%)
На 8 м.ч. розчину – 3 м.ч. КОН На 160г розчину – x x = (160·3)/8=60 г (40% КОН)
Знаходимо m(H2O) = 160-60=100 г.
Задача 5. Обчислити скільки см3 20% хлоридної кислоти потрібно взяти для виготовлення 500 см3 її 0,1М розчину. Густина кислоти 1,1 г/ см3. Розв’язування. Для виготовлення 500 см3 0,1М розчину хлоридної кислоти потрібно мати 0,05моль хлоридної кислоти. За масою це дорівнює: 36,5 г·0,05=1,83 г. 1 см3 20%-го розчину 100:20=1,1:х; х=(1,1·20):100=0,22 г кислоти у 1 см3 20% розчину. Для остаточного розв’язання складаємо пропорцію: 1 см3: 0,22 = х см3: 1,83 г; х=8,32 см3. Відповідь: 8,32 см3 розчину хлоридної кислоти.
Задача 6. Визначити молярну концентрацію еквівалента і молярність 12% розчину Розв’язування. Молярна концентрація має величину моль/дм3 і обчислюється за формулою:
Визначимо: M(
Молярна концентрація еквівалента визначається за формулою:
VIII. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електролітична дисоціація - розпад електролітів на іони під час розчинення їх у воді. Електроліти - речовини, розчини або розплави яких проводять електричний струм (кислоти, основи і майже всі солі). Розчини електролітів вони є провідники другого роду. Неелектроліти - речовини, розчини або розплави яких не проводять електричний струм (більшість органічних сполук, а також речовини, в молекулах яких є тільки ковалентні неполярні або малополярні зв'язки).
Дисоціація води. рН Вода як слабкий електроліт незначною мірою дисоціює на іони Н+ і ОН-, що перебувають у рівновазі з недисоційованими молекулами:
Водневий показник
Наприклад: [H+]=10-5, pH=5. В нейтральних розчинах (вода) [H+]=[OH-]=10-7, pH=7 кислих розчинах [H+]>[OH-]>10-7, pH<7 лужних розчинах [H+]<[OH-]<10-7, pH>7. Таблиця кислотно-основних індикаторів
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ Задача 1. Написати у молекулярній та іонній формах рівняння реакцій між алюміній хлоридом і аргентум (І)нітратом. Розв’язування: Складаємо рівняння реакції в молекулярній формі:
В іонній формі рівняння виглядатиме:
Виключимо з обох частин рівності однакові іони, тобто іони, що не беруть участі в реакції(їх підкреслено). Записуємо скорочене іонне рівняння реакції
Задача 2. Визначити рН розчинів сильних кислот
Розв’язування: Так, для 0,01 М розчину хлоридної кислоти знаходимо
Для 0,03 М розчину цієї ж кислоти
а для 1М розчину рН = 0.
Задача 3.Визначити рН 0,005 М розчину натрій гідроксиду Розв’зування: У розчині сильний електроліт – натрій гідроксид – повністю дисоціює на іони:
З 1 моль Знаючи величину іонного добутку води
Одержуємо
IХ. ГІДРОЛІЗ СОЛЕЙ Гідроліз солей -взаємодія між іонами солі та води з утворенням слабкого електроліту (малодисоційованої сполуки). Примітка.
Практичні навички.
16. Виконання експериментальних задач, пов’язаних із підтвердженням хімічних властивостей оксидів, гідроксидів, кислот, солей.
Завдання для контрольної роботи
Загальна хімія
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.242.165 (0.18 с.) |


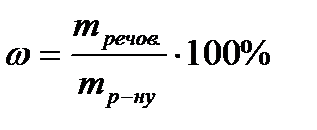 ,
, mреч – маса речовин (г); mр-ну – маса розчину (г).
mреч – маса речовин (г); mр-ну – маса розчину (г). або
або 
 ,
, ,
, ;
;  .
. ;
;  ;
; ;
;  ,
, – густина розчину (г/см3).
– густина розчину (г/см3). .
. ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ 20%. Густина розчину ρ=1,15 г/ см3.
20%. Густина розчину ρ=1,15 г/ см3. дорівнює
дорівнює , звідки
, звідки  ;
;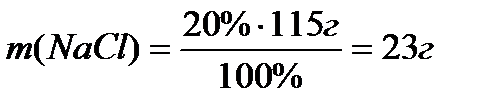
 60% (густина ρ´=1,5 г/ см3) потрібна для цього?
60% (густина ρ´=1,5 г/ см3) потрібна для цього? (безводної), необхідну для приготування 208 г 6% розчину, виходячи із поняття масової частки розчиненої речовини
(безводної), необхідну для приготування 208 г 6% розчину, виходячи із поняття масової частки розчиненої речовини 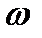 (
( ):
): тоді
тоді  ;
; .
. , звідки
, звідки  ;
; .
.  ;
; 
 60%.
60%. , яку потрібно взяти для приготування 300 г розчину з масовою часткою натрій сульфату 8%.
, яку потрібно взяти для приготування 300 г розчину з масовою часткою натрій сульфату 8%. , необхідної для приготування 300 г 8% розчину:
, необхідної для приготування 300 г 8% розчину: ) = w(
) = w(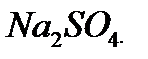 )·m;
)·m; ) =0,08·300 =24 г, а також
) =0,08·300 =24 г, а також
 ;
; 
 )= n(
)= n( )· M(
)· M( );
); )=0,169 моль·322 г/моль = 54,4 г.
)=0,169 моль·322 г/моль = 54,4 г. ) =54,4 г.
) =54,4 г.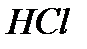 , густина якого має масу m= ρV = 1,1·1=1,1 г. Масу
, густина якого має масу m= ρV = 1,1·1=1,1 г. Масу  у 1,1 г розчину хлоридної кислоти 20% (тобто у 1 см3 20% розчину) знаходимо з пропорції:
у 1,1 г розчину хлоридної кислоти 20% (тобто у 1 см3 20% розчину) знаходимо з пропорції: , густина якого 1,122 г/см3.
, густина якого 1,122 г/см3. ,
, ) = 152 г/моль; Мекв (
) = 152 г/моль; Мекв ( ) = M:2=152:2=76г/моль.
) = M:2=152:2=76г/моль.
 ,
,

 - вираз для константи дисоціації води, який називається йонним добутком води.
- вираз для константи дисоціації води, який називається йонним добутком води.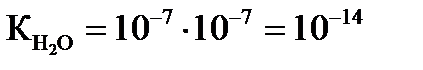 - йонний добуток води.
- йонний добуток води.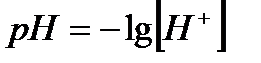 .
.
 .
.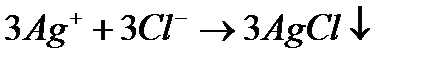


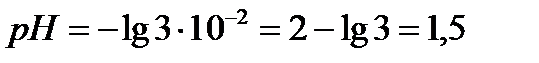 ,
, .
. утворюється 1 моль
утворюється 1 моль  -, а з 0,005 моль
-, а з 0,005 моль  – 0,005 моль
– 0,005 моль  . Отже, концентрація іонів
. Отже, концентрація іонів  дорівнює 0,005 моль/дм3.
дорівнює 0,005 моль/дм3. , знаходимо концентрацію іонів гідрогену:
, знаходимо концентрацію іонів гідрогену: ;
;




