
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція 4. Способи пом’якшення води
План лекції
3. Загальна характеристика іонітів. 4. Пом’якшення природних вод Na-, Н- катіонуванням. 5. Пом’якшення природних вод на глауконітових та вугільних фільтрах. 1. Вода, загальна твердість якої перевищує 6,4 мг-екв/дм3, для приготування безалкогольних напоїв непридатна, оскільки значно зменшує стійкість за рахунок нейтралізації частини фруктових кислот солями твердості, змінює активну кислотність напоїв, зумовлює перевитрату молочної, лимонної та інших кислот, які додають до напоїв для надання їм відповідного кислого смаку. Тому воду з підвищеною твердістю пом’якшують термічними, реагентними, іонообмінним способами та їх комбінуванням. Термічний спосіб застосовують для пом’якшення карбонатних природних вод для котлів низького тиску, а ще у комбінації з реагентними методами пом’якшення. Термічне пом’якшення води ґрунтується на зміщенні вуглекислотної рівноваги при нагріві води в бік утворення карбонату кальцію за рівнянням Ca(HCO3)2 При підвищеній температурі рівновага реакції зміщується вправо за рахунок пониження розчинності діоксиду вуглецю. Гідрогенкарбонат кальцію розкладається з утворенням нерозчинного карбонату кальцію. Кип’ятінням можна повністю видалити з води CO2, значно знизивши карбонатну кальцієву твердість, але повністю усунути вказану твердість води не можна, оскільки карбонат кальцію частково розчиняється у воді. За наявності у воді гідрогенкарбонату магнію в процесі кип'ятіння води утворюється погано розчинний карбонат магнію, який надалі гідролізується з утворенням осаду малорозчинного гідроксиду магнію Mg(HCO3)2 MgCO3+ H2O Кип’ятінння води дозволяє усунути її тимчасову твердість. При високій температурі також зменшується розчинність сульфату кальцію і частково зменшується некарбонатна твердість води. Цей спосіб дуже ефективний для пом’якшення води, загальна твердість якої умовно рівна карбонатній і зберігається нерівність
2.) У практиці водопідготовки використовують ряд методів обробки води реагентами з метою зв'язування катіонів твердості у малорозчинні сполуки (Mg(ОH)2, СаСО3, Са3(РО4)2, Mg3(РО4)2 тощо, які потім усувають з води осадженням і фільтруванням.
Усунення карбонатної твердості води вапнуванням (декарбонізацію води) застосовують, якщо одночасно необхідно зменшити твердість і лужність, у поєднанні з подальшим Na-катіонуванням для одержання добре пом’якшеної води. Принцип способу полягає в обробці води гашеним вапном Са(ОН)2 чи вапняним молоком. Для вияснення складу солей, які будуть присутні у воді після її обробки, доцільно записати реакції у молекулярній формі - зв'язування вільної вуглекислоти: 2СО2 + Са(ОН)2 Са(HCO3)2 + Са(ОН)2 - усунення кальцієвої карбонатної твердості Са(HCO3)2 + Са(ОН)2 - усунення магнієвої карбонатної твердості Mg(HCO3)2 + 2 Са(ОН)2 За наявності у воді гідрогенкарбонатів натрію при обробці вапном утворюється осад CaCO3 і одночасно утворюється карбонат натрію 2NaHCO3 + 2Са(ОН)2 Під час вапнування відбувається переведення магнієвих солей некарбонатної твердості в малорозчинний гідроксид магнію з утворенням еквівалентної кількості кальцієвих солей сильних кислот MgSO4 + Са(ОН)2 MgCl2+ Са(ОН)2 Теоретична межа пом’якшення води вапнуванням без її підігріву визначається розчинністю карбонату кальцію і гідроксиду магнію. Так, розчинність карбонату кальцію при температурі 0оС становить 0,15 мг-екв/дм3, а при температурі 80оС – 0,03 мг-екв/дм3, а гідроксиду магнію – відповідно 0,4 і 0,2 мг-екв/дм3. Отже, теоретична межа пом’якшення природних вод вапнуванням (без надлишку карбонат-іонів і гідроксильних іонів) становить при 0оС – 0,55, а при 80оС – 0,23 мг-екв/дм3. Фактично розчинність утворених при вапнуванні сполук у природних водах залежить від іонного складу води і надлишку іонів Вапняно-содовий метод пом’якшення води застосовують для пом’якшення води будь-якого іонного складу. Додавання вапна веде до зниження твердості води за рахунок осадження кальцію і магнію в кількості, еквівалентній до вмісту у воді гідрогенкарбонат-іонів. Але хоча додавання вапна зумовлює осадження гідрогенкарбонатів кальцію та магнію у вигляді
Тому, якщо кальцій і магній містяться у воді разом з аніонами сильних кислот, у воду необхідно додатково вносити реагент, що містить іони 2СО2 + Са(ОН)2 Са(HCO3)2 + Са(ОН)2 Mg(HCO3)2 + Са(ОН)2 Mg(HCO)2 +Са(ОН)2 а потім соду, яка реагує з солями кальцію некарбонатної твердості СаSO4 + Na2СО3 СаCl2 + Na2СО3 і з солями магнію некарбонатної твердості: MgCl2 + Са(ОН)2 MgSO4 + Са(ОН)2 Внаслідок часткової розчинності карбонату кальцію та гідроксиду магнію у воді вапняно-содовим методом можна пом’якшити воду лише до твердості 0,5 мг-екв/дм3, а лужність знизити до 0,8–1,2 мг-екв/ дм3. Утворення осаду під час пом’якшення води вапном та содою відбувається у дві стадії. На першій стадії миттєво проходить хімічна взаємодія між іонами з утворенням малорозчинних сполук Зручним показником контролю правильності розрахунку доз реагентів і завершення процесу пом’якшення у відстійниках або в освітлювачах є ступінь стабільності води, яка виходить з цих споруд. Термохімічний метод пом’якшення води при температурі води понад 100оС застосовують виключно для підготовки води для парових котлів. Основними реагентами термохімічного пом’якшення є вапно і сода з добавками фосфатів або рідше гідроксиду натрію і соди. Гідроксид натрію спрощує технологію приготування та дозування реагенту, але дорожчий за соду. При високотемпературному пом’якшенні соду додають до води у деякому надлишку.. Метод застосовують для повного пом’якшення води. Установки термохімічного пом’якшення складаються з дозаторів реагентів, підігрівачів, тонкошарових відстійників чи освітлювальних фільтрів. Недоліком методу є його значна енергомісткість. Вапняно-содове пом’якшення часто поєднують з фосфатним допом’якшенням і магнезіальним обезкремнюванням. Для зменшення сульфатної твердості до води додають Ва(ОН)2, ВаСО3, ВаАl2О4, а надалі обробляють вапном і содою для допом’якшення СаSO4 + Ва(ОН)2 MgSO4 + Ва(ОН)2 Ca(OH)2 + Са(НСО3)2 СаSO4 + ВаАl2О4 СаCl2 + ВаАl2О4 MgCl2 + ВаАl2О4 MgSO4 + ВаАl2О4 Са(НСО3)2+ ВаАl2О4 Mg(НСО3)2+ ВаАl2О4 Для підготовки питної води метод непридатний через токсичність барієвих реагентів, які, окрім того, є дуже дорогими. Фосфатне допом’якшення води ведуть при температурі понад 105–150оС. У результаті залишкова твердість води становить 0,02–0,03 мг-екв/дм3. Фосфатуванням води досягають її високої стабільності, знижують її корозійний вплив на металічні трубопроводи і попереджують відкладення карбонатів на їх стінках.
Як фосфатні реагенти використовують гексаметафосфат, ортофосфат, триполіфосфат натрію тощо. Хімізм пом’якшення води триполіфосфатом описують рівняннями 3Са(НСО3)2+ 2Na3РО4 3Mg(НСО3)2+ 2Na3РО4 Трифосфати кальцію та магнію характеризуються низькою розчинністю і майже повністю випадають в осад. У зв’язку з дороговизною фосфатних реагентів фосфати застосовують лише для допом’якшення води після попереднього її пом’якшення іншими, дешевшими реагентами (вапно, сода). 3. Іонообмінне пом’якшення води ґрунтується на здатності іонітів еквівалентно обмінювати свої іони на іони, що знаходяться у розчині. Залежно від того, відбувається обмін катіонів чи аніонів, такі матеріали ділять, відповідно, на катіоніти і аніоніти. Іоніти можуть бути мінерального і органічного походження, природні та синтетичні. Процес водопідготовки методом іонного обміну, в результаті якого проходить обмін катіонів називають катіонуванням, а обмін аніонів – аніонуванням. Іоніти можуть бути мінерального і органічного походження, природні та синтетичні. Мінеральні катіоніти природного походження належать до групи алюмосилікатів натрію, кальцію, магнію, феруму, хрому – цеоліти, глини, глауконіти тощо, володіють низькою об’ємною ємністю та недостатньою хімічною стійкістю. Тому їх заміняють синтетичними мінеральними катіонітами – сумішшю розчину сульфату алюмінію, соди та рідкого скла (слабокислотні алюмосилікати – пермутити). Із катіонітів природного походження у водопідготовці використовують глауконітовий пісок та гумусове вугілля. Природними катіонітами органічного походження є гумусове, буре вугілля, торф й інші речовини, які містять малорозчинні органічні кислоти та їх солі. Найдешевшим органічним штучним силькислотним катіонітом є сульфоване вугілля – вугілля, подрібнене до невеликих зерен і оброблене для підсилення іонообмінної активності концентрованою сульфатною кислотою при високій температурі. До синтетичних органічних іонітів належать іонообмінні смоли –високомолекулярні сполуки які поділяють на катіоно- і аніонообмінні. Перші – це продукти поліконденсації фенолу та формальдегіду (фенол-формальдегідні катіоніти – КУ–1) або сульфування співполімерів стиролу (полістирольні катіоніти – КУ–2); другі – продукти поліконденсації амінів з формальдегідом або епіхлоргідрином, а також продукти приєднання основних груп до співполімерів стиролу (полістирольні аніоніти).
У практиці водопідготовки частіше використовують сильнокислотні катіоніти, що містять активні сульфогрупи, оскільки їх обмінна здатність мало залежить від рН середовища, тоді, як слабокислотні працюють лише при рН > 7. 4. На практиці застосовують Na- і H-катіонування води та їх паралельне і послідовне поєднання. Na-катіонітовий метод застосовують для пом’якшення води з вмістом вапна не більше 8 мг/дм3 і колірністю не більше 30 град. Твердість води знижується при одноступеневому натрій-катіонуванні до 0,1–0,05, при двоступеневому до 0,01мг-екв/дм3. Послідовність роботи Na-катіонітового фільтра, зображеного на рис.7 складається з наступних чотирьох операцій: фільтрування води крізь шар катіоніту до моменту досягнення гранично-допустимої твердості у фільтраті (швидкість фільтрування води 10-25м3/год), зрихлення шару катіоніту висхідним потоком пом’якшеної води, регенерація катіоніту розчином кухонної солі та відмивання регенерованого катіоніту від надлишку кухонної солі та солей калцію та магнію. Під час Na-катіонування мають місце такі реакції: 2[Кат]Na + Ca(HCO3)2 2[Кат]Na + Mg(HCO3)2 2[Кат]Na + CaSO4 2[Кат]Na + MgSO4 2[Кат]Na + CaCl2 2[Кат]Na + MgCl2 де [Кат] – високомолекулярний аніон Na-катіоніту.
Рис.7. Будова іонітового фільтра Загальна лужність води після Na-катіонування практично не змінюється. Під час пом’якшення води з високою карбонатною твердістю утворюється гідрогенкарбонат натрію, який гідролізує з утворенням лугу: NaHCO3 + H2O Тому у цьому випадку для усунення надлишкової лужності використовують Na-катіонування з підкисленням пом’якшеної води сульфатною або хлоридною кислотами. Під час Na-катіонування також збільшується загальна мінералізація води, яка залежить від значень еквівалентів (у мг/мг-екв) обмінюваних іонів Пом’якшення води Н-катіонуванням ґрунтується на її фільтруванні крізь шар катіоніту, який містить обмінні Н+ іони і відбувається за наступною схемою: 2[Кат]Н + Ca(HCO3)2 2[Кат]Н + Mg(HCO3)2 2[Кат]Н + CaSO4 2[Кат]Н + MgSO4 2[Кат]Na + CaCl2 2[Кат]Na + MgCl2 Під час Н-катіонування значно зменшується значення pH води через кислоти, які нагромаджуються у фільтраті. Н-катіонітові фільтри регенерують 1–1,5%-м розчином сульфатної або 5–6%-м розчином хлоридної кислоти.СO2,що виділяється під час катіонування усувають дегазацією.
При регенерації Н-катіонітових фільтрів кислотою у недостатній кількості для З наведених вище реакцій для натрій-катіонітового пом’якшення видно, що лужність води у процесі іонного обміну змінюється. Після Н-катіонування фільтрат стає кислішим, а після Na-катіонування – більш лужним. Одержувати воду різної лужності можна, змішуючи пропорційно кислий фільтрат після Н-катіоніту з лужним фільтратом після Na-катіоніту. У цьому і є суть та перевага методу: застосування послідовного, паралельного та змішаного Н-Na-катіонування для пом’якшення води і досягнення певної лужності. При паралельному Н-Na-катіонуванні (рис. 8) частину води пропускають крізь Na-катіонітовий фільтр, частину – крізь Н-катіонітовий фільтр (перша ступінь пом’якшення). Після цього потоки об’єднують у таких пропорціях, щоб залишкова лужність після пом’якшення не перевищувала 0,4 (для глибшого пом’якшення до 0,01) мг-екв/дм3, а надалі пропускають крізь
Рис. 8. Схема паралельного Н-Na-катіонування 1 – Na-катіонітовий фільтр І ступеня; 2 – Н-катіонітовий фільтр; 3 – декарбонізатор; 4 – Na-катіонітовий фільтр ІІ ступеня декарбонізатор і подають на другу ступінь катіонування. Пом’якшення води відбувається за реакціями описаним вище. При змішуванні фільтратів відбувається реакція нейтралізації лужності води: Н2SO4 + 2NaHCO3 → Na2SO4 + 2СO2 + 2Н2O. Схему паралельного Н-Na-катіонування доцільно застосовувати у тих випадках, коли сумарна концентрація сулфат- і хлорид-іонів не перевищує 4 мг-екв/дм3, а вміст натрію не більший за 2 мг-екв/дм3. При послідовному Н-Na-катіонуванні (рис. 9) воду послідовно пропускають крізь Н-катіонітовий і Na-катіонітовий фільтри. Одержану суміш подають у дегазатор для вилучення діоксиду вуглецю, а далі – на Na- катіонуй1вання. Ця схема дозволяє повніше використати обмінну ємність Н-катіоніту та знизити витрату кислоти на його регенерацію На практиці водопідготовки використовують катіонування в одну, дві та більше стадій (ступеневе пом’якшення), коли воду, що пройшла паралельне чи послідовне Н-Na-катіонування після дегазації подають на Н-чи Na-катіонітовий фільт для остаточного знесолення.
Рис. 9. Схема послідовного Н-Na-катіонування 1 – Н-катіонітовий фільтр; 2 – Na-катіонітовий фільтр І ступеня; 3 – декарбонізатор; 4 – Na-катіонітовий фільтр ІІ ступеня Для глибокого знесолення вод послідовно пропускають крізь Н-каіонітовий і аніонітовий фільтри. У Н-катіонітовому фільтрі катіони кальцію, магнію, натрію тощо обмінюються на іон Н+ катіоніту і у фільтраті нагромаджуються сильні кислоти. Для вилучення аніонів воду подають на ОН-аніонітовий фільтр, де одночасно відбувається й нейтралізація кислот: 2[A]OH + Н2SO4 → [A]2SO4 + 2Н2O [A]OH + НCl → [A]Cl + Н2O ОН-аніонітові фільтри регенерують 2%-м розчином NaOH або кальцинованої соди: [A]2SO4 + 2NaОН → 2[A]ОН+ Na2SO4 [A]2SO4 + Na2СО3 → [A]2СО3 + Na2SO4 Для повного знесолення води застосовують модифіковану технологію з використанням змішаних шарів, що складаються з іоніту в Н+- та ОН ˉ -формі. Змішаний шар іонітів розміщують у спеціальному фільтрі змішаної дії, які дозволяють фільтрувати воду з підвищеною швидкістю – 50–100 м3/год при висоті шару 1–1,2 м. Катіонування у фільтрі змішаної дії представлено на рис. 10.У цій технології застосовують сильнокислотні та сильноосновні іоніти за умови, що початкова вода містить мало іонізованих домішок. 5. Глауконіт – природна глина, Na-катіоніт – алюмосилікат феруму, магнію і калію загальної формули Підстилочний шар кварцового піску значно зменшує корисний об’єм фільтра. У нових конструкціях роблять безпідстилочний дренаж у вигляді днища з рівномірно розподіленими щілинами шириною 0,4–0,5 мм. Це дозволяє звільнити до 40% об’єму фільтру. Завантаження фільтру служить багато років і вимагає лише періодичного додавання глауконіту (5–10% у рік). Після завершення певного періоду роботи фільтра здатність глауконіту до обміну катіонів зменшується, тому його регенерують пропусканням крізь нього 10%-го розчину NaCl. Технологія очистки води на глауконітовому фільтрі така: вихідна вода із напірного збірника поступає у верхню частину фільтра. Пом’якшена вода відводиться у збірник знизу апарату. Фільтр за допомогою кранів з’єднаний з каналізацією для відведення промивних вод. Після завантаження фільтраційних шарів кришку ємкості щільно закривають, промивають глауконіт водою 24 год до одержання прозорого фільтрату. Після промивки глауконіт розрихлюють потоком води, який подають у напрямку, зворотному до фільтрування. Після регенерації фільтр промивають водою до повного зникнення солі, після чого він готовий до експлуатації. Тривалість одного циклу становить 360 хв, зокрема: тривалість роз рихлення глауконіту – 10 хв, регенерації – 15 хв, промивки – 35 хв, пом’якшення води – 300 хв. Швидкість фільтрування – 200 дал/год. Межа пом’якшення на такому фільтрі – 0,1–0,5 мг-екв/ дм3. Аналогічну будову має фільтр, в якому для пом’якшення води використовують сульфовугілля. У цьому випадку, замість глауконіту фільтр завантажують сульфовугіллям марки К (крупний). Використання сульфовугілля дає кращі результати, тому що його ємність поглинання вища, порівняно з глауконітом.
|
|||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1030; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.186.6 (0.067 с.) |
 CaCO3↓+ CO2↑+ H2O.
CaCO3↓+ CO2↑+ H2O. .
. і ОНˉ.
і ОНˉ. та
та  , проте твердість води не зменшує, а замінює магнієву твердість на кальцієву.
, проте твердість води не зменшує, а замінює магнієву твердість на кальцієву. . Спочатку в пом’якшувану воду вносять вапно (у вигляді 2–3%-го водного розчину), яке зв’язує вільну вуглекислоту та усуває кальцієву і магнієву карбонатні твердості (при надлишку вапна карбонат магнію взаємодіє з ним з утворенням осаду гідроксиду магнію):
. Спочатку в пом’якшувану воду вносять вапно (у вигляді 2–3%-го водного розчину), яке зв’язує вільну вуглекислоту та усуває кальцієву і магнієву карбонатні твердості (при надлишку вапна карбонат магнію взаємодіє з ним з утворенням осаду гідроксиду магнію):
 =23, ЕСа =20,
=23, ЕСа =20,  =12:
=12:  . Фільтр після зменшення обмінної ємкості регенерують 5–8%-м розчином NaCl.
. Фільтр після зменшення обмінної ємкості регенерують 5–8%-м розчином NaCl.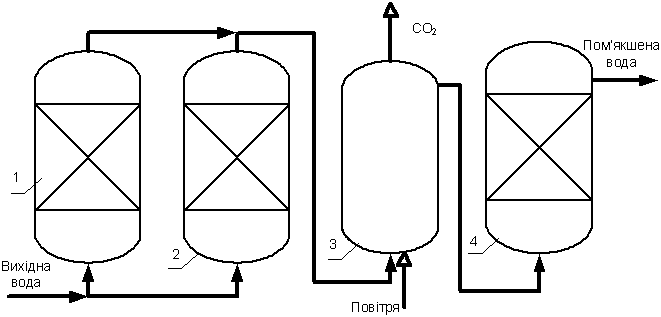

 , де Ме – катіон лужного або лужноземельного металу, n – його валентність. Будова глауконітового фільтра аналогічна до будови пісочного. Його завантажують у такій послідовності: на відстані 60 мм від дна на борти фільтра вкладають металеву сітку з отворами діаметром 1 мм. На сітку насипають кварцову підстилку у вигляді трьох шарів: нижнього, який складається із зерен кварцового піску розміром 5–7 мм висотою 70 мм; середнього (2,5–5 мм) – 50 мм та верхнього (1,5–2,5 мм) висотою 30 мм. На кварцовий пісок насипають шар глауконіту висотою 700 мм. Шар кварцу і глауконіту ретельно розрівнюють. Зверху на глауконіт вкладають металеву сітку для рівномірного розподілу рідини.
, де Ме – катіон лужного або лужноземельного металу, n – його валентність. Будова глауконітового фільтра аналогічна до будови пісочного. Його завантажують у такій послідовності: на відстані 60 мм від дна на борти фільтра вкладають металеву сітку з отворами діаметром 1 мм. На сітку насипають кварцову підстилку у вигляді трьох шарів: нижнього, який складається із зерен кварцового піску розміром 5–7 мм висотою 70 мм; середнього (2,5–5 мм) – 50 мм та верхнього (1,5–2,5 мм) висотою 30 мм. На кварцовий пісок насипають шар глауконіту висотою 700 мм. Шар кварцу і глауконіту ретельно розрівнюють. Зверху на глауконіт вкладають металеву сітку для рівномірного розподілу рідини.


