
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція 2. Іонний склад та стабільність води
План лекції 1. Іонний склад води, види твердості води. 2. Показники стабільності води. 3. Загальна характеристика сполук вугільної кислоти. 4. Лужність води. Форми лужності. 5. Визначення вільної, рівноважної і агресивної вуглекислоти.Розрахунок індексу стабільності води.
1. Основна частина мінеральних солей, розчинених у природних водах, належить до сильних електролітів і повністю дисоційована на іони. Тому сума катіонів води завжди рівна сумі аніонів води. Загальний вміст основних солей у воді визначають аналітично кількістю катіонів натрію, калію, кальцію, магнію і гідрогенкарбонат-, сульфат і хлорид-аніонів. Інші іони присутні у воді у незначній кількості, хоч їх вплив на властивості та якість води інколи дуже суттєвий. Вміст іонів калію і натрію, аналітичне визначення яких є трудомістким, розраховують із рівності катіонно-аніонного складу води. Для розрахунку використовують результати аналізів, виражені у мг-екв/дм3:
У перерахунку на натрій ця кількість становить у мг/дм3:
де 23 – еквівалентна маса натрію, мг/мг-екв. Для процесів водопідготовки (пом’якшення, вилучення іонів феруму, знесолення), в основі яких лежить обробка води шляхом зміни рН середовища, та й для процесів приготування безалкогольних напоїв важливо мати уяву про утворення солей, які при зміні pH води послідовно утворюють малорозчинні сполуки. Тому для перед використанням природних вод у технологічному процесі будують діаграму гіпотетичного складу солей, які послідовно утворюють осади при збільшенні значення рН (табл. 8). За результатами аналізу катіонно-аніонного складу розраховують: 1) загальний вміст солей – загальну мінералізацію – (МЗ) у мг/дм3:
де
С і – концентрація іону, мг-екв/дм3, Е і – еквівалентна маса і -го іону, мг/мг-екв. Значення МЗ визначає категорію досліджуваної води. Залежно від кількості розчинених речовин у 1дм3 води розрізняють: прісну воду - менше 1г; слабко мінералізовану - 1–5 г; мінералізовану - 5–50; ропу - понад 50 г; 2) сухий залишок (СЗ) у мг/дм3:
Таблиця 8 Діаграма гіпотетичного складу солей води
Розрізняють сухий, щільний і пропалений залишки. Сухий залишок визначають безпосередньо з досліджуваної проби води, щільний – з її фільтрату. Пропалений залишок, який дозволяє оцінити співвідношення мінеральних та органічних речовин у воді, визначають пропалюванням сухого або щільного залишку при температурі 800оС. Це співвідношення є орієнтовним, оскільки в результаті пропалювання не лише згоряють органічні речовини, але й частково розкладаються карбонати і летять хлориди.
Важливою технологічною характеристикою є твердість води. Використання твердої води призводить до небажаних наслідків, а саме: відкладення накипу на поверхні теплообмінних апаратів (котлів, холодильників тощо), що погіршує теплообмін; до посилення корозії котлів і теплообмінників; до збільшення непродуктивних витрат миючих засобів; до погіршення харчових властивостей продуктів та напоїв. Твердість природної води зумовлена наявністю в ній розчинних солей кальцію, магнію, феруму (ІІ) і (ІІІ), барію тощо. Розрізняють тимчасову, карбонатну, постійну, загальну, а також кальцієву та магнієву твердості води. Загальна твердість 1 мг-екв/дм3 відповідає вмісту 20,04 мг Са2+ або 12,16 мг Mg2+ в 1 дм3 води. Загальна твердість складається з кальцієвої
Різницю між загальною та карбонатною твердостями називають некарбонатною (постійною) твердістю
Загальна твердість – це також сума тимчасової та постійної твердості. За її значенням у мг-екв/дм3 природну воду класифікують як: ü дуже м ’ яку – 0–1,5; ü м ’ яку – 1,5–3; ü середньої твердості – 3–4,5; ü достатньо тверду – 4,5–6; ü тверду – 6–10; ü дуже тверду – понад 10.
2. Іони феруму практично завжди, а іони мангану рідше, присутні у поверхневих і підземних водахі присутня у колоїдній і нерозчинній формі. Іони Fe2+ у воді у присутності розчиненого кисню дуже швидко переходить у тривалентну форму і утворює малорозчинний гідроксид феруму (ІІІ), який випадає в осад: Підвищений вміст феруму та мангану вказує також на забруднення води виробничими стоками і надає їй неприємного червоно-коричневого або чорного відтінку, погіршує смак, зумовлює відкладання осаду у трубах та їх заростання. У поверхневих водах ферум може входити до складу органічних сполук, за наявності яких розвиваються залізобактерії. Надмір іонів феруму у воді викликає у людини ризик інфаркту, захворювання печінки, негативно впливає на репродуктивну функцію. Природний вміст сульфатів у поверхневих і ґрунтових водах зумовлений вивітрюванням порід та біохімічними процесами у водоносних шарах. Сульфат-іони містяться в усіх природних водах, у концентраціях не більше 60–100 мг/л. Підвищена концентрація сульфатів може також свідчити про забруднення джерела стічними водами, в основному промисловими. Певною мірою вміст сульфат-іонів визначає некарбонатну твердість води. Вони утворюють з іонами кальцію важкорозчинну сіль, а при високих концентраціях органічних домішок за відсутності кисню можуть відновлюватись до сульфід-іонів. У результаті вода набуває неприємного запаху сірководню. У підвищених концентраціях сульфат-іони надають воді підсиленого соленого смаку і негативно впливають на роботу кишково-шлункового тракту. Хлориди є складовою частиною більшості природних вод. Вони визначають некарбонатну твердість води. У воді рік концентрація хлоридів не перевищує 10 мг/дм3, тому підвищений вміст хлорид-іонів свідчить про її забруднення стічними водами. Вода з великим вмістом сульфатів і хлоридів має підвищену корозійну активність і може руйнувати залізобетонні конструкції. У природній воді присутні силікати і силікатна кислота, ступінь іонізації якої визначається величиною pH води. У природних водах силікатна кислота може знаходитися у формі мета–силікатної H2SiO3 (SiO2 · H2O), ортосилікатної H4SiO4 (SiO2 · 2H2O) і полісилікатної H2Si2O5 (2SiO2 · H2O) кислот. Усі ці кислоти при звичайних для природних вод значеннях pH є малорозчинними і утворюють у воді колоїдні розчини. Флуор у високій концентрації зустрічається переважно у підземних водах тих регіонів, водоносні горизонти яких представлені породами, які містять його сполуки. Фтористий кальцій і фтористий магній є малорозчинними сполуками та через незначні концентрації у присутності іонів кальцію і магнію вони не осаджуються. Тому самоочищення води від флуору практично не відбувається, якщо мало місце її забруднення флуоровмісними виробничими стічними водами, або внаслідок місцевого живлення джерела ґрунтовими водами, які містять флуор. При перевищенні концентрації флуору у воді понад норму в людей, які споживають таку воду спостерігається флюороз зубів – спочатку з’являються білі крейдоподібні, а потім пігментовані плями на зубах і зменшується їх міцність. При нестачі в раціоні людей флуору, і насамперед у питній воді, населення хворіє карієсом зубів, тому передбачають заходи по регулюванню вмісту флуору у воді.
Йод міститься в незначній кількості у більшості природних вод. Це біологічно активний і важливий мікроелемент, фізіологічне значення якого пов’язують з поширенням ендемічного зобу – захворювання, викликаного недостачею йоду у раціоні харчування людей. Разом з питною водою та їжею людина повинна споживати 0,05–0,1 мг йоду щодобово. На Україні передбачений випуск йодованої солі та олії. Підвищені концентрації у воді стронцію викликають рахіт, ламкість костей, надлишок ртуті викликає хворобу Мінамата. Зайва кількість цинку пригнічує окиснювальні процеси та викликає рахіт, а надлишкова мідь – викликає захворювання печінки, гепатит і анемію. У воді природних джерел найчастіше присутні кисень, вуглекислота і сірководень. Наявність кисню і вуглекислоти не погіршує якості питної води, але сприяє корозії металу і бетону. Сірководень міститься у деяких підземних водах, а його присутність у поверхневих водах вказує на забруднення джерела стічними водами. Сполуки сірководню можуть знаходитися у воді у вигляді молекулярно розчиненого H2S, гідрогенсульфідів HS– і сульфідів S2–. Співвідношення між різними формами залежить від значення pHводи При рН < 4 у воді міститься сірководень лише у формі H2S, при 7> рН >4 вміст вільного H2S зменшується, натомість з’являються іони HS –, концентрація яких збільшується при 10 > рН > 7. При рН > 7 в розчині переважають йони HS –, і починають з’являтись сульфід-іони S2–, максимальна концентрація яких можлива за рН > 10. При наявності у воді іонів Fe2+ утворюється дрібнодисперсний осад сульфіду феруму (ІІ). Це явище досить часто спостерігають у тупикових ділянках водопроводу з малим обміном води. У результаті життєдіяльності сульфатредукуючих бактерій сульфати перетворюються на сульфіди і реагують з іонами феруму. Сірководень – токсичний газ, надає воді неприємний запах, у господарсько-питній воді його присутність не допускається.
3. Вуглекислота присутня у всіх природних водах і має суттєвий вплив на якість напоїв на їх основі, а також суттєво впливає на процеси водопідготовки. У природних водах сполуки вугільної кислоти знаходяться у вигляді недисоційованих молекул H2CО3, молекулярно розчиненого вуглекислого газу СО2 та гідрогенкарбонат - (рН < 8,4) і карбонат -іонів (рН > 8,4). Загальний вміст вуглекислоти у природних водах становить від десятих до сотень мг/дм3. Зокрема у ріках та озерах, він практично не перевищує 20–30 мг/дм3, а у підземних немінеральних джерелах – 90 мг/дм3. Розчинений газоподібний СО2 реагує з водою з утворенням слабкої вугільної кислоти
Цю форму називають вільною вуглекислотою CО2,В і характеризують сумою концентрацій СО2 та H2CО3 у перерахунку на СО2 (оскільки у природних водах концентрація недисоційованих молекул H2CО3 порівняно з концентрацією CО2,В дуже низька). У поверхневих водах вміст CО2,В не перевищує 20 мг/дм3, а підземних джерелах водопостачання вміст вуглекислоти вищим за 40 мг/дм3. Форму вуглекислоти, яка міститься у воді, можна визначити за константами дисоціації, які розраховують за загальним вмістом у воді СО2 та H2CО3 і концентраціями будь-яких двох іонів, що є у рівнянні дисоціації. Вугільна кислота двоосновна і дисоціює у воді у дві стадії
Кількісні співвідношення між окремими сполуками в розчині визначаються рівняннями першого та другого ступеня дисоціації вугільної кислоти, записаними згідно закону збереження мас. Константи дисоціації H2CО3 першої та другої стадій відповідно становлять:
Значення К1 та К2 відрізняються приблизно на чотири порядки, що свідчить про те, що у природній воді містяться переважно гідрогенкарбонат-іони, а вміст карбонат-іонів незначний. Частку СО2, яка припадає на гідрогенкарбонат- та карбонат-іони називають гідрогенкарбонатною та карбонатною вуглекислотою. Загальний вміст (у мг/дм3) вуглекислоти у воді (СО2,З) є сумарною концентрацією всіх трьох її форм. З рівнянь дисоціації H2CО3також випливає, що концентрації СО2, H2CО3, іонів
Рис. 2. Співвідношення між масовим вмістом СО2,
Практично можна вважати, що у природній воді при pH < 4,5 міститься лише вільна вуглекислота; при pH4,5–8,4 додатково з’являються іони
4. Присутність у природних водах солей вугільної кислоти впливає на розчинність карбонатів кальцію і магнію та зумовлює такий показник, як лужність води ( Лужність води визначають за вмістом у ній гідроксильних іонів та речовин, здатних реагувати з сильними кислотами і виражають у мг-екв/дм3. Залежно від типу аніонів, які зумовлюють лужність, розрізняють карбонатну, гідрогенкарбонатну, гідратну, силікатна, гуматну, боратну та фосфатну лужності.
Загальну лужність води виражають рівнянням
Оскільки у природних водах переважають гідрогенкарбонати та карбонати, визначають лише карбонатну, гідрогенкарбонатну та гідратну лужності. Цей показник визначає буферну ємність природної води і має важливе значення у технології водопідготовки. Експериментально лужність визначають послідовним титруванням проби води розчином хлоридної чи сульфатної кислот у присутності індикаторів фенолфталеїну і метилового оранжевого, або з визначенням точки еквівалентності за допомогою pH-метра. При титруванні проби води розчином кислоти забарвлення фенолфталеїну при рН8,2–8,4 переходить з рожевого у безколірне, що співпадає з таким станом розчину, коли у ньому залишаються лише гідрогенкарбонати та вільна вуглекислота. Метилоранж міняє забарвлення при рН4–4,3, коли у розчині залишається лише вільна вуглекислота. Порівнюючи кількість кислоти, витраченої на титрування за метилоранжем з кількістю кислоти, витраченої при титруванні з фенолфталеїном, можна визначити вид лужності. При титруванні з фенолфталеїном відбуваються реакції нейтралізації гідроксид- та карбонат-йонів з утворенням відповідно води та гідрогенкарбонат-йону:
Як видно, витрата кислоти на титрування з фенолфталеїном еквівалентна вмісту гідроксид- та половині вмісту карбонат-йонів, так як останній нейтралізується лише наполовину. Визначену лужність називають лужністю за фенолфталеїном (
При подальшому титруванні у присутності метилоранжу відбувається реакція нейтралізації
яка завершується при pH4,5, що відповідає точці зміни забарвлення індикатора метилового оранжевого з жовтого на рожеве.
Таким чином визначають загальну лужність води(
Для роздільного визначення форм лужності води додатково встановлюють її лужність за фенолфталеїном (точка еквівалентності при pH8,3–8,4). При титруванні проби досліджуваної води розчином HCl у присутності фенолфталеїну мають місце лише реакції (4) та (5). Концентрацію окремих форм лужності води розраховують за допоміжними таблицями або за номограмами, керуючись даними про загальну лужність води, її водневий показник (pH), температуру та загальний вміст солей.
3. Стабільність води визначають при виборі джерела водопостачання, виконанні будівельних робіт і під час контролю властивостей води на діючих установках. Воду називають стабільною, якщо при контакті з бетонними та металевими поверхнями вона не змінює свій хімічний склад, тобто не розчиняє та не виділяє карбонат кальцію. Важкорозчинні солі СaCO3 та MgCO3 розчиняються лише у присутності СО2 за рівняннями
У природних водах встановлюється динамічна хімічна рівновага між різними формами вуглекислоти, яка в іонній формі виражається рівнянням
Константа рівноваги цієї системи запишеться у вигляді рівняння
Концентрації [ СаCО3 ] і [ H2O ] є постійними величинами, тому їх об’єднують з константою рівноваги К. Тоді
де З рівняння випливає, що гідрогенкарбонат-іони можуть знаходитися у розчині лише за наявності у ньому вільної вуглекислоти. При цьому, певній концентрації у воді іонів Концентрацію [CO2] Р (ммоль/дм3)у воді знаходять за рівнянням
Інколи вміст вільної вуглекислоти у воді перевищує кількість вуглекислоти, необхідної для розчинення карбонатів, тобто вміст у воді вільної вуглекислоти може бути більшим, ніж її рівноважна концентрація. Кількість вільної вуглекислоти, яка перевищує рівноважну називають агресивною вуглекислотою – Стабільність води оцінюють, порівнюючи концентрацію у ній
Якщо
Для визначення вмісту агресивної вуглекислоти ( Зручнішим для практичної оцінки стабільності води є метод Ланжельє, згідно якого на основі даних хімічного аналізу води розраховують індекс стабільності води за значенням рН, що відповідає її рівноважному стану у водному розчині вуглекислих сполук.
4. У практиці водопостачання стабільність води визначають за значенням індексу насичення води карбонатом кальцію (індексу стабільності – І), який розраховують за рівнянням
де
Значення
Вода є стабільною, якщо
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 728; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.0.25 (0.091 с.) |
 ,
, ,
,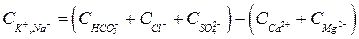 .
. ,
,
 ,
, – концентрації відповідних іонів (у мг/дм3) обчислені за формулою
– концентрації відповідних іонів (у мг/дм3) обчислені за формулою ,
,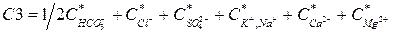 .
.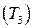 характеризує вміст у воді катіонів кальцію і магнію в мг-екв/дм3:
характеризує вміст у воді катіонів кальцію і магнію в мг-екв/дм3:  .
. і магнієвої
і магнієвої  твердостей. Залежно від аніонного складу твердість води поділяють на к арбонатну
твердостей. Залежно від аніонного складу твердість води поділяють на к арбонатну  , яку визначають за вмістом у воді гідрогенкарбонатів і карбонатів кальцію та магнію. Якщо кількість гідрогенкарбонатів води перевищує загальний вміст кальцію та магнію, то карбонатна твердість дорівнює загальній, а якщо навпаки, то карбонатна твердість дорівнює концентрації гідрогенкарбонат і карбонат іонів:
, яку визначають за вмістом у воді гідрогенкарбонатів і карбонатів кальцію та магнію. Якщо кількість гідрогенкарбонатів води перевищує загальний вміст кальцію та магнію, то карбонатна твердість дорівнює загальній, а якщо навпаки, то карбонатна твердість дорівнює концентрації гідрогенкарбонат і карбонат іонів: .
. . Вона зумовлена присутністю сульфатів, хлоридів і нітратів кальцію та магнію. Тимчасова твердість обумовлена наявністю гідрогенкарбонатів, які під час кип’ятіння переходять у нерозчинні карбонати, які випадають в осад.
. Вона зумовлена присутністю сульфатів, хлоридів і нітратів кальцію та магнію. Тимчасова твердість обумовлена наявністю гідрогенкарбонатів, які під час кип’ятіння переходять у нерозчинні карбонати, які випадають в осад.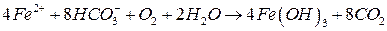





 і
і  знаходяться у кількісному взаємозв’язку з pH води. Для перевірки результатів аналізу на вміст форм вуглекислоти у воді та для теоретичного розрахунку pH води використовують вуглекислотні номограми. При чіткому виконанні аналізів різниця між експериментальним та розрахованим теоретичним значенням pH, як правило, не перевищує 0,2–0,3.
знаходяться у кількісному взаємозв’язку з pH води. Для перевірки результатів аналізу на вміст форм вуглекислоти у воді та для теоретичного розрахунку pH води використовують вуглекислотні номограми. При чіткому виконанні аналізів різниця між експериментальним та розрахованим теоретичним значенням pH, як правило, не перевищує 0,2–0,3.
 ).
).



 ) і розраховують за рівнянням
) і розраховують за рівнянням

 ,
,


 ,
,
 .
.
 ,
, – константа вуглекислотної рівноваги.
– константа вуглекислотної рівноваги. ). Її вміст можна розрахувати за значенням величину
). Її вміст можна розрахувати за значенням величину  та
та  виражені у моль/л.
виражені у моль/л. .
. . Її наявність є основною причиною порушення стабільності води.
. Її наявність є основною причиною порушення стабільності води. з розрахунковою величиною
з розрахунковою величиною  . Вода є стабільною, якщо
. Вода є стабільною, якщо  . Якщо концентрація
. Якщо концентрація  , то вуглекислотна рівновага зсувається вправо, що зумовлює випадання карбонату кальцію в осад за реакцією
, то вуглекислотна рівновага зсувається вправо, що зумовлює випадання карбонату кальцію в осад за реакцією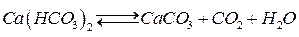
 , то рівновага зсувається у напрямку зворотної реакції і карбонат кальцію розчиняється у воді:
, то рівновага зсувається у напрямку зворотної реакції і карбонат кальцію розчиняється у воді: ,
, – фактичне значення pH води, визначене вимірюванням;
– фактичне значення pH води, визначене вимірюванням; – значення pH води, яке відповідає її максимальному насиченню карбонатом кальцію.
– значення pH води, яке відповідає її максимальному насиченню карбонатом кальцію. , мг/л), лужність води (
, мг/л), лужність води ( .
. ; якщо
; якщо  , то у ній випадає в осад карбонат кальцію; якщо
, то у ній випадає в осад карбонат кальцію; якщо  , то вода є агресивною до металу та бетону і потребує стабілізаційної обробки.
, то вода є агресивною до металу та бетону і потребує стабілізаційної обробки.


