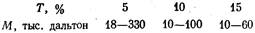5%-ный (0,9 М) раствор уксусной кислоты с добавлением 4 —
8 М мочевины часто используют для электрофоретического
фракционирования гистонов [Panyim, Chalkley, 1969]. Молеку-
лярные массы гистонов лежат в диапазоне 11 — 22 тыс. дальтон,
поэтому для их разделения используют мелкопористые гели
(T = 15 — 20). Положительно заряженные в кислой среде гисто-
ны мигрируют в направлении катода. Наибольшей подвижностью
обладает гистон Н4, затем следуют Н2А, Н2В и НЗ, которые в
этой простой системе разделяются довольно плохо. От них за-
метно отстает относительно более крупный гистон H1. В каче-
стве лидирующего красителя используют пиронин.
Недавно Спайкер описал систему фракционирования гисто-
нов в двуступенчатом ПААГ с «кислой мочевиной». Основной
рабочий гель — пластина (толщиной 0,5 мм) 15%-го ПААГ в
0,9 М СН3СООН с 2,5 М мочевины. Над ним полимеризована
полоска формирующего геля: 7,5% ПААГ в 0,375 М СН3СООК,
рН 4, с 2,5 М мочевины. Электрофорез при повышенном напря-
жении — за 1 — 2 ч. Качество полос и их разрешение в такой си-
стеме сильно выигрывают [Spiker, 1980].
Электрофорез «в кислой мочевине» успешно используют и
для фракционирования других щелочных белков: рибосомных,
факторов инициации трансляции, субъединиц РНК-полимеразы
и др. Впрочем, намного более совершенное разделение сложных
смесей этих белков происходит при двумерном электрофорезе,
когда фракционирование «в кислой мочевине» используют в од-
ном из направлений. Ниже, при анализе метода двумерного
электрофореза, будут даны соответствующие ссылки.
Если есть опасение, что воздействие уксусной кислоты на бе-
лок может оказаться слишком жестким, то ее 50%-ный раствор
титруют КОН до рН 4,3 — 4,5. При этом надо иметь в виду, что
электропроводность такого буфера будет за счет ионов калия
значительно выше, чем одной уксусной кислоты, что потребует
соответствующего уменьшения напряжения, подаваемогона
гель.
Описано электрофоретическое разделение гистонов и при
рН 7,8 (0,18 М глицилглицин, титрованный NaOH), которое ис-
пользуется для изучения гистон-гистонового взаимодействия и
некоторых лабильных модификаций гистонов. Все гистоны, кро-
ме H1, при этом почти одинаково и относительно слабо заряже-
ны, поэтому фракционирование идет главным образом по моле-
кулярной массе. Добавление мочевины предупреждает агрега-
цию гистонов, однако несколько изменяет взаимное расположе-
ние полос. Мочевина разворачивает гистоны Н2А, Н2В и Н3,
но не влияет на конфигурацию H1 и Н4. По-видимому, эти по -
следние развернуты и в отсутствие мочевины [Hoffman, Chalk-
ley, 1976].
Щелочные белки рибосом удается разделять не только в кис-
лых, но и в слегка щелочных условиях, например в Трис-борат-
ном буфере, рН 8,7. Электрофорез проводят в 4%-ном ПААГ
[Howard, Traut, 1973]. Исходный белковый препарат полимери-
зуют в геле с мочевиной на середине высоты трубки. Вблизи изо-
электрической точки часть рибосомальных белков оказывается
заряженной отрицательно, а другая — положительно. Миграция
в электрическом поле идет в обе стороны, к катоду и аноду. Ще-
лочные белки рибосом при рН 8,7 растворяются с трудом и толь-
ко в присутствии 6 М мочевины, которую вводят также и в бу-
фер геля.
Электрофорез хроматина. Электрофоретическое фракциони-
рование хроматина после его обработки микрококковой нуклеа-
зой ведут в буфере низкой ионной силы, например в 0,01 М три-
этиламмоний-НСl (рН 7,6; 2 мМ ЭДТА), что обусловлено плохой
растворимостью хроматина в более концентрированных буферах.
Хроматин в целом (благодаря ДНК) заряжен отрицательно и
мигрирует к аноду. Удается разделить субнуклеосомы, моно-
нуклеосомы с различным содержанием ДНК и белков, лежащих
вне их «ядра» («core»), а также ди- и тринуклеосомы. Ввиду
малой электропроводности разбавленного буфера при напря-
женности 15 В/см сила тока через трубку диаметром 6 мм со-
ставляет всего лишь 3 мА. Электрофорез в трубках длиной 7 см
занимает 1,5 ч.
РАЗДЕЛЕНИЕ БЕЛКОВ ПО РАЗМЕРУ
С ИСПОЛЬЗОВАНИЕМ ДДС-Na
Существо метода
Рассмотренный выше электрофорез белков в простой систе-
ме удобно использовать для их разделения, но не для характери-
стики. Электрофоретическая подвижность каждого белка в про-
стой системе зависит одновременно и от его суммарного заряда,
и от молекулярной массы, и от конфигурации, и, наконец, от
жесткости упаковки полипептидной цепи. Вклад каждого из этих
факторов неизвестен и может существенно изменяться в зави-
симости от условий электрофореза. Для установления строгой
количественной корреляции между каким-либо одним из пере-
численных параметров и электрофоретической подвижностью
белка надо исключить влияние всех остальных.
Электрофорез в ПААГ с использованием ДДС-Na позволяет
фракционировать белки в зависимости от значений только од-
ного параметра — их молекулярной массы. Для этого белки в
исходном растворе препарата обрабатывают не менее чем трех-
кратным избытком ДДС-Na. За счет гидрофобных взаимодей-
ствий детергент примерно одинаково связывается с подавляю-
щим большинством белков в соотношении 1,4 мг ДДС-Na на
1 мг белка [Reynolds, Tanford, 1970]. Огромный избыток пол-
ностью диссоциированных остатков сульфокислоты, привноси-
мых с детергентом, в большинстве случаев делает несуществен-
ной роль собственного заряда белка. Постоянство соотношения
детергент/белок делает практически одинаковым отношение от-
рицательного заряда к массе для любого белка, даже для гисто-
нов с их заметным собственным положительным зарядом. Бла-
годаря электрическому отталкиванию
тесно расположенных по поверхности
белка остатков серной кислоты поли-
пептидная цепочка распрямляется и
приобретает форму жесткого эллипсои-
да вращения. Его малая ось имеет дли-
ну 1,6 нм, а размер большой линейно
связан с числом аминокислотных остат-
ков, а следовательно, с молекулярной
массой белка. Это справедливо лишь
для неразветвленных полипептидов, ли-
шенных дисульфидных мостиков, поэ-
тому одновременно с обработкой ДДС-
Na необходимо обеспечить полную де-
натурацию белка и разрыв всех S—S-
связей. С этой целью белковый препа-
рат обрабатывают высокой концентра-
цией b-меркаптоэтанола при повышен-
ной температуре.
| Рис. 18. Линейная зависи- мость логарифма молеку- лярной массы (Ig M) от от- носительного расстояния миграции белков (Rf) при электрофорезе в ПААГ
|
Электрофоретическая подвижность
(и') жесткого комплекса белок — ДДС-Na оказывается связан-
ной с молекулярной массой белка (М) простым соотношением:
и'=А — В lg М, где А и В — коэффициенты, зависящие от порис-
тости геля, температуры и других условий эксперимента. Вели-
чину и' удобнее представлять в относительных единицах, выра-
жающих отношение путей миграции белка и бромфенолового
синего за время электрофореза, т. е. в значениях введенной ра-
нее величины Rf. Такая замена отразится только на значениях
коэффициентов А и В. Нет смысла определять эти коэффициенты
в каждом опыте. Одновременно с фракционированием исследуе-
мой смеси можно провести электрофорез набора белков-«марке-
ров», молекулярные массы которых точно известны. Разумеется,
вся предварительная обработка ДДС-Na и меркаптоэтанолом
должна быть строго одинаковой для исследуемого препарата и
маркеров. При электрофорезе в пластине для смеси маркеров
можно отвести отдельный трек. При использовании трубок мар-
керы лучше добавить прямо в препарат, так как нельзя гаран-
тировать строгой идентичности условий электрофореза в двух
разных трубках.
По окончании электрофореза, измерив пути миграции бром-
фенолового синего и каждого из маркеров, можно рассчитать
значения Rf и, зная молекулярные массы маркеров, построить
экспериментальную зависимость lg M от Rf для данного опыта.
Если пористость геля выбрана удачно (см. ниже), такая зави-
симость получается линейной (рис. 18). Определив теперь rf
для интересующего нас белка, из графика можно найти для него
величину lg M и подсчитать M. Положение и наклон прямой
на графике изменяются при вариации концентрации ПААГ и
других условий эксперимента, поэтому нельзя пользоваться ка-
кой-либо стандартной калибровкой. График зависимости Ig M
от Rf надо строить для каждого опыта. Отметим также, что при
определении Rf надо вводить поправки на набухание или съежи-
вание геля при фиксации, окраске белков и удалении красителя,
приводя все к исходному линейному размеру.
Метод определения молекулярной массы белков электрофоре-
зом в ПААГ с ДДС-Na завоевал себе прочную репутацию и ис-
пользуется очень широко. Тем не менее следует проявлять из-
вестную осторожность. Исследуемый белок может оказаться
принадлежащим к той, по-видимому, сравнительно немногочис-
ленной, категории белков, для которой количественное соотно-
шение в комплексе с ДДС-Na существенно отличается от 1: 1,4.
Есть данные о том, что на полноту комплексообразования с
ДДС-Na может влиять распределение зарядов по полипептид-
ной цепочке. Показано, например, что обработка рибонуклеазы
малеиновой кислотой снижает количество связывающегося с ней
ДДС-Na с 1,9 до 0,3 г на 1 г белка. Такая обработка не изме-
няет заметным образом молекулярной массы рибонуклеазы, но
вносит отрицательный заряд карбоксила на место положитель-
ного заряда аминогруппы. С другой стороны, на связывании
ДДС-Na с лизоцимом обработка малеиновой кислотой никак не
сказывается [Tung, Knight, 1972]. Ненормальное связывание
ДДС-Na может быть также обусловлено необычной обогащен-
ностью белка какой-либо гидрофильной аминокислотой. Глико-
протеиды хуже связываются с ДДС-Na, чем чистые белки.
Разной степенью связывания ДДС-Na, по-видимому, следует
объяснить и успешное разделение a - и b-цепей глобина кролика
электрофорезом в 12,5%-ном ПААГ с ДДС-Na. Различие моле-
кулярных масс этих цепей (15 419 и 16 000) вряд ли само по
себе могло бы обеспечить это разделение (Wood, Shaeffer, 1975].
Недавно было показано, что единственная мутационная замена
аминокислоты (Арг®Цис) в белке с молекулярной массой 26 000
приводит к кажущемуся изменению этой величины на 1000. Су-
щественно отметить, что такое изменение связано с заменой
только одного из нескольких остатков аргинина, входящих в со-
став белка. Следовательно, в этом случае играет роль еще и
окружение аргинина [Noel et al., 1979].
Рассмотренные примеры не могут дискредитировать плодо-
творный метод определения молекулярной массы белков элект-
рофорезом с участием ДДС-Na. Они лишь указывают на необхо-
димость некоторой осторожности и критичности в оценке ре-
зультатов эксперимента, особенно с малоизученными белками.
Выбор пористости геля
При данной пористости (концентрации) геля описаннаявыше
линейная зависимость имеет место только для белков, молеку-
лярные массы которых лежат в определенном интервале. Слиш-
ком крупные для данного геля белки, очевидно, вовсе не смогут
мигрировать в нем. Подвижности слишком малых белков, для
которых поры геля практически не создают препятствий, будут
зависеть не от их молекулярной массы, а только от отношения
заряда к массе. Как указывалось, в присутствии ДДС-Na это
отношение одинаково для большинства белков. Для ориентиров-
ки можно назвать некоторые цифры. Так, для одинаково сши-
тых гелей (С = 3,3) были рекомендованы следующие значения Т
в зависимости от молекулярной массы белков (M) [Dunker,
Rueckert, 1969]:
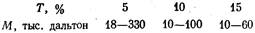
Фирма BDH для своего стандартного набора белков-марке-
ров в интервале М 56 — 280 тыс. дальтон предлагает использо-
вать гели с T = 3,3, а в интервале 14 — 72 тыс. — с T = 10; в обоих
случаях С = 2,6. Отметим попутно, что эффект торможения миг-
рации биополимеров в слабосшитых гелях с С < 2,6 быстро ос-
лабляется с уменьшением С при неизменном значении Т. По-
видимому, в этом случае ярко проявляется способность жестко-
го комплекса белок — ДДС-Na раздвигать гибкие, слабосшитые
нити акриламида.
Для определения молекулярных масс пептидов та же фирма
выпускает набор стандартных фрагментов миоглобина с диапа-
зоном М 2,5 — 17 тыс. Для него и соответствующих пептидов ре-
комендуется использовать сильно сшитый гель (Т = 12,5; С =
= 9), содержащий 8 М мочевину, которая усиливает торможение
малых пептидов в геле.
О важности правильного выбора пористости геля можно су-
дить из сопоставления двух картин разделения набора из семи
маркерных белков (рис. 19) [Fehrnström, Moberg, 1977]:

Разделение вели в приборе «Мультифор», использовав 5%- и
10%-ный ПААГ. Легко видеть, что в 5%-ном геле миоглобин
движется почти с такой же скоростью, как и цитохром с. При
перенесении результатов этих опытов на графики (рис. 20) по-
лучается, как и следовало ожидать, что точка, отвечающая по-

ложению цитохрома с в 5%-ном геле, выпадает из прямой ли-
нии, проходящей через все остальные точки, тогда как для 10%-
ного геля она оказывается на такой прямой.