
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторный практикум по биологической химииСтр 1 из 13Следующая ⇒
ФЕДЕРАЛЬНОЕ АГЕНСТВО по ОБРАЗОВАНИю Белгородский государственный университет Медицинский факультет
Лабораторный практикум по биологической химии
учебные указания к проведению лабораторных работ по биологической химии для студентов второго курса медицинского факультета по специальностям: 060101 - Лечебное дело и 060103 - Педиатрия
БЕЛГОРОД 2006г
«___»___________20 г.
Напечатаны по решению редакционно-издательского совета университета
Составители: Е.А.Шенцева, кандидат биологических наук, Л.Р.Закирова, кандидат биологических наук. Предисловие
Настоящие методические указания к проведению лабораторных работ по биологической химии написано сотрудниками кафедры биохимии и фармакологии Белгородского государственного университета доцентом Е.А.Шенцевой и старшим преподавателем Л.Р.Закировой. Методические указания составлены в полном соответствии с программой курса биологической химии, рекомендованной для студентов медицинских ВУЗов (Москва, 2000г.) Методические указания содержат описание лабораторных работ по курсу биологической химии, выполняемых студентами II курса медицинского факультета на лабораторно-практических занятиях. В каждой лабораторной работе излагается краткая информация по изучаемой теме, принцип метода, ход эксперимента, советы по оформлению результатов и контрольные вопросы для закрепления изученного материала. Методические указания призваны помочь студенту овладеть на лабораторно-практических занятиях современными методами экспериментальных исследований, закрепить теоретические знания, приобретенные на лекциях, анализировать полученные результаты. В основу методических указаний положен многолетний опыт проведения курса биологической химии на лабораторно-практических занятиях на кафедре биохимии и фармакологии Белгородского государственного университета. Сотрудники кафедры будут признательны всем, кто пожелает высказать свои замечания, полезные советы и пожелания относительно содержания методических указаний. ОГЛАВЛЕНИЕ биохимия простых белков_ 8 Лабораторная работа №1_ 8 Качественные цветные реакции на функциональные группы белков и аминокислот 8
Лабораторная работа №2_ 12 Реакции осаждения белков_ 12 биохимия Сложных белков (протеинов) 17 Лабораторная работа №3_ 17 Геминовая проба Тейхмана_ 17 Лабораторная работа №4_ 18 Выделение казеиногена из молока и открытие в нем фосфата_ 18 Лабораторная работа №5_ 20 Выделение муцина из слюны и открытие в нем углеводного компонента_ 20 биохимия ФЕРМЕНТов_ 21 Лабораторная работа №6_ 21 Количественное определение активности амилазы (по Вольгемуту) 21 Лабораторная работа №7_ 22 Специфичность действия амилазы слюны_ 22 Лабораторная работа №8_ 23 Влияние температуры на активность α-амилазы слюны_ 23 Лабораторная работа №9_ 24 Определение оптимума рН для действия α-амилазы слюны_ 24 Лабораторная работа №10_ 25 Влияние активаторов и ингибиторов на активность α-амилазы слюны_ 25 биохимия нуклеиновых кислот_ 26 Лабораторная работа №11_ 26 Кислотный гидролиз нуклеопротеинов дрожжей и определение состава нуклеиновых кислот 26 Изучение реакций окисления_ 28 Лабораторная работа №12_ 28 Открытие альдегиддегидрогеназы в молоке 28 Лабораторная работа №13_ 29 Обнаружение каталазы крови_ 29 Лабораторная работа №14_ 30 Открытие пероксидазы_ 30 Лабораторная работа №15_ 30 Получение тирозиназы и окисление тирозина в присутствии кислорода_ 30 Обмен углеводов_ 31 Лабораторная работа №16_ 32 Определение глюкозы в крови (набором реактивов «Глюкоза-ФКД») 32 Биохимия липидов_ 33 Лабораторная работа №17_ 34 Эмульгирование триацилглицеридов желчными кислотами_ 34 Лабораторная работа №18_ 34 Качественная реакция Петтенкоффера на желчные кислоты_ 34 Лабораторная работа №19_ 35 Определение содержания β-липопротеинов (липопротеинов низкой плотности) в плазме крови 35 Лабораторная работа №20_ 36 Качественные реакции на холестерол_ 36 биохимия белков_ 37 Лабораторная работа №21_ 37 Качественный анализ желудочного сока_ 37 Лабораторная работа №22_ 39 Определение активности аспартатаминотрансферазы(аланинаминотрансферазы) по методу Райтмана-Френкеля(набором реагентов) 39 Лабораторная работа №23_ 40 Определение мочевины в крови по реакции с диацетилмонооксимом (набором реагентов) 40
биохимия гормонов_ 42 Лабораторная работа №24_ 43 Качественная реакция на адреналин_ 43 Лабораторная работа №25_ 44 Обнаружение йодтиронинов_ 44 Витамины__ 44 Лабораторная работа №27_ 45 Качественные реакции на витамины_ 45 Биохимия печени_ 50 Лабораторная работа №27_ 51 Качественное определение «прямого» и «непрямого» билирубина в сыворотке крови 51 Лабораторная работа №28_ 52 Количественное определение содержания билирубина и его фракций в сыворотке крови 52 Лабораторная работа №29_ 53 Тимоловая проба (проба коллоидоустойчивости) 53 Биохимия крови_ 55 Лабораторная работа №30_ 55 Определение общего белка в сыворотке крови биуретовым методом (набором реагентов) 55 БИОХИМИЯ мочи_ 57 Лабораторная работа №31_ 57 Качественные реакции на белок в моче 57 Определение глюкозы в моче 59 Качественные реакции на кровяные пигменты в моче 59 Качественная реакция на желчные пигменты в моче 60 Качественные реакции на ацетон и ацетоуксусную кислоту в моче 60 Качественная реакция на индикан в моче 62 Приложение_ 64 Техника безопасности при работе в биохимических лабораториях_ 64 Способы взятия крови_ 64 Множители и приставки, применяемые для обозначений кратных и дольных единиц 65 Фотоколориметрия_ 65 Разделение белков сыворотки методом электрофореза на бумаге 66 Метод сахарной нагрузки_ 67 Количественное определение кислотности желудочного сока_ 69 Экспресс-методы обнаружения патологических компонентов мочи с помощью комбинированных тест-полосок_ 70 Биохимия простых белков Основную роль в структуре и процессах жизнедеятельности живых организмов играют белки, представляющие собой высокомолекулярные азотсодержащие биополимеры со специфическими структурами, состоящие из 20 природных аминокислот, соединенных между собой пептидными связями. Простые белки (протеины) состоят только из аминокислот и являются высокомолекулярными полимерными органическими соединениями – полипептидами.
Лабораторная работа №1 Ход работы К 5 каплям раствора белка прибавляют 3 капли 10% раствора едкого натра и 1 каплю 1% раствора сернокислой меди и перемешивают. Содержимое пробирки приобретает сине-фиолетовый цвет. Нельзя добавлять избыток сернокислой меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка. v Нингидриновая реакция. Нингидриновая реакция характерна для аминогрупп, находящихся в альфа-положении. Растворы белка, альфа-аминокислот и пептидов при нагревании с нингидрином дают синее или фиолетовое окрашивание. Принцип метода. В этой реакции альфа-аминокислоты и пептиды окисляются нингидрином и подвергаются окислительному дезаминированию и декарбоксилированию с образованием аммиака, альдегида и СО2. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет. Нингидриновая реакция используется для количественного определения альфа-аминокислот в аминокислотных анализаторах, а также широко используется в хроматографическом анализе и для колориметрического количественного определения аминокислот.
1.
окисленный восстановленный (гидриндантин (бесцветный))
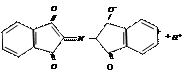
2. нингидрин нингидрин продукт конденсации окисленный восстановленный пурпур Роумэна (сине-фиолетовый)
Ход работы В пробирку наливают 0,5 мл раствора яичного белка и прибавляют 5 капель 0,5% водного раствора нингидрина и нагревают на водяной бане до кипения. Появляется розово-фиолетовое или сине-фиолетовое окрашивание. С течением времени раствор синеет. Данная реакция не является специфичной, поскольку её дают некоторые амины и амиды кислот. v Ксантопротеиновая реакция. Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот – фенилаланина (Phe), тирозина (Tyr), триптофана (Trp), а также свободные перечисленные кислоты. Белки, в которых циклические аминокислоты отсутствуют, не дают ксантопротенновой реакции. Принцип метода. Реакция обусловлена нитрованием бензольного кольца циклических аминокислот с образованием нитросоединений желтого цвета. При взаимодействии азотной кислоты с тирозином реакция нитрования протекает по следующему уравнению:
1. тирозин (Tyr) динитротирозин
при подщелачивании возникает хиноидная структура, окрашенная в оранжевый цвет: 2. динитротирозин натриевая соль динитротирозина хиноидная форма хиноидной структуры (насыщенный желтый) (оранжевый)
Ход работы В пробирку вносят 0,5 мл раствора яичного белка. Добавляют 0,5 мл концентрированной азотной кислоты и осторожно нагревают. Вначале появляется осадок свернувшегося белка (под влиянием кислоты), который при нагревании окрашивается в желтый цвет. После охлаждения в пробирку наливают по каплям 10% раствор едкого натра до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина. v Реакция Фоля. Реакция Фоля указывает на присутствие в белке аминокислот цистеина (Cys) и цистина, содержащих слабосвязанную серу. Метионин (Met), хотя и является содержащей серу аминокислотой, этой реакции не дает, поскольку сера в нем связана прочно. Принцип метода. Реакция состоит в том, что при кипячении белка с реактивом Фоля (плюмбит натрия в избытке NаОН) под действием щелочи цистеин или цистин легко отщепляет серу в виде сернистого натрия, который с плюмбитом дает черный или бурый осадок сернистого свинца. Интенсивность окраски зависит от количества в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу и от количества белка в растворе. Реакция протекает по следующим уровням:
1. цистеин серин осадок черного цвета
Ход работы В пробирку вносят 0,5 мл яичного белка и прибавляют 5 капель реактива Фоля. Кипятят и дают постоять 1-2 минуты. При стоянии появляется бурый или черный осадок черного цвета сернистого свинца.
v Реакция Адамкевича. Реакция Адамкевича открывает в белках аминокислоту триптофан (Trp). Принцип метода. При добавлении к раствору белка незначительных количеств глиоксиловой кислоты и при подслаивании концентрированной серной кислоты получаем красно-фиолетовое кольцо на границе раздела жидкостей, обусловленное способностью триптофана в кислой среде взаимодействовать с альдегидной группой глиоксиловой кислоты, давая окрашенные продукты конденсации. В качестве источника глиоксиловой кислоты можно использовать ледяную уксусную, в которой глиоксиловая всегда присутствует в небольшом, но вполне достаточном для этих целей количестве.
триптофан глиоксиловая кислота триптофан продукт конденсации (красно-фиолетовое кольцо)
Ход работы В пробирку наливают 1 мл раствора белка и 1 мл уксусной кислоты. Осторожно (!) по стенке подслаивают 1 мл концентрированной серной кислоты, Наблюдают появление красно-фиолетового кольца. Записывают химизм реакции.
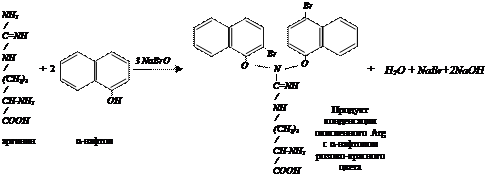
v Реакция Сакагучи. Реакция Сакагучи открывает в белках аминокислоту аргинин (Arg). Принцип метода. Аминокислота аргинин и полипептиды, содержащие ее в присутствии щелочи окисляются гипобромитом или гипохлоридом натрия и в присутствии α-нафтола образуют продукт конденсации красного цвета (гуанидиновая группировка). Реакция не является строго специфичной для аргинина. Ее дают и другие монозамещенные гуанидина (метилгуанидин, гликоциамин, агматин и др.), но они отсутствуют в молекуле белка и не мешают определению в белке аргинина.
Ход работы Вносят в пробирку 0,5 мл раствора яичного белка, добавляют 0,5 мл 10% раствора едкого натра, 5 капель 0,1% раствора α-нафтола в спирте и 1-5 капель раствора гипобромита. Появляется розово-красное окрашивание, обусловленное образованием продукта конденсации окисленного аргинина с α-нафтолом.
Указания к оформлению лабораторной работы В тетради для лабораторных работ отметьте цель занятия. Полученные результаты всех цветных реакций необходимо записать в виде таблицы. Химизм каждой цветной реакции записать отдельно.
Сделайте выводы о специфичности цветных реакций на белки и аминокислоты.
Контрольные вопросы 1. Назовите и напишите аминокислоты, содержащие серу. С помощью какой реакции можно их открыть? 2. Что открывает нингидриновая реакция? 3. Каково значение цветных реакций на белки и аминокислоты?
4. Какие сокращения для аминокислот приняты в биологической химии? Лабораторная работа №2 Реакции осаждения белков Изучение физико-химических свойств белков необходимо для понимания механизмов развития многих патологических состояний (например, отеков), механизмов транспорта веществ (в том числе лекарственных препаратов). На знании физико-химических свойств белков основано их получение и использование в качестве лекарственных препаратов. Реакции осаждения используются в медицине для качественного и количественного определения белка в биологических жидкостях, для удаления белков из растворов. Пробы коллоидоустойчивости используются для функциональной диагностики болезней внутренних органов. Реакции осаждения белков в зависимости от применяемого осадителя могут быть обратимыми и необратимыми. В случае необратимых реакций белки не подвергаются глубоким изменениям, и получаемые осадки могут быть вновь растворены в первоначальном растворителе, обычно в воде. Белки при этом сохраняют свои первоначальные нативные свойства. При необратимых реакциях, осажденные белки подвергаются глубоким изменениям, получаемые осадки не могут быть вновь растворены в первоначальном растворителе, обычно в воде, т.е. наступает денатурация белков. Обратимые реакции осаждения можно получить путем так называемого высаливания при помощи нейтральных солей: NaCl, (NH4)2SO4, MgSO4, спиртом (в случае непродолжительного действия его га белок при низкой температуре) и др. Значение реакций осаждения белков в том, что они дают возможность: 1) изучить свойства белков; 2) освободить жидкость от присутствия белка, что бывает необходимо при некоторых исследованиях; 3) установить наличие белка, например, в моче, при различных патологических состояниях (заболеваниях почек – нефрите, сердечная декомпенсация и др.); 4) высаливанием с помощью различных концентраций нейтральных солей (или спиртом) можно выделить отдельные белковые фракции. Почти все белки свертываются при нагревании в нейтральной или слабокислой среде. Более полное и быстрое осаждение белков происходит в изоэлектрической точке. Для большинства белков ИЭТ соответствует слабокислой среде (рН около 5,0). Протамины и гистоны имеют ИЭТ в щелочной среде (рН около 8,0). Кроме рН среды важную роль в свертывании белков при нагревании играет концентрация солей.
v Осаждение белков нагреванием. Устойчивость белка в растворе к нагреванию зависит от наличия заряда (положительного в сильнокислой среде и отрицательного - в щелочной среде). Полное и быстрое осаждение белков происходит в изоэлектрической точке, которая для большинства белков соответствует слабокислой среде (рН около 5,5). Принцип метода. При нагревании растворов белка вначале отмечается увеличение опалесценции и появление мути (коагуляции). При дальнейшем повышении температуры - появление хлопьевидного осадка белка (седиментация). При кипячении происходит необратимое изменение природных свойств белка (денатурация).
Ход работы В 5 пробирок наливают по 0,5 мл раствора яичного белка. В первой пробирке нейтральный раствор белка нагревают до кипения. Отмечают появление мути, связанное с разрушением водной оболочки вокруг молекул белка и укрупнению его частиц; мицеллы белка несут заряд и удерживаются во взвешенном состоянии. Во вторую пробирку прибавляют 3 капли 1% раствора уксусной кислоты, создавая слабокислую среду. Раствор белка нагревают до кипения и частицы белка при этом теряют заряд и приближаются к изоэлектрическому состоянию. В третью пробирку добавляют 15 капель 1% раствора уксусной кислоты и нагревают раствор до кипения. В четвертую пробирку наливают 15 капель 1% раствора уксусной кислоты для получения сильнокислой реакции, 2 капли насыщенного раствора хлористого натрия и нагревают. Выпадает хлопьевидный осадок белка, так как частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлористого натрия. В пятую пробирку добавляют 6 капель 10% раствора едкого натра, создавая щелочную среду, и нагревают. В каждой пробирке определяют рН среды с помощью индикатора. При кипячении жидкости осадок не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается. Отмечают, в какой пробирке произошло осаждение белка, а в какой - нет. Делают выводы о влиянии рН среды на белковые макромолекулы и выпадение белка в осадок. Результаты оформляют в виде таблицы (1).
v Осаждение белков солями щелочных и щелочно-земельных металлов (высаливание). Осаждение белков из растворов при действии высоких концентраций нейтральных солей щелочных и щелочноземельных металлов называют высаливанием. Метод высаливания позволяет получить белки в кристаллическом виде и применяется для разделения и очистки. Принцип метода. Реакция высаливания (осаждение белков с помощью больших концентраций нейтральных солей) обусловлена дегидротацией макромолекул белка с одновременной нейтрализацией электрического заряда. Для высаливания различных белков требуется неодинаковая концентрация одних и тех же солей. Глобулины, имеющие большую молекулярную массу, легче высаливаются, чем альбумины. Глобулины осаждаются в полунасыщенном, а альбумины – в насыщенном растворе сернокислого аммония.
Ход работы В 3 пробирки вносят по 1 мл раствора белка и добавляют по 1 мл насыщенных растворов: Na2S04, Mg2SO4, (NH4)2SO4 . После добавления осадителей к растворам белка, смеси необходимо перемешать встряхиванием. Определяют, в какой пробирке объем осадка больше. Затем проверяют растворимость осажденного белка добавлением 2 мл воды. Выясняют, в какой пробирке происходит растворение осадка. Делают вывод о необратимом или обратимом растворении белков. Результаты оформляют с помощью таблицы (2).
v Осаждение белка солями тяжелых металлов. Осаждение белков солями тяжелых металлов, в отличие от высаливания, происходит при небольших концентрациях солей. Принцип метода. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя с ними солеобразные и комплексные соединения (на этом основано применение белков в качестве противоядия при отравлении солями тяжелых металлов), растворимые в избытке этих солей (за исключением солей AgNO3 , HgCl2), но нерастворимые в воде. Соли тяжелых металлов вызывают необратимое осаждение белков, т.е. денатурацию.
Ход работы В 2 пробирки вносят по 0,5 мл раствора белка и добавляют по 1-2 капли растворов CuS04,(CH3COO)2Pb. Отмечают выпадение осадка в пробирках. Затем добавляют в каждую пробирку по 1-2 мл воды и определяют растворимость осадка белка. Далее в эти пробирки добавляют по каплям соответствующие растворы осадителей и перемешивают содержимое. Делают вывод о причинах обратимости осаждения белка в растворах солей тяжелых металлов. Результаты опыта оформляют в виде таблицы (2).
v Осаждение белков органическими кислотами. В реакциях осаждения белков большое практическое значение получили трихлоруксусная и сульфосалициловая кислоты. Сульфосалициловой кислотой широко пользуются в клинике при обнаружении малых количеств белка в моче и других биологических жидкостях (чувствительность реакции 1:50000). Сульфосалициловая кислота, помимо белков, осаждает продукты их распада – высокомолекулярные пептоны и полипептиды. ТХУ осаждает только белки и не осаждает продуктов их распада. В связи с этим ТХУ осаждают, например, белки крови, когда хотят отделить их от высокомолекулярных пептидов. Принцип метода. При действии на раствор белка органические кислоты способны нейтрализовать заряд белка и разрушить его пространственную структуру, что приводит к необратимой денатурации и осаждению белка.
Ход работы В 3 пробирки вносят по 0,5 мл раствора белка и добавляют по 1-2 капли растворов сульфосалициловой кислоты. Определяют растворимость выпавшего осадка в воде. Во 2 пробирку наливают 2 мл раствора белка и 2 мл 10% раствора трихлоруксусной кислоты; взбалтывают содержимое и фильтруют через складчатый фильтр, в другую пробирку. Полноту осаждения белков определяют при добавлении к фильтрату сульфосалициловой кислоты. Результаты опытов оформляют в виде таблицы (2). v Осаждение белков алкалоидными реактивами. Алкалоидные реактивы – танин, пикриновая кислота, фосфорно-вольфрамовая, фосфорно-молибденовая кислота раствор йодной ртути в йодистом калии и др. – вызывают необратимое осаждение белка в кислой среде. Принцип метода. Реакция обусловлена наличием в белке азотистых гетероциклических группировок, аналогично тем, которые встречаются в молекулах алкалоидов (индольные, имидазольныее, пиррольные и др.). При этом алкалоидные реактивы являются анионами, а белки – катионами. Слабое подкисление белкового раствора уксусной кислотой ведет к появлению положительного заряда на поверхности белка и облегчает взаимодействие белка с отрицательно заряженными ионами осадителя. Белки, обладающие основным свойствами (гистоны, протамины), хорошо растворяются в нейтральной среде без подкисления.
Ход работы В 2 пробирки вносят по 0,5 мл раствора белка и добавляют по 5 капель 1% раствора уксусной кислоты. Затем добавляют в одну 5 капель пикриновой кислоты, в другую 5 капель танина. Определяют растворимость выпавшего осадка добавлением 1 мл воды. Результаты оформляют в виде таблицы (2).
v Осаждение белка минеральными кислотами. Концентрированные минеральные кислоты вызывают денатурацию белка и выпадение его в осадок (образуются комплексные соли белка с минеральными кислотами). Ортофосфорная кислота осадка не дает. В избытке всех минеральных солей, за исключением азотной, выпавший в осадок белок растворяется. В связи с этим реакция осаждения белков азотной кислотой особенно распространена при клинических исследованиях мочи (проба Геллера). Эта качественная реакция с концентрированной азотной кислотой лежит в основе количественного определения белка в моче по методу Робертса-Стольникова-Брандберга. Принцип метода. Выпадение белка в осадок связано с дегидратацией белковых частиц и их нейтрализацией, что приводит к разрушению пространственной структуры белка и выпадению его в осадок.
Ход работы В 3 пробирки вносят по 1 мл раствора белка и добавляют по 2-3 капли следующих концентрированных растворов кислот НNО3, НС1, Н2SO4. Содержимое пробирок осторожно перемешивают и добавляют еще несколько капель соответствующих кислот. Определяют растворимость выпавшего осадка добавлением 1 мл воды. Результаты опыта оформляют в виде таблицы (2).
v Осаждение белка органическими растворителями. В органических растворителях, таких как спирт, ацетон и др., белки не растворяются и выпадают в осадок. Однако, кратковременное воздействии органических растворителей при низкой температуре от 0 до 100С сохраняет белок в нативном состоянии, что используется в фармацевтической практике для получения отдельных белковых препаратов, например гормона инсулина. При длительном воздействии органических растворителей наступает необратимая денатурация белка. Принцип метода. Спирт, связывает воду, т.е. обезвоживает коллоидные частицы белка, вызывая дегидратацию мицелл белка, нарушение гидрофобных взаимодействий внутри белковой молекулы и вызывают ее денатурацию, что приводит к снижению растворимости и выпадению денатурированного белка в осадок.
Ход работы К 5 каплям раствора белка прибавить 15-20 капель этилового спирта. Раствор мутнеет. Добавить 1 каплю насыщенного раствора хлористого натрия. При стоянии выпадает осадок белка. Результаты опыта оформляют в виде таблицы (2).
Указания к оформлению лабораторной работы В тетради для лабораторных работ отметьте цель занятия, принцип метода, порядок работы (кратко, в виде таблицы). Результаты работ по осаждению белков представьте в виде двух таблиц: 1) Осаждение белка при кипячении при различных реакциях среды.
2) Реакции осаждения белков различными веществами.
Сделайте выводы: 1) о механизме осаждения белков при кипячении; 2) о влиянии концентрации водородных ионов и ионов солей на устойчивость в растворе молекул денатурированного при кипячении белка; 3) о возможности применения реакций осаждения в лабораторной практике.
Контрольные вопросы 1. Чем обусловлены реакции осаждения белков? 2. При каких температурных условиях возможно осаждение белков? 3. Что такое денатурация белков? Чем она может быть вызвана? 4. Каковы должны быть Ваши действия при отравлении человека солями тяжелых металлов, основанные на необратимых реакциях осаждения белков? биохимия Сложных белков (протеинов) Сложные белки относятся к смешанным макромолекулам – белок-небелковым комплексам, которые содержат два компонента – простой беок и небелковый компонент, соединенные между собой ковалентными или слабыми (ионными, водородными, вандервальсовыми, фосфоэфирными и др.) связями. Небелковый компонент называется – простетическая группа. К сложным белкам относятся: нуклеопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины, сложные белки-ферменты, металлопротеины.
Лабораторная работа №3 Геминовая проба Тейхмана Качественные реакции на небелковую часть гемопротеинов позволяют выявить структурные компоненты (геминовую группировку и входящее в ее состав железо) в биологическом материале. Пробой Тейхмана пользуются в судебно-медицинской экспертизе для доказательства наличия кровяных пятен. Эта проба заключается в образовании кристаллического солянокислого гемина при действии на кровь уксусной кислоты и хлорида натрия. Гемин отличается от гема наличием трехвалентного железа, соединенного с атомом хлора. Принцип метода. При нагревании крови с ледяной уксусной кислотой гемоглобин распадается на гем и глобин. Если гидролиз крови проводить в присутствии уксусной кислоты и хлорида натрия, гемм превращается в солянокислую соль – гемин. Образуются характерные кристаллы солянокислого гемина. Ход работы
Если обнаружить кристаллы не удается, то приподнимают покровное стекло, добавляют 2-3 капли концентрированной уксусной кислоты, нагревают и после охлаждения вновь исследуют под микроскопом.
Указания к оформлению лабораторной работы В тетради для лабораторных работ запишите ход работы, зарисуйте наблюдаемую картину в поле зрения и сделайте выводы об исследуемом веществе.
Контрольные вопросы 1. Что является простетической группой молекулы гемоглобина? 2. Какова степень окисления железа в геме и гемине? 3. Может ли геминовое железо присоединять кислород?
Лабораторная работа №4 Выделение казеиногена из молока и открытие в нем фосфата Казеиноген белок молока относятся к сложным белкам – фосфопротеинам – содержит в качестве небелковой группы остатки фосфорной кислоты (0,5-0,9%). К фосфопротеинам относятся также вителлин, вителлинин и витин яичного желтка, ихтулин рыбьей икры, а также ферменты – фосфорилаза, фосфоглюкомутаза, пепсин и др. Все фосфопротеины с химической точки зрения характеризуются эфирной связью фосфорной кислоты в белковых молекулах. Эфирная связь в молекулах фосфопротеинов осуществляется благодаря присоединению остатков фосфорной кислоты к оксигруппе остатков серина и треонина (оксиаминокислот). Биологическая роль фосфопротеинов заключается в том, что они служат типичным материалом для растущих организмов. Присутствие фосфопротеинов в материале можно открыть реакциями на фосфаты, на белки и продукты их постепенного гидролиза. Казеиноген – фосфопротеин молока – под действием пищеварительных ферментов (пепсин) превращается в казеин, который с солями кальция образует казеинат кальция, что сопровождается свертыванием молока. Кальциевая соль казеина в противоположность кальциевой соли казеиногена нерастворима в воде. Превращением казеиногена в казеин объясняется ферментативное свертывание молока. В простокваше и других кисло-молочных продуктах в свернутом состоянии находится казеиноген. Качественные реакции на фосфатную группу используются для открытия фосфопротеинов в исследуемых образцах. Принцип метода. Казеиноген обладает свойствами кислоты и в молоке находится в виде анионов, растворимых в воде. Недиссоциированные молекулы казеиногена малорастворимы в воде. Изоэлектическая точка казеиногена находиться при рН=4,7. Этим объясняется, что при подкислении при рН=4,7 молоко свертывается благодаря выпадению в осадок казеиногена. Свертывание молока возможно также и в присутствии молочной кислоты, образовавшейся из лактозы под влиянием молочнокислых бактерий. При щелочном гидролизе казеиноген (казеин) распадается на фосфат и белок. Фосфат может быть обнаружен специфической реакцией с молибденовым реактивом.
Ход работы v Выделение казеиногена из молока. К 2 мл молока приливают равный объем дистиллированной воды. Осаждают казеиноген добавлением 1 капли концентрированной уксусной кислоты. Не следует добавлять избыток кислоты, поскольку молекулы белка казеиногена перезаряжаются и вновь переходят в раствор, что мешает осаждению. Выпавший осадок казеиногена отфильтровывают и промывают на фильтре дистиллированной водой 2 раза. Часть осадка снимают с фильтра стеклянной палочкой и проводят с ним цветные реакции на белки (биуретовую, Фоля, Милона). v Обнаружение фосфата в казеиногене. В пробирку вносят 0,1г сухого порошка казеина, прибавляют 5 мл 10% раствора гидроксида натрия и ставят в кипящую водяную баню на 30 мин. Охлаждают пробирку и проводят реакцию на продукты гидролиза. А. Обнаружение белка. Проводят реакцию 10 капель гидролизата и проводят реакцию с биуретовым реактивом, добавляя 3-5 капель его к 10 каплям гидролизата (см. лаб. № 2). Отмечают появление характерного окрашивания. Б. Обнаружение фосфата. В другую пробирку вносят 20 капель гидролизата и нейтрализуют его, прибавляя по каплям концентрированную азотную кислоту до слабокислой реакции по лакмусовой бумаге. Затем прибавляют 10 капель раствора молибдата аммония, перемешивают содержимое и приливают 10 капель 1% раствора аскорбиновой кислоты, приготовленной на 1М растворе соляной кислоты. Вновь перемешивают, оставляют стоять пробы до развития синего окрашивания и записывают химизм реакции. Н3РО4+12(NH4)2МоО4+21НNО3→(NН3)3(РО4•12МоО3)+21N4NО3+12Н2О Указания к оформлению лабораторной работы В тетради для лабораторных работ запишите ход работы, принцип метода, химизм реакций и сделайте выводы о составе и растворимости сложного белка молока – казеиногена.
Контрольные вопросы 1. Назовите простетическую группу казеиногена молока. 2. Почему в кислом молоке казеиноген выпадает в осадок и молоко створаживается? 3. Охарактеризуйте биологическую роль фосфопротеинов.
Лабораторная работа №5 Выделение муцина из слюны и открытие в нем углеводного компонента Муцин – сложный белок – гликопрот
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1035; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.12.205 (0.17 с.) |

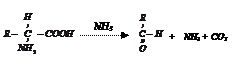
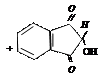
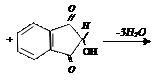
 нингидрин аминокислота альдегид нингидрин
нингидрин аминокислота альдегид нингидрин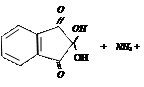


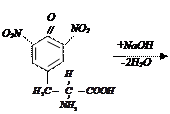


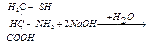
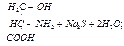 2.
2. 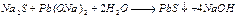 .
.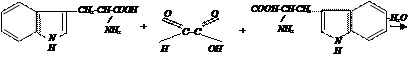

 Каплю свежей крови помещают на предметное стекло и дают ей высохнуть на воздухе. К подсушенной крови добавляют 1-2 капли 0,9% раствора хлорида натрия; тщательно перемешивают стеклянной палочкой, далее, туда добавляют 1-2 капли концентрированной уксусной кислоты и еще раз тщательно перемешивают стеклянной палочкой, покрывают покровным стеклом и осторожно нагревают до начала кипения (не кипятить!). При этом предметное стекло следует держать высоко над пламенем горелки, чтобы избежать выкипания жидкости. Затем препарат охлаждают и рассматривают под микроскопом образовавшиеся при разрушении гемоглобина кристаллы солянокислого гемина, имеющие форму ромбоидальных палочек (смотри рисунок).
Каплю свежей крови помещают на предметное стекло и дают ей высохнуть на воздухе. К подсушенной крови добавляют 1-2 капли 0,9% раствора хлорида натрия; тщательно перемешивают стеклянной палочкой, далее, туда добавляют 1-2 капли концентрированной уксусной кислоты и еще раз тщательно перемешивают стеклянной палочкой, покрывают покровным стеклом и осторожно нагревают до начала кипения (не кипятить!). При этом предметное стекло следует держать высоко над пламенем горелки, чтобы избежать выкипания жидкости. Затем препарат охлаждают и рассматривают под микроскопом образовавшиеся при разрушении гемоглобина кристаллы солянокислого гемина, имеющие форму ромбоидальных палочек (смотри рисунок).


