
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В этом процессе синтезируются различные пентозы, в том числе рибоза, необходимая для построения молекул нуклеотидов и нуклеиновых кислот.
В аэробных условиях, при переносе протонов и электронов с цитозольных 12 молекул НАДФН2 в митохондрии на ферменты дыхательной цепи, возможен синтез 36 молекул АТФ в реакциях окислительного фосфорилирования.
7. Установлено, что окисление жирных кислот протекает в печени (60%), почках, скелетных мышцах, жировой ткани. Около 70% О2, поглощаемого миокардом, используется для Окисления ЖК.
Биоэнергетика процесса бета-окисления жирных кислот складывается из произведения числа циклов бета-окисления на число молекул АТФ, синтезируемых в каждом цикле (5АТФ): (Сn/2 -1) 5 = Х (АТФ) Например, при бета-окислении стеариновой кислоты (Cn=18) выход АТФ равен: (18/2-1)5= 40 АТФ. Выход энергии при полном окислении жирных кислот до углекислого газа и воды складывается из суммы энергии, выделенной при бета-окислении (Cn/2-1)5, и энергии, высвобождаемой при окислении в цикле Кребса всех молекул ацетил-КоА, образовавшихся при бета-окислении данной жирной кислоты (Сn/2)12: (Сn/2-1)5 + (Cn/2)12 = Х АТФ Например, при полном окислении стеариновой кислоты (Cn=18) выход АТФ равен: (18/2-1) 5 + (18/2)12= 40+108 = 148 АТФ.
Билет №31 1. Динамическая биохимия изучает химические реакции, представляющие обмен веществ (метаболизм), а именно пути превращения молекул и механизмы происходящих между ними реакций. Простые молекулы и их производные (моносахариды, жирные кислоты, аминокислоты, нуклеотиды и др.), образующиеся в процессе метаболизма, называются метаболитами. В основе лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества. Методы преимущественно формировались в XX веке; наиболее распространенными являются хроматография, центрифугирование и электрофорез. 2. Транскрипция - первая стадия реализации генетической информации в клетке. ) Процесс транскрипции Для того чтобы хранящаяся в ДНК информация могла быть использована, ее необходимо переписать (транскрибировать) в последовательностьРНК. При этом ДНК служит только матрицей, т. е. она не меняется в процессе транскрипции. Транскрибируемые последовательности ДНК, т. е. участки ДНК, которые кодируют определенные белки, называются генами. Установлено, что геном млекопитающих содержит по крайней мере 50000 индивидуальных генов, которые вместе составляют менее 20% суммарной ДНК генома. Функция «избыточных» последовательностей ДНК до конца не установлена.
Как уже упоминалось, РНК-полимераза II связывается с 3'-концом промоторного участка. Последовательность, обеспечивающая это связывание, так называемый ТАТА-бокс, короткий А- и Т-обогащенный участок, последовательность которого слегка варьирует у разных генов. Типичная последовательность (каноническая) —...ТАТААА.... Для взаимодействия полимеразы с этим участком необходимы несколько белков, основныхфакторов транскрипции. Дополнительные факторы могут либо стимулировать, либо ингибировать этот процесс (контроль транскрипции) (см. с.242). После инициации синтеза (2), РНК-полимераза движется в направлении 3'→5' матричной цепи. В процессе инициации фермент разделяет короткий участок двойной спирали ДНК на две отдельные цепочки. Нуклеозидтрифосфаты связываются комплементарно на кодирующей цепочкеДНК водородными связями и шаг за шагом присоединяются к растущей молекуле РНК (3). Вскоре после начала элонгации 5'-конец транскрипта защищается «кэпом» (от англ. cap) (см. с. 242). Как только транскрипция доходит до сайта полиаденилирования (обычно это последовательность...ААТААА...), транскрипт отщепляется (4). После этого полимераза прекращает транскрипцию и диссоциирует от ДНК.
3. Витамин B2 интенсифицирует процессы обмена веществ в организме, участвуя в метаболизме белков, жиров и углеводов. Рибофлавин необходим для образования красных кровяных телец и антител, для дыхания клеток и роста. Он облегчает поглощение кислорода клетками кожи, ногтей и волос. Он улучшает состояние органа зрения, принимая, наряду с витамином A, участие в процессах темновой адаптации, снижает усталость глаз и играет большую роль в предотвращении катаракты. Витамин B2 оказывает положительное воздействие на слизистые оболочки пищеварительного тракта. Рибофлавин сводит к минимуму негативное воздействие различных токсинов на дыхательные пути. Рибофлавин необходим для метаболизма триптофана, который превращается в организме в ниацин. Одним из ценнейших качеств рибофлавина является его способность ускорять в организме превращение пиридоксина - витамина B6 - в его активную форму. Флавиновые дегидрогеназы. Это также большая группа ферментов, катализирующая отнятие 2Н от различных субстратов. Простетической группой этих ферментов служат производные витамины В2 (рибофлавина) — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит изоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н++2е) (рис.5). Простетическая группа у флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
4. Авитамино́з — заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины. Причины, вызывающие авитаминоз. Нарушение поступления витаминов с пищей при неправильном питании, недостаточном или некачественном питании.Нарушение процессов пищеварения или нарушение работы органов, связанных непосредственно с пищеварением.Поступление в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови.Особенности детского обмена веществ.Особенности обмена веществ у пожилых людей Впоследствии авитаминоз может привести к гораздо более плохим последствиям: проблемам с желудочно-кишечным трактом, ухудшению зрения. Гиповитаминоз – это состояние неполного витаминного дефицита, когда количества потребляемого витамина достаточно, чтобы не развилась тяжелая болезнь, но недостаточно для полного обеспечения всех выполняемых данных витамином функций. Причины любых гиповитаминозов можно подразделить на 2 группы – экзогенные и эндогенные. К первым относятся: скудное содержание в пищевом рационе продуктов, выступающих основными источниками того или иного витамина; разрушение витаминов вследствие длительного и неправильного хранения продуктов, нерациональной кулинарной обработки; действие антивитаминных факторов (ферментов аскорбаксилазы, тиаминазы и др.), содержащихся в продуктах; нарушение баланса химического состава рациона, неадекватное соотношение между витаминами и другими нутриентами; антагонизм с некоторыми ЛС. Среди эндогенных факторов развития гиповитаминозов, в свою очередь, можно выделить: заболевания органов ЖКТ, перенесенные операции (например, резекция желудка), приводящие к нарушению всасывания витаминов; нарушения всасывания витаминов вследствие их утилизации кишечными паразитами и патогенной кишечной микрофлорой; наследственные либо приобретенные нарушения метаболизма витаминов и образования их активных форм. Гиповитаминоз провоцирует головокружение, шум в голове, кровоточивость десен, ломкость ногтей и волос, бессонницу и многие другие недуги. Гѝпервитамино́з — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах). Основные причины возникновения гипервитаминоза - изыточное потребление продуктов, богатых соответствующим витамином (например, печени белого медведя, моржа или кита, содержащих витамин А в очень больших количествах) или передозировка витаминосодержащих препаратов. Последствия гипервитаминоза: тошнота, рвота, потеря массы тела, запоры, головная боль и боль в мышцах тела.
5. Окислительное фосфорилирование. При окислении одной молекулы субстрата на один атом поглощенного митохондриями кислорода может использоваться от одного до трех молекул фосфорной кислоты и синтезироваться при этом 1, 2 или 3 молекулы АТФ. Это процесс - процесс синтеза АТФ в реакциях биологического окисления субстратов получил название - окислительное фосфорилирование. Для его количественной оценки был введен показатель окислительного фосфорилирования - коэффициент Р/О. Коэффициент Р/О (АДФ/О) - это есть отношение количества молекул фосфорной кислоты (АДФ) к количеству атомов кислорода использованных митохондриями при окислении какого-либо субстрата. 1.Ферменты дых. Цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов. 2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2. 3.Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную цепь, по которой электроны движутся (50-200 шт/сек)к своему конечному акцептору- кислороду. В результате образуется вода. 4.Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию. Часть энергии электронов используется в 1,3,4 комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства: Изменение энергии электронов=совершение работы+ выделение тепла
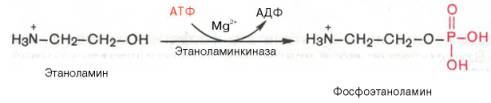
5. Перенос ионов водорода через мембрану (выкачивание) происходит неслучайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосорилирования). Они представлены 1,3,4 комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией. Мобилизация гликогена. Мобилизация гликогена начинается с возникновения готовности и необходимости организма выполнять мышечную работу, например, при любой стрессовой ситуации. При этом из мозгового вещества надпочечников в кровь секретируется гормон адреналин, который, взаимодействуя с рецепторами мембран миоцитов, активирует фермент аденилатциклазу. Аденилатциклаза используя АТФ, синтезирует множество молекул цАМФ, что является фактором усиления нейро-геморального сигнала на клетку и ткань в целом. Далее молекулы цАМФ активируют цАМФ-зависимые протеинкиназы, которые активируют фосфорилазкиназу. Фосфорилазкиназа активирует фосфорилазу "b", переводя ее в фосфорилазу "а". Далее идет фосфоролиз гликогена, т.е. его мобилизация. В целом мобилизация гликогена - это конечное звено каскада реакций запускаемые появлением в клетке 3`5`-АМФ (цАМФ). 7 Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазма-тической сети клетки. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатиднаякислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфин-гомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всехфосфолипидов. В качестве примера рассмотрим синтез отдельных представителей фосфолипидов.
Билет №32 1. Объектом изучения статистической биохимии является химический состав живой материи. Метод синтеза, радиоактивных изотопов и физические методы. 2. Хромосомы состоят из ДНК И Белка с небольшой примесью хромосомной РНК. В структурной организации хромосомы молекула наряду с типичной одной двойной спиралью, может содержать участки состоящих из нескольких двойных спиралей, дополнительно закрученных крупными витками. Молекула ДНК за счет остатков фосфорной кислоты заряжается отрицательно и присоединяет к своей поверхности по всей длине положительно заряженные белки- гистоны, образуя сложный белок дезоксирибонуклеопротеид называемый хроматином. Исследования структуры хромосом позволили предположить, что спираль ДНК соединяется с группами из восьми молекул гистона и образует нуклеосомы –частицы, имеющие вид нанизанных на нитку бусинок. Эти нуклеосомы и соединяющие их участки ДНК плотно упакованы в виде спирали. На каждый виток спирали приходится примерно 6 нуклеосом которые по своим размерам и другим признакам соответствуют хромомере хромосом. Все хромосомы состоят из двух хромомер и соединены друг с другом центральными двумя нитями ДНК. Хромосомы по своей химической природе можно отнести к нуклеопротеидам. Хромосомы – хранители генетической информации.
Регулируют процессы в клетке путем синтеза первичной структуры белка, иРНК, рРНК. Структурная организация рибосом всех названных групп принципиально одинакова. Рибосома состоит из двух субъединиц (субчастин): большой и малой. В рибосомах эукариот они имеют постоянную седиментации Сведберга 60s и 40s. В нативном виде не все субчастини соединяются в цели рибосомы, а находятся в динамическом равновесии: 80s " 60s +40s. Большая субъединица рибосомы имеет вид треугольника, трапеции или ковша с поперечником в 15-18 нм, меньшая - напоминает телефонную трубку с поперечником 14-16 нм. Присоединяются обе субъединицы поперечными сторонами с помощью ионов магния (Mg2+), а между ними остается узкая щель. В процессе функционирования (т. е. синтеза белка) Рибосомы осуществляет несколько функций: 1) специфическое связывание и удержание компонентов белоксинтезирующей системы [информационная, или матричная, РНК (иРНК): аминоацил-тРНК; пептидил-тРНК; гуанозинтрифосфат (ГТФ); белковые факторы трансляции EF - Т и EF - G]: 2) каталитические функции (образование пептидной связи, гидролиз ГТФ): 3) функции механического перемещения субстратов (иРНК, тРНК), или транслокации. Функции связывания (удержания) компонентов и катализа распределены между двумя рибосомными субчастицами. Малая рибосомная субчастица содержит участки для связывания иРНК и аминоацил-тРНК и, по-видимому, не несёт каталитических функций. Большая субчастица содержит каталитический участок для синтеза пептидной связи, а также центр, участвующий в гидролизе ГТФ: кроме того, в процессе биосинтеза белка она удерживает на себе растущую цепь белка в виде пептидил-тРНК. Каждая из субъединиц может проявить связанные с ней функции отдельно, без связи с другой субчастицей. Однако ни одна из субчастиц в отдельности не обладает функцией транслокации, осуществляемой только полной Рибосомы 3. Энзимопатии— общее название болезней или патологических состояний, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов. Выделяют наследственные энзимопатии, в основе которых лежит генетически обусловленная недостаточность одного или нескольких ферментов, и приобретенные, энзимопатии развивающиеся как следствие различных болезней, чаще хронических. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов. Особенностью течения наследственных энзимопатий является наличие скрытого периода, когда болезнь не имеет выраженных клин. симптомов, но может быть заподозрена или установлена на основании биохимических исследований крови, мочи или кала. 4. Витамин представлен двумя формами – эргокальциферол и холекальциферол. Химически эргокальциферол отличается от холекальциферола наличием в молекуле двойной связи С22 и С23 и метильной группой при С24.
После всасывания в кишечнике или после синтеза в коже витамин попадает в печень. Здесь он гидроксилируется по С25 и кальциферолтранспортным белком переносится к почкам, где еще раз гидроксилируется, уже по С1. Образуется 1,25 –дигидроксихолекальциерол или кальцитриол.
Реакция гидроксилирования в почках стимулируется паратгормоном, пролактином, соматотропным гормоном и подавляется высокими концентрациями фосфатов и кальция. растительные –люцерина,хвощ, крапива, петрушка. Животные- яичный желток, сливочное масло, сыр, рыбий жир, икра, молочные продукты Витамин D способствует правильному росту костей, предохраняет детей от развития рахита, ускоряет процессы заживления костной ткани при ее повреждениях. Витамин D регулирует в организме обмен кальция и фосфора. он поддерживает уровень неорганического Р и Са в плазме крови выше порогового значения и повышает всасывание Са в тонкой кишке. В качестве гормона действует активный метаболит витамина D - 1,25-диоксихолекациферол, образующийся в почках. Он оказывает влияние на клетки кишечника, почек и мышц: в кишечнике стимулирует выработку белка-носителя, необходимого для транспорта кальция, а в почках и мышцах усиливает реабсорбцию Ca++. Витамин D является главным звеном гормональной регуляции обмена кальция и фосфора: Увеличивает проницаемость плазматической мембраны энтероцитов для кальция и активный транспорт его в митохондрии. Индуцирует синтез белка-переносчика для выкачивания кальция из энтероцитов в кровь. Стимулирует абсорбцию фосфора в кишечнике. Стимулирует отложение солей кальция во вновь сформированном остеоидном матриксе. Способствует дифференцировке моноцитов и макрофагов в остеокласты. Снижает синтез остеобластами коллагена I типа, способствуя резорбции избытка неминерализованного остеоида. Усиливает реабсорбцию кальция в дистальных извитых канальцах почек. от него зависит восприимчивость организма к кожным заболеваниям, болезням сердца и раку. препятствует росту раковых клеток. Витамин D предупреждает слабость мышц, повышает иммунитет (уровень витамина D в крови служит одним из критериев оценки ожидаемой продолжительной жизни больных СПИДом), необходим для функционирования щитовидной железы и нормальной свертываемости крови.. Витамин D 3 участвует в регуляции артериального давления (в частности, при гипертонии у беременных) и сердцебиения. При наружном применении витамина D 3 уменьшается характерная для псориаза чешуйчатость кожи. 5.
6. Фермент синтеза гликогена гликогенсинтетаза "а" (активная форма), под воздействием цАМФ-зависимой протеинкиназы переходит в неактивную гликогенсинтетазу "b". Донором глюкозных остатков для синтеза гликогена служит УДФ-глюкоза, которая образуется из УТФ и глюкозо-1-фосфата под воздействием фермента глюкозо-1-фосфат-уридилтрансферазы: глюкозо-1-фосфат + УТФ ® УДФ-глюкоза + Н3РО4. Далее, под воздействием гликогенсинтетазы (1,4-гликозилтрансферазы) происходит перенос остатков глюкозы с УДФ-глюкозы на олигосахаридный фрагмент (гликоген - затравка). Синтезируется линейная цепь гликогена, где остатки глюкоза соединяются друг с другом 1-4 альфа-гликозидной связью: УДФ-глюкоза + n(глюкоза) ® УДФ + (1,4)-гликоген Ветвления в молекуле гликогена возникают в результате действия фермента ветвления: - амило-1,4-->1,6 гликозилтрансферазы. (1,4)-гликоген (1,4)-(1,6)-гликоген Гликоген — главная форма запасания углеводов у животных и 7. Гпиколипиды (3) содержатся во всех тканях, главным образом в наружном липидном слое плазматических мембран. Гликолипиды построены из сфингозина, остатка жирной кислоты и олигосахарида. Заметим, что в них отсутствует фосфатная группа. К наиболее простым представителям этой группы веществ относятся галактозилцерамид и глюкозилцерамид (так называемые цереброзиды). Соединения с сульфогруппой на углеводных остатках носят название сульфатидов.
Гликолипиды участвуют также в иммунных реакциях, активном транспорте ионов натрия, передаче нервного импульса. Билет №33 1. Главной целью биологической химии является формирование системных знаний о закономерностях и химическом строении основных веществ организма и молекулярных основах биохимических процессов, лежащих в основе жизнедеятельности организма в норме и патологии. 2. После установления химической природы наследственного материала проблема самовоспроизведения (репликации) хромосом, а точнее — генотипа превратилась в проблему репликации ДНК. Первостепенное значение для решения этой проблемы имела разработка модели строения ДНК Ф. Криком и Дж. Уотсоном в 1953 г. Структура двойной спирали позволяла представить простой механизм репликации ДНК: двойная спираль сначала раскручивается, цепи расходятся, а затем каждая одноцепочечная половина молекулы ДНК достраивается до целой, двухцепочечной молекулы:Последовательность нуклеотидов вновь синтезирующихся цепей определяется правилом комплементарности оснований и последовательностью нуклеотидов имеющейся цепи. Иначе говоря, имеющиеся нуклеотидные цепи служат матрицей для синтеза новых цепей; в результате получаются две двухцепочечные молекулы ДНК, идентичные исходной молекуле.
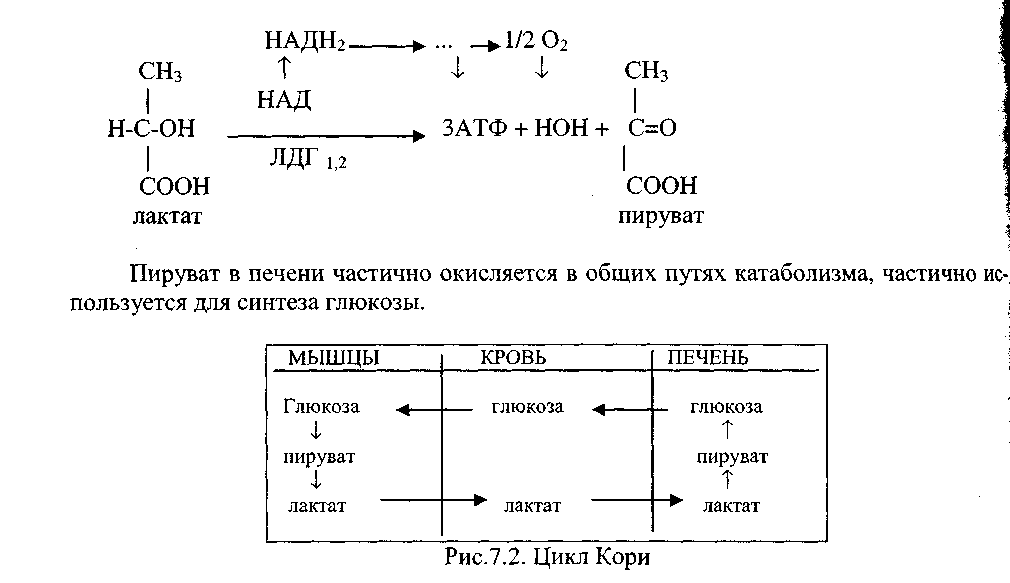
3. Ингибиторами ферментов называют вещества, снижающие их активность. Наибольший интерес представляют ингибиторы, взаимодействующие с активным центром фермента. Такие ингибиторы чаще всего являются структурными аналогами субстрата и, следовательно, комплементарны активному центру фермента. Поэтому они подавляют активность только одного фермента или группы ферментов с очень сходным устройством активного центра. Различают ингибиторы конкурентные и неконкурентные, обратимые и необратимые. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы. Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз). Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов. 4. Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо. Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н; Для детей незаменимыми также являются аргинин и гистидин. полноценность белковых продуктов во многом определяется содержанием в них незаменимых аминокислот. Если в молекуле присутствуют все восемь незаменимых аминокислот, белки называются полноценными, они наиболее необходимы организму. Источники полноценных белков – это в основном продукты животного происхождения: молоко, яйца, рыба, мясо. Особенно ценны три незаменимые аминокислоты – триптофан, лизин, метионин. Повышенное количество триптофана содержится в молоке, мясе, зерновых продуктах; лизина – в мясе и продуктах из крови убойных животных, рыбе, твороге, яйцах; метионина – в твороге, мясе, горохе, фасоли, сое. 5. ХЕМИОСМОТИЧЕСКАЯ ТЕОРИЯ учение о механизме преобразования энергии в биол. мембранах при синтезе аденозинтрифосфорной к-ты (АТФ). Разработана П. Митчеллом в 1961—66. Согласно исходным представлениям Митчелла, запасание энергии в АТФ происходит вследствие предварительного, накопления зарядов на стенках мембраны, создания мембранного потенциала и разности концентраций протонов. Разность электрохимических. потенциалов ионов водорода на сопрягающих мембранах (внутренней мембраны митохондрий, тилакоиды хлоропластов, мембраны бактерий) возникает за счёт энергии, выделяемой при деятельности цепи окислит.-восстановит, ферментов, или за счёт поглощённых квантов света. Трансмембранные электрохимич. потенциалы ионов могут служить источником энергии не только для синтеза АТФ, на и для транспорта веществ, движения бактериальных клеток и др. энергозависимых процессов. 6. В организме человека и животных при недостаточном поступлении кислорода в клетки возможен, так называемый, анаэробный дихотомический путь катаболизма глюкозы (анаэробный гликолиз). В интенсивно работающих скелетных мышцах, когда мощность механизма доставки кислорода в клетки оказываются недостаточными, включаются анаэробные механизмы синтеза АТФ происходящие вне митохондрий и без участия митохондриальных ферментов. В эритроцитах, где вообще отсутствуют митохондрии, потребность в АТФ удовлетворяется только за счет анаэробного гликолиза. Интенсивный анаэробный гликолиз характерен и для опухолевых клеток.
7. Гиперлипопротеинемия - общее наименование пяти различных типов нарушений обмена веществ, при которых в крови больных обнаруживают жиры. Заболевание может быть наследственным. При некоторых формах гиперлипопротеинемий симптомы выражены слабо, от них можно избавиться, соблюдая диету. Тяжелое течение заболевания может привести к смерти. Гиперлипопротеинемия обнаруживается примерно у каждого пятого человека с повышенным содержанием липидов и липопротеинов в крови. Это нарушение может быть также связано с наличием другого заболевания, например, диабета, болезни почек или поджелудочной и щитовидной желез.
Билет № 37 1. Роль биохимии в медицинской практике Практически любое заболевание начинается с повреждения (нарушения) одной реакции в метаболизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метаболизма ведет к нарушению гомеостаза в биологических жидкостях организма человека, что сопровождается изменением биохимических показателей. Большое значение клинико-биохимических методов исследования биологических жидкостей велико в медицине и важно для подготовки медицинских лабораторных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма.
2. Вторичная структура белка. Связи, стабилизирующие вторичную структуру белка
3. Коферменты ароматического ряда Убихинон Химическое строение: Убихинон имеет бензольное кольцо, связанное с различными группами (2, 3-диметокси-метил-1,4-бензохинон с изопреновой цепью в шестом положении):
Убихинон — очень важный кофермент процессов биологического окисления питательных веществ и образования энергии в клетках. Входя в состав компонентов дыхательной цепи в митохондриях, он осуществляет перенос водорода через мембраны к цитохромам. Кофермент Q включен во многие пищевые смеси, которые используются для коррекции массы тела, повышения физической работоспособности, а также в растирочные препараты для улучшения энергообразования в суставах и мышцах. Убихинон — весьма распространенный кофермент, отсюда его название — "вездесущий хинон". Он обнаружен во всех живых клетках. Внутри клеток убихинон локализован, по-видимому, только в митохондриях.
4. Строение, пищевые источники и биологические функции витамина С
Влияет на различные функции организма: проницаемость капилляров, рост и развитие костной ткани, повышает иммунобиологическую сопротивляемость к неблагоприятным воздействиям, стимулирует продукцию гормонов надпочечников, способствует регенерации. Отсутствие аскорбиновой кислоты в пище человека понижает сопротивляемость к заболеваниям, вызывает цингу, или скорбут (язва во рту). Суточная потребность в аскорбиновой кислоте составляет 60 мг — величина, не характерная для витаминов
5. Общие пути катаболизма. Окислительное декарбоксилирование альфа-кетоглутарата - общие пути катаболизма - единые пути катаболизма для различных классов веществ, являющиеся продолжением специфических путей. С общими путями катаболизма, в основном, связаны главные биоэнергетические процессы, сопряженные с высвобождением и накоплением энергии в клетке.
6. Химизм и биологическое значение процесса резервирования гликогена
7. Механизм синтеза жиров в жировой ткани
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот. Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг. 8. 392
Билет № 38
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 371; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.246.254 (0.095 с.) |








 Вторичная структура —полипептидная нить закручена в спираль и образуются водородные связи между СООН одного виткаи NH2 другого витка, образуя достаточно прочную структуру. Водородная, пептидная связи
Вторичная структура —полипептидная нить закручена в спираль и образуются водородные связи между СООН одного виткаи NH2 другого витка, образуя достаточно прочную структуру. Водородная, пептидная связи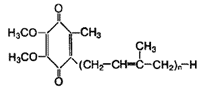
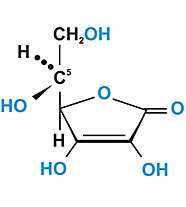 АСКОРБИНОВАЯ КИСЛОТА, С 6 Н 8 О 6, водорастворимый витамин. Синтезируется растениями (из галактозы), животными (из глюкозы), за исключением человека и приматов и некоторых других животных, которые получают аскорбиновую кислоту с пищей. Биологическая роль аскорбиновой кислоты связана с участием в окислительно-восстановительных процессах клеточного дыхания.
АСКОРБИНОВАЯ КИСЛОТА, С 6 Н 8 О 6, водорастворимый витамин. Синтезируется растениями (из галактозы), животными (из глюкозы), за исключением человека и приматов и некоторых других животных, которые получают аскорбиновую кислоту с пищей. Биологическая роль аскорбиновой кислоты связана с участием в окислительно-восстановительных процессах клеточного дыхания.
 В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП (рис. 8-22). Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП (рис. 8-22). Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.


