
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 13. 1. Синтез гема и его регуляция
1. Гем является простетической группой гемоглобина, миоглобина, цитохромов, каталазы, пероксидазы. 2. Гем синтезируется во всех клетках, но наиболее активно синтез идет в печени и костном мозге. Эти ткани нуждаются в больших количествах гема, необходимого для образования гемоглобина и цитохромов. Субстратами синтеза гема являются глицин, сукцинил-КоА и Fe2+. В матриксе митохондрий из глицина и сукцинил-КоА под действием пиридоксальзависимого фермента 5-аминолевулинатсинтазы образуется 5-аминолевулиновая кислота, которая поступает в цитоплазму. В цитоплазме фермент 5 -аминолевулинатдегидратаза катализирует реакцию конденсации двух молекул 5-аминолевулиновой кислоты с образованием порфобилиногена. Далее из четырех молекул порфобилиногена последовательно образуются промежуточные метаболиты - порфириногены, последний из которых поступает в митохондрии и превращается в протопорфирин ГХ. Фермент феррохелатаза завершает образование гема, присоединяя Fe2+ к протопорфирину IX (рис. 13.1).
В митохондриях клеток пиридоксальзависимый фермент 5-аминолевулинатсинтаза катализирует первую реакцию синтеза гема. Затем 5-аминолевулиновая кислота поступает в цитоплазму, где 5-аминолевулинатдегидратаза катализирует превращение двух молекул 5-аминолевулината в порфобилиноген, имеющий циклическое строение. В результате последовательных реакций в цитоплазме образуется протопорфирин IX. Он поступает в митохондрии и под действием фермента феррохелатазы соединяется с Fe+2 с образованием гема 3. Две первые реакции синтеза гема катализируют ферменты, аллостерическим ингибитором которых является гем. Вместе с тем гем является индуктором синтеза α- и β-цепей гемоглобина. В ретикулоцитах Fe2+ индуцирует синтез 5-аминолевулинатсинтазы (рис. 13.2). Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфаниламиды, эстрогены, прогестины) являются индукторами синтеза 5-аминолевулинатсинтазы. 4. В результате генетических дефектов или нарушений регуляции ферментов, участвующих в биосинтезе гема, развиваются порфирии. Первичные порфирии обусловлены генетическими дефектами в структуре генов,
Гем по принципу отрицательной обратной связи ингибирует 5-аминолевулинатсин- тазу и 5-аминолевулинатдегидратазу, а также является индуктором трансляции α- и β-цепей гемоглобина. Ионы Fe2+ индуцируют синтез 5-аминолевулинатсинтазы кодирующих ферменты синтеза гема, вторичные - связаны с нарушениями регуляции реакций синтеза гема. Порфирии может вызвать прием лекарственных препаратов, являющихся индукторами синтеза 5-аминолевулинат- синтазы. Эти заболевания сопровождаются накоплением в клетках промежуточных метаболитов синтеза гема порфириногенов, которые оказывают токсическое действие на нервную систему и вызывают нейропсихические симптомы. Порфириногены на свету превращаются в порфирины, которые при взаимодействии с кислородом образуют активные радикалы, повреждающие клетки кожи. ТЕМА 13.2. ОБМЕН ЖЕЛЕЗА Железо входит в состав гемсодержащих белков, а также металлофлавопротеинов, железосерных белков, трансферрина, ферритина. 1. Источником железа при биосинтезе белков, содержащих железо, являются пищевые продукты. Обычно всасывается не более 10% железа пищи. Железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезенки, может повторно использоваться для синтеза железосодержащих белков. Кислая среда желудка и присутствие в пище аскорбиновой кислоты, восстанавливающей Fe 3+, способствуют освобождению железа из солей органических кислот пищи (рис. 13.3). 2. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин улавливает железо в клетках слизистой кишечника и превращается в ферритин, который остается
• Железо поступает с пищей, транспортируется кровью в форме трансферрина, запасается в виде ферритина и используется для синтеза цитохромов, железосодержащих ферментов, гемоглобина и миоглобина. • Организм теряет железо с мочой, калом, потом и при кровотечениях. • Гемосидерин аккумулирует избыток железа в энтероцитах. Это снижает поступление железа в кровь из клеток кишечника. Когда потребности в железе невелики, скорость синтеза апоферритина повышается. Слущивание клеток слизистой оболочки кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется.
Фермент крови ферроксидаза (церулоплазмин) окисляет железо, оно связывается с гликопротеином крови трансферрином и транспортируется кровью (рис. 13.4). 3. Трансферрин взаимодействует со специфическими рецепторами и поступает в клетки. Количество рецепторов трансферрина зависит от содержания железа в клетках и регулируется на уровне транскрипции гена белкарецептора. При снижении содержания железа в клетках скорость синтеза рецепторов повышается, и наоборот.
В полости кишечника Fe3+ высвобождается из белков и солей органических кислот пищи. Усвоение Fe3+ улучшает аскорбиновая кислота, восстанавливающая его до Fe+2. Поступление Fe2+ из слизистой оболочки кишечника в кровь сопровождается окислением железа медьсодержащим ферментом плазмы крови ферроксидазой. Избыток поступившего в клетки слизистой оболочки кишечника железа соединяется с белком апоферритином, который окисляет железо и превращается в ферритин. В крови Fe3+ транспортирует белок плазмы крови трансферрин. В тканях Fe2+ используется для синтеза железосодержащих белков или депонируется в составе ферритина. 4. Белок ферритин играет роль депо железа в клетках печени, селезенки, костного мозга. Избыток железа аккумулируется в печени и других тканях в составе гранул гемосидерина. Если количество железа в клетках превышает объем ферритинового депо, то оно откладывается в белковой части молекулы ферритина. Таким образом ферритин превращается в гемосидерин, который плохо растворим в воде и может содержать до 37% железа. Накопление гранул гемосидерина в ретикулоэндотелиоцитах печени и селезенки может привести к повреждению органа - гемохроматозу. При недостаточном поступлении или нарушении утилизации железа развивается железодефицитная анемия. ТЕМА 13.3. КАТАБОЛИЗМ ГЕМА 1. Распад гема происходит в эндоплазматическом ретикулуме клеток эндотелиальной системы селезенки, костного мозга и печени при участии ферментов гемоксигеназной системы (рис. 13.5). В результате ряда превращений образуется непрямой (не дающий прямую реакцию с диазореактивом, так как связан с белком альбумином) - неконъюгированный билирубин. Билирубин плохо растворим в воде и транспортируется кровью в печень в комплексе с альбумином.
2. Билирубин поступает в гепатоциты по механизму облегченной диффузии с помощью белков-переносчиков лигандина и протеина Z. В печени билирубин конъюгирует с глюкуроновой кислотой под действием ферментов эндоплазматического ретикулума УДФ-глюкуронилтрансферазы I, катализирующей образование билирубинмоноглюкуронида и УДФ-глюкуронилтрансферазы II, образующей билирубиндиглюкуронид. В результате реакций конъюгации образуется прямой или конъюгированный, билирубин (рис. 13.6).
Синтез УДФ-глюкуронилтрансфераз индуцируют некоторые лекарственные препараты, например, фенобарбитал.
3. По механизму активного транспорта прямой билирубин в составе желчи поступает в двенадцатиперстную кишку. В кишечнике ферментами микрофлоры он гидролизуется с образованием билирубина и глюкуроновой кислоты. Билирубин в результате нескольких реакций восстановления превращается в бесцветные тетрапирролы - уробилиногены. В результате окисления они превращаются в уробилин, который выводится из организма, являясь пигментом кала уробилином (стеркобилином) (200-300 мг/сут). Небольшая часть уробилиногенов всасывается в кишечнике, с кровью воротной вены транспортируется в печень, оттуда поступает в кровь, затем в почки и, окисляясь в пигмент желтого цвета уробилин, удаляется с мочой(3-4 мг/ сут). 4. Концентрация общего билирубина в крови здорового человека составляет 1,7-17 мкмоль/л (0,1-1 мг/дл). Повышение концентрации билирубина в крови - гипербилирубинемия - может быть обусловлено увеличением образования билирубина, превышающим способность гепатоцитов его конъюгировать и экскретировать в кишечник, закупоркой желчевыводящих протоков, генетическими дефектами ферментов и белков, участвующих в метаболизме билирубина в печени. Когда концентрация билирубина в крови превышает норму более чем в 2,5 раза, он поступает в ткани, окрашивая их в желтый цвет. Пожелтение склер глаз, кожи и слизистых оболочек из-за отложения в них билирубина называют желтухой. 5. При дифференциальной диагностике желтух в крови определяют концентрацию прямого, непрямого и общего билирубина, в моче - содержание прямого билирубина и уробилина, в кале - содержание уробилина (стеркобилина). В зависимости от механизма возникновения различают несколько типов желтух. • Гемолитическая (надпеченочная) желтуха является следствием ускоренного гемолиза эритроцитов при генетических дефектах глюкозо- 6-фосфат дегидрогеназы, пируваткиназы или белков плазматической мембраны эритроцитов, отравлении сильными окислителями, переливании несовместимых групп крови. При этом увеличивается по сравнению с нормой поступление билирубина в кровь и образование непрямого билирубина. Уровень непрямого билирубина в крови возрастает в 2-3 раза по сравнению с нормой, так как потенциальная способность гепатоцитов инактивировать билирубин ограничена. В моче и кале повышено содержание уробилина и стеркобилина, соответственно. • Механическая (подпеченочная) желтуха является результатом нарушения секреции желчи, вызванным закупоркой желчных протоков камнями или послеоперационными рубцами. В крови повышается концентрация непрямого и прямого билирубина, который поступает в мочу, придавая ей коричневый цвет. В моче и кале отсутствуют уробилин и стеркобилин, поэтому кал больных ахолический (бесцветный).
• Печеночно-клеточная (печеночная) желтуха сопровождает разные формы гепатита. В этом случае снижается способность гепатоцитов захватывать билирубин из крови и экскретировать его в кишечник, поэтому в крови повышается концентрация прямого и непрямого билирубина, а в моче и кале снижается содержание конечных продуктов распада гема. Поскольку концентрация прямого билирубина в крови превышает почечный порог, то он фильтруется в мочу, окрашивая ее в коричневый цвет. Из-за снижения содержания стеркобилина кал больных светлый. • Желтуха новорожденных - это «физиологическая» желтуха. Она обусловлена большим по сравнению взрослым организмом количеством эритроцитов в расчете на массу тела. После рождения ребенка эритроциты разрушаются, так как HbF замещается HbA. Кроме того, у новорожденных может наблюдаться запаздывание «включения» гена глюкуронилтрансферазы, недостачная способность гепатоцитов улавливать билирубин из крови и экскретировать прямой билирубин в желчь. Неконъюгированный билирубин проходит через гематоэнцефалический барьер и, являясь разобщителем окислительного фосфорилирования, снижает синтез АТФ в клетках головного мозга и вызывает пирогенное действие. Дегенеративные изменения нервных клеток приводят к билирубиновой энцефалопатии. Новорожденным назначают барбитураты для индукции синтеза глюкуронилтрансферазы. Кроме того, для снижения уровня неконъюгированного билирубина используют фототерапию новорожденных сине-зеленым светом с длиной волны 620 нм. В результате такого облучения билирубин окисляется и превращается в гидрофильные фотоизомеры, которые поступают в почки и выводятся из организма с мочой. • Наследственные желтухи обусловлены генетическими дефектами белков, участвующих в метаболизме билирубина в печени. Например, синдром Жильбера связан с генетическими дефектами белков, захватывающих билирубин из крови, синдром Дубина-Джонса - с дефектом белков, участвующих в экскреции прямого билирубина в кишечник, а при синдроме Криглера-Найяра нарушена первичная структура глюкуронилтрансферазы.
МОДУЛЬ 14 БИОХИМИЯ КРОВИ Темы _ 14.1. Метаболизм эритроцитов 14.2. Особенности метаболизма фагоцитирующих клеток 14.3. Основные биохимические механизмы гемостаза 14.4. Основные свойства белковых фракций крови и значение их определения для диагностики заболеваний
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 2402; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.193.129 (0.013 с.) |
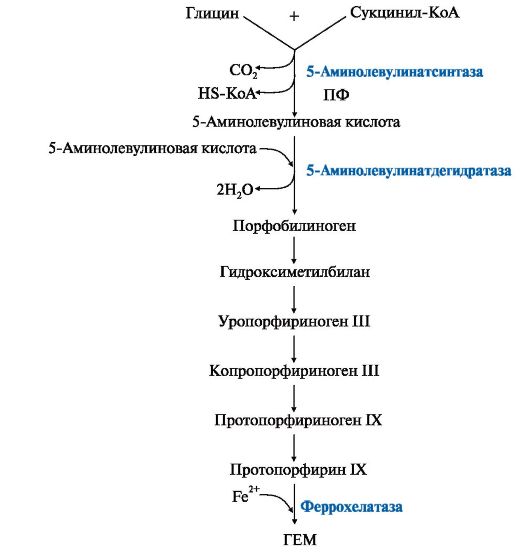 Рис. 13.1. Синтез гема.
Рис. 13.1. Синтез гема. Рис. 13.2. Регуляция синтеза гема и гемоглобина.
Рис. 13.2. Регуляция синтеза гема и гемоглобина. Рис. 13.3. Обмен железа.
Рис. 13.3. Обмен железа.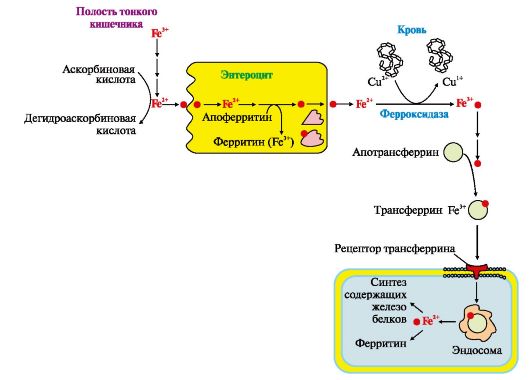 Рис. 13.4. Поступление экзогенного железа в ткани.
Рис. 13.4. Поступление экзогенного железа в ткани.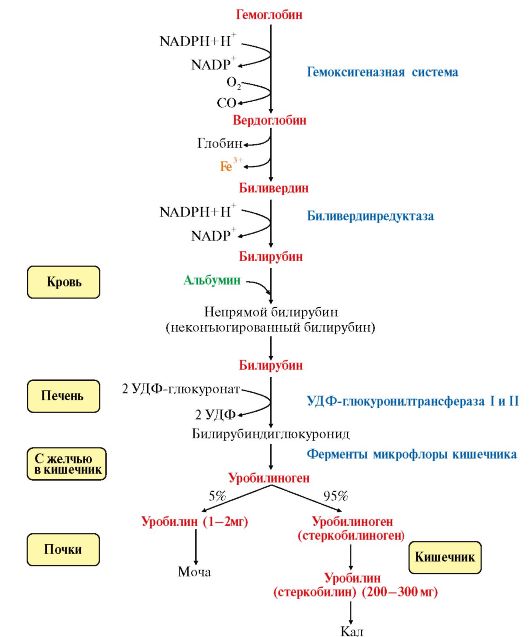 Рис. 13.5. Катаболизм гема
Рис. 13.5. Катаболизм гема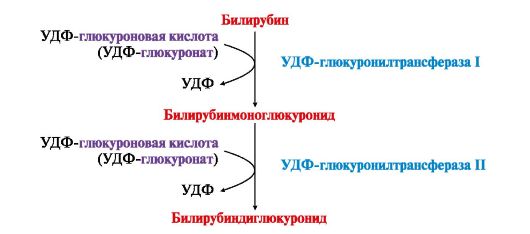 Рис. 13.6. Образование билирубинмоноглюкуронида и билирубиндиглюкуронида (прямого билирубина) в гепатоцитах
Рис. 13.6. Образование билирубинмоноглюкуронида и билирубиндиглюкуронида (прямого билирубина) в гепатоцитах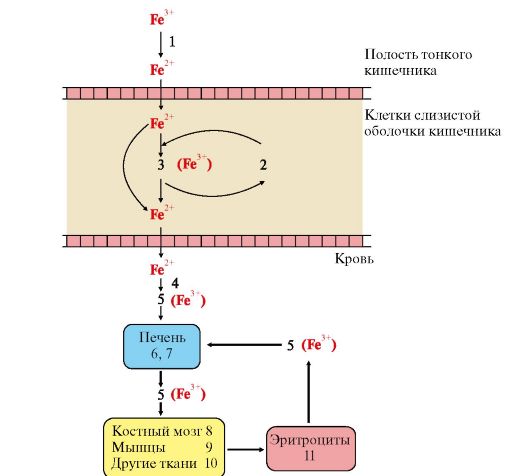 Рис. 13.7. Поступление, транпорт и использование железа в организме
Рис. 13.7. Поступление, транпорт и использование железа в организме


