
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. 4. Кофакторы и коферменты
Большинство ферментов для проявления каталитической активности нуждается в присутствии некоторых веществ небелковой природы - кофакторов. Различают две группы кофакторов: ионы металлов и коферменты. 1. Ионы металла участвуют в функционировании фермента различными способами. • Изменяют конформацию молекулы субстрата, что обеспечивает комплементарное взаимодействие с активным центром. Например, в качестве субстрата выступает комплекс Mg2+-АТФ. • Обеспечивают нативную конформацию активного центра фермента. Ионы Mg2+, Mn2+, Zn2+, Co2+, Mo2+ участвуют в стабилизации активного центра ферментов и способствуют присоединению кофермента. • Стабилизируют конформацию белковой молекулы фермента. Например, для стабилизации четвертичной структуры фермента алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. • Непосредственно участвуют в ферментативном катализе. Ионы Zn2+, Fe2+, Мп2+, Cu2+ принимают участие в электрофильном катализе. Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях:
Таблица 2 .1. Структура и функция основных коферментов
ФЕРМЕНТОВ 1. В названии большинства ферментов содержится суффикс «аза», присоединенный к названию субстрата реакции (например: уреаза, сахараза, липаза, нуклеаза) или к названию химического превращения определенного субстрата (например: лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза, пируваткарбоксилаза). Однако в употреблении сохранился ряд тривиальных, исторически закрепленных названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения (например трипсин, пепсин, ренин, тромбин и др.).
2. Для того чтобы систематизировать имеющиеся в природе ферменты, Международный союз биохимии и молекулярной биологии (IUBMB) в 1961 г. разработал номенклатуру, согласно которой все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов, в зависимости от преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы; 2-й класс - трансферазы; 3-й класс - гидролазы; 4-й класс - лиазы; 5-й класс - изомеразы; 6-й класс - лигазы. Эта классификация необходима для точного определения фермента: для каждого фермента имеется кодовое число. Например, фермент маладегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовое число - 1.1.1.38. Первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+), последняя цифра - это порядковый номер фермента в данной подгруппе. 3. Характеристика основных классов ферментов с примерами катализируемых ими реакций. 1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции. Класс делится на подклассы: а) дегидрогеназы катализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа (рис. 2.5), изоцитратдегидрогеназа, сукцинатдегидрогеназа, α-кетобутиратдегидрогеназа и др.;
б) оксидазы - катализируют реакции окисления с участием молекулярного кислорода (рис. 2.6);
в) оксигеназы (гидроксилазы) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды (рис. 2.7).
Коферменты реакции: тетрагидробиоптерин (Н4БП) и дигидробиоптерин (Н2БП) 2. Трансферазы - катализируют реакции переноса функциональных групп. В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы (рис. 2.8), ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы) (рис. 2.9).
ПФ - кофермент пиридоксальфосфат
АТФ является донором остатка фосфорной кислоты 3. Гидролазы катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются на подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др. Пример схемы реакции гидролиза молекулы белка приведен на рис. 2.10.
4. Лиазы - к лиазам относятся ферменты, отщепляющие от субстратов негидролитическим путем определенные группы, такие, как СО2, Н2О, NH2SH2 и др., или присоединяющие (например, молекулу воды) по двойной связи. Реакция декарбоксилирования (отщепления молекулы CO2) приведена на рис. 2.11, а реакция присоединения молекулы воды (гидратазная реакция) - на рис. 2.12.
ПФ-кофермент пиридоксальфосфат
5. Изомеразы катализируют различные внутримолекулярные превращения (рис. 2.13).
6. Лигазы (синтетазы) катализируют реакции усложнения молекулы за счет присоединения друг к другу двух молекул с образованием ковалентной связи; при этом используется энергия АТФ или других макроэргических соединений (рис. 2.14).
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 2915; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.132.194 (0.006 с.) |
 2. Коферменты являются органическими веществами, чаще всего производными витаминов, которые непосредственно участвуют в ферментативном катализе, так как находятся в активном центре ферментов. Фермент, содержащий кофермент и обладающий ферментативной активностью, называют холоферментом. Белковую часть такого фермента называют апоферментом, который в отсутствие кофермента не обладает каталитической активностью.
2. Коферменты являются органическими веществами, чаще всего производными витаминов, которые непосредственно участвуют в ферментативном катализе, так как находятся в активном центре ферментов. Фермент, содержащий кофермент и обладающий ферментативной активностью, называют холоферментом. Белковую часть такого фермента называют апоферментом, который в отсутствие кофермента не обладает каталитической активностью. Кофермент может связываться с белковой частью фермента только в момент реакции или быть связанным с апоферментом прочными ковалентными связями. В последнем случае он называется простетической группой. Примеры наиболее распространенных коферментов - производных витаминов, а также их участие в ферментативных процессах - приведены в табл. 2.1.
Кофермент может связываться с белковой частью фермента только в момент реакции или быть связанным с апоферментом прочными ковалентными связями. В последнем случае он называется простетической группой. Примеры наиболее распространенных коферментов - производных витаминов, а также их участие в ферментативных процессах - приведены в табл. 2.1.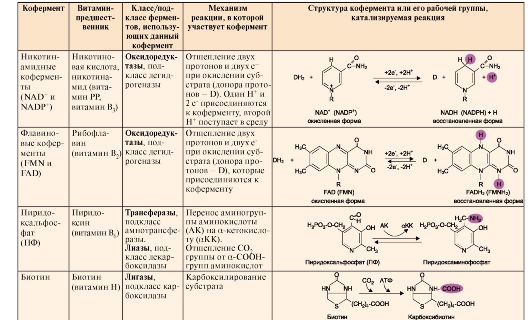 Окончание табл. 2 .1.
Окончание табл. 2 .1.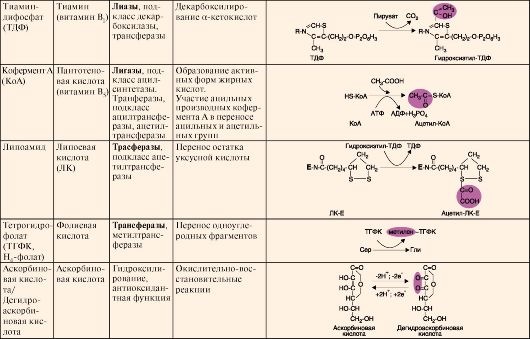 ТЕМА 2.5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
ТЕМА 2.5. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА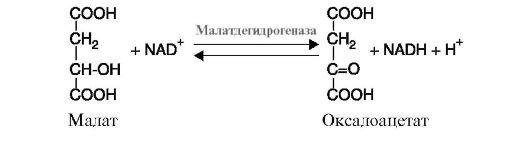 Рис. 2.5. Реакция дегидрирования малата
Рис. 2.5. Реакция дегидрирования малата Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой
Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой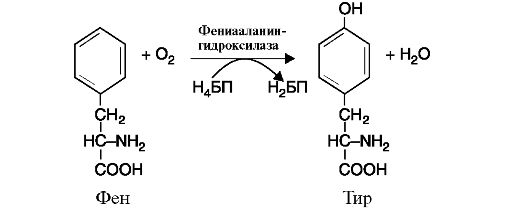 Рис. 2.7. Реакция гидроксилирования фенилаланина.
Рис. 2.7. Реакция гидроксилирования фенилаланина.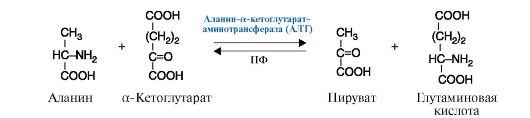 Рис. 2.8. Реакция, катализируемая ферментом АЛТ (Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз.
Рис. 2.8. Реакция, катализируемая ферментом АЛТ (Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз. Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.
Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.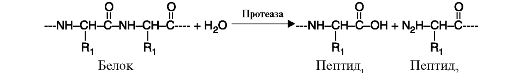 Рис. 2.10. Реакция гидролиза молекулы белка
Рис. 2.10. Реакция гидролиза молекулы белка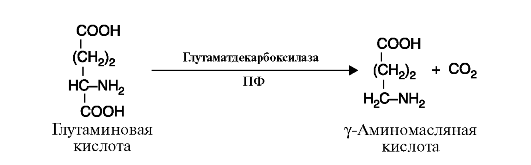 Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)
Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)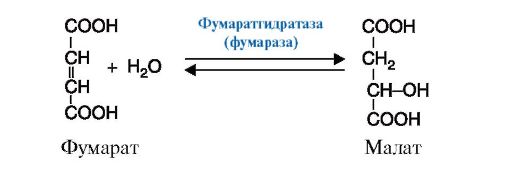 Рис. 2.12. Реакция присоединения молекулы воды к фумарату
Рис. 2.12. Реакция присоединения молекулы воды к фумарату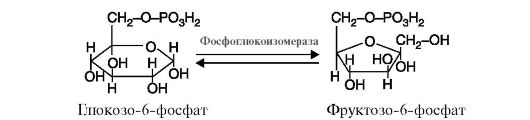 Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза
Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза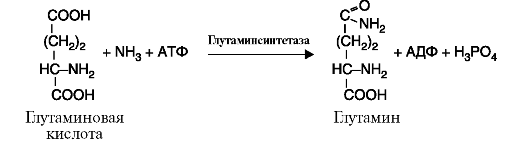 Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой
Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой


