
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дитилин - конкурентный агонист Н-холинорецепторов, ингибирующий функцию нервно-мышечных синапсов.
ТЕМА 1.3. ДЕНАТУРАЦИЯ БЕЛКОВ И ВОЗМОЖНОСТЬ ИХ СПОНТАННОЙ РЕНАТИВАЦИИ 1. Так как нативная конформация белков поддерживается за счет слабых взаимодействий, изменение состава и свойств окружающей белок среды, воздействие химических реагентов и физических факторов вызывают изменение их конформации (свойство конформационной лабильности). Разрыв большого количества связей приводит к разрушению нативной конформации и денатурации белков. Денатурация белков - это разрушение их нативной конформации под действием денатурирующих агентов, вызванное разрывом слабых связей, стабилизирующих пространственную структуру белка. Денатурация сопровождается разрушением уникальной трехмерной структуры и активного центра белка и потерей его биологической активности (рис. 1.16). Все денатурированные молекулы одного белка приобретают случайную конформацию, отличающуюся от других молекул того же белка. Радикалы аминокислот, формирующие активный центр, оказываются пространственно удаленными друг от друга, т.е. разрушается специфический центр связывания белка с лигандом. При денатурации первичная структура белков остается неизменной.
Таблица 1.1. Реагенты и условия, вызывающие денатурацию белков
Применение денатурирующих агентов в биологических исследованиях и медицине. В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений обычно из раствора вначале удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту (ТХУ). После добавления ТХУ в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием (табл. 1.1.)
В медицине денатурирующие агенты часто применяют для стерилизации медицинского инструмента и материала в автоклавах (денатурирующий агент - высокая температура) и в качестве антисептиков (спирт, фенол, хлорамин) для обработки загрязненных поверхностей, содержащих патогенную микрофлору. 2. Спонтанная ренативация белков - доказательство детерминированности первичной структуры, конформации и функции белков. Индивидуальные белки - это продукты одного гена, которые имеют идентичную аминокислотную последовательность и в клетке приобретают одинаковую конформацию. Фундаментальный вывод о том, что в первичной структуре белка уже заложена информация о его конформации и функции, был сделан на основе способности некоторых белков (в частности, рибонуклеазы и миоглобина) к спонтанной ренативации - восстановлению их нативной конформации после денатурации. Формирование пространственных структур белка осуществляется способом самосборки - самопроизвольного процесса, при котором полипептидная цепь, имеющая уникальную первичную структуру, стремится принять в растворе конформацию с наименьшей свободной энергией. Способность к ренативации белков, сохраняющих после денатурации первичную структуру, описана в опыте с ферментом рибонуклеазой. Рибонуклеаза - фермент, разрушающий связи между отдельными нуклеотидами в молекуле РНК. Этот глобулярный белок имеет одну полипептидную цепь, третичная структура которой стабилизирована множеством слабых и четырьмя дисульфидными связями.
Обработка рибонуклеазы мочевиной, разрушающей водородные связи в молекуле, и восстановителем, разрывающим дисульфидные связи, приводит к денатурации фермента и потере его активности. Удаление денатурирующих агентов диализом приводит к восстановлению конформации и функции белка, т.е. к ренативации. (рис. 1.17).
А - нативная конформация рибонуклеазы, в третичной структуре которой имеются четыре дисульфидные связи; Б - денатурированная молекула рибонуклеазы; В - ренативированная молекула рибонуклеазы с восстановленной структурой и функцией Таблица 1.3. Структура и функции окситоцина и вазопрессина
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 617; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.253.221 (0.005 с.) |
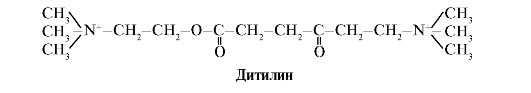 Нервно-мышечные синапсы скелетных мышц содержат Н-холинорецепторы. Их взаимодействие с ацетилхолином приводит к мышечным сокращениям. При некоторых хирургических операциях, а также в эндоскопических исследованиях используют препараты, вызывающие расслабление скелетных мышц (миорелаксанты). К ним относится дитилин, являющийся структурным аналогом ацетилхолина. Он присоединяется к Н-холинорецепторам, но в отличие от ацетилхолина очень медленно разрушается ферментом - ацетилхолинэстеразой. В результате длительного открытия ионных каналов и стойкой деполяризации мембраны нарушается проведение нервного импульса и происходит мышечное расслабление. Первоначально эти свойства были обнаружены у яда кураре, поэтому такие препараты называют курареподобными.
Нервно-мышечные синапсы скелетных мышц содержат Н-холинорецепторы. Их взаимодействие с ацетилхолином приводит к мышечным сокращениям. При некоторых хирургических операциях, а также в эндоскопических исследованиях используют препараты, вызывающие расслабление скелетных мышц (миорелаксанты). К ним относится дитилин, являющийся структурным аналогом ацетилхолина. Он присоединяется к Н-холинорецепторам, но в отличие от ацетилхолина очень медленно разрушается ферментом - ацетилхолинэстеразой. В результате длительного открытия ионных каналов и стойкой деполяризации мембраны нарушается проведение нервного импульса и происходит мышечное расслабление. Первоначально эти свойства были обнаружены у яда кураре, поэтому такие препараты называют курареподобными.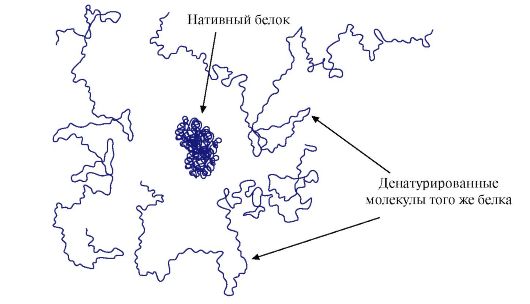 Рис. 1.16. Структура нативного белка и трех денатурированных молекул того же белка
Рис. 1.16. Структура нативного белка и трех денатурированных молекул того же белка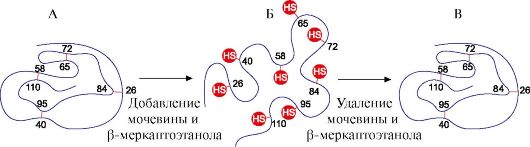 Рис. 1.17. Денатурация и ренативация рибонуклеазы
Рис. 1.17. Денатурация и ренативация рибонуклеазы Для этого:
Для этого:


