Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень. ⇐ ПредыдущаяСтр 4 из 4
Метаболизм глюкозы в эритроцитах. Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% - в пентозофосфатном пути. Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата. Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином. Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глу-татиона.
Метаболизм глюкозы в печени. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени. В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»). Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобногексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата, при этом активность глюкокиназы в печенипочти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом. Считают, что основная роль печени – расщепление глюкозы – сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные впечени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения. В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтезажирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтезануклеиновых кислот. Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служитгликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печенибольшое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Метаболизм глюкозы в мозгу. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисленияглюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Между глюкозой и гликогеном мозговой ткани имеется тесная связь, выражающаяся в том, что при недостаточном поступлении глюкозыиз крови гликоген головного мозга является источником глюкозы, а глюкоза при ее избытке – исходным материалом для синтеза гликогена. Распад гликогена в мозговой ткани происходит путем фосфоролиза с участием системы цАМФ. Однако в целом использование гликогена в мозге по сравнению с глюкозой не играет существенной роли в энергетическом отношении, так как содержание гликогена в головном мозге невелико. Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу. Значение этого явления пока недостаточно ясно, ибо гликолиз как источник энергии ни в коей мере не может сравниться по эффективности с тканевым дыханием в головном мозге.
Метаболизм глюкозы в мышцах. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов.
Метаболизм глюкозы в жировой ткани. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот. Cтроение и виды протеогликанов. В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные - например агрекан и версикан. Кроме них, в межклеточном матриксе имеется целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там самые разнообразные функции. Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный "ёршик". В хрящевой ткани молекулы агрекана собираются в агрегаты с гаалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалент-ными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахаридными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200 × 106 Д состоит из одной молекулы гиалуроновой кислоты и 100 молекул агрекана (и такого же количества связывающего белка). Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и "выталкивается" в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Малые протеогликаны. Малые протеогликаны - протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани. Эти протеогликаны имеют небольшой коровый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан. Коровые белки бигликана и декорина похожи по размерам и структуре (молекулярная масса 36 000 и 38 000 Д, соответственно). Они имеют несколько тандемных повторов, богатых лейцином, которые образуют α-спирали или β-структуры. На N- и С-концах этих белков имеются домены, содержащие S-S-связи. Ко'ровые белки значительно различаются по первичной структуре в N-концевых областях, что определяет различия в присоединении гликозаминогликанов. Бигликан содержит серии в положениях 5 и 11, что обеспечивает присоединение двух полисахаридных цепей. Декорин содержит один серии в положении 4, поэтому к нему присоединяется одна полисахаридная цепь. У этих протеогликанов полисахаридные цепи представлены дерматансульфатом с молекулярной массой ~ 30 000 Д.Ко́ровый белок фибромодулина (молекулярная масса ~ 40 000 Д) тоже имеет области тандемных повторов, богатые лейцином, но его N-концевая область отличается тем, что не содержит серина, а имеет несколько сульфатированных остатков тирозина, поэтому одна или две цепи кератансульфата присоединяются к ко'ровому белку фибромодулина не в N-концевой, а в области, богатой лейцином, через NH2-группу аспарагина. Малые протеогликаны являются мультифункциональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр (т.е. препятствуют образованию толстых фибрилл). Декорин и бигликан, присоединяясь к фибронектину, подавляют клеточную адгезию, а присоединяясь к фактору роста опухолей (3, снижают его митогенную активность. Кроме этого, имеется большое количество данных о том, что малые протеогликаны играют важную регуляторную роль в процессах развития и восстановления соединительной ткани.
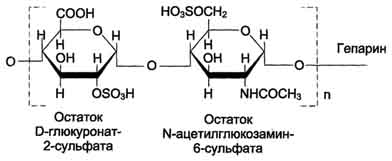
50. Гликозаминогликаны представляют собой длинные неразветвлённые цепи гетерополиса-харидов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером - производное аминосахара (глюкоз- или галактозамина). NH2-rpynna аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата. и других пузырьков
• протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса; • все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Na+, K+, Са2+) и таким образом участвовать в формировании тургора различных тканей; • протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов; • гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах; • гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках; • кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы; • гепарин - антикоагулянт; • гепарансульфаты - компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических
Гликолипиды —сложные липиды, образующиеся в результате соединения липидов с углеводами. У гликолипидов имеются полярные «головы» (углевод) и неполярные «хвосты» (остатки жирных кислот). Благодаря данному свойству, вместе с фосфолипидами, гликолипиды входят в состав клеточных мембран. Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводые компоненты входят в число других углеводов клеточной поверхности.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1802; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.0.25 (0.012 с.) |