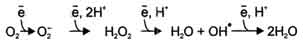Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Терморегуляторная функция тканевого дыхания.
Около 55 % энергии полного расщепления глюкозы аккумулируется в макроэргических связях аденозинтрифосфорной кислоты (АТФ) и использу- ется для обеспечения функций клетки или пластичных процессов в ней. Остальная часть энергии является непосредственным источником теплообра- зования. Несопряженное дыхание выполняет важную терморегуляторную функцию. Оно обеспечивает поддержание температуры тела на более вы- соком уровне, чем температура окружающей среды. Степень сопряженности дыхания и фосфорилирования в клетках является регулируемым процессом, связанным с состоянием митохондрий. В патологических условиях митохон- дрии могут длительное время находиться в набухшем состоянии. Это стиму- лирует гликолиз. При действии холода организм нуждается в срочной моби- лизации тепла, которая происходит путем разобщения окислительного фос- форилирования и свободного окисления. При таком разобщении энергетиче- ский обмен клетки направляется в сторону повышенного образования тепла за счет временного снижения специфической функции клетки. В норме интенсивность митохондриального транспорта электронов ре- гулируется содержанием АДФ. Выполнение клеткой функций с затратой АТФ приводит к накоплению АДФ, который в свою очередь активирует тка- невое дыхание, осуществляя таким образом дыхательный контроль, что поз- воляет клеткам правильно реагировать на интенсивность клеточного метабо- лизма и поддерживать запасы АТФ на необходимом уровне. За счет наличия дыхательного контроля возможна терморегуляторная функция тканевого ды- хания: процессы разобщения тканевого дыхания и окислительного фосфори- лирования приводят к повышению температуры тела. Благодаря этому эво- люционно стало возможным поддержание оптимальной температуры тела, для протекания всех жизненно важных биологических процессов и незави-46
симость от условий окружающей среды. Однако без дыхательного контроля разобщение между процессами тканевого дыхания и окислительного фосфо-рилирования могут привести к необратимому повышению температуры тела и гибели организма.
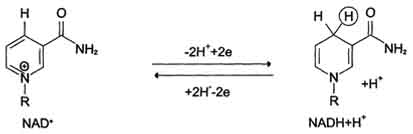
Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+ (см. раздел 2). NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид. Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+. Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах. Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию: NADPH + NAD+ ↔ NADP+ + NADH.
8. Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2. Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система. FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента. Большинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе. 9. Цитохромы или гемопротеины присутствуют во всех типах организмов. В клетках эукариотов они локализованы в митохондриальных мембранах и в ЭР. Известно около 30 различных цитохромов. Все цитохромы в качестве простетической группы содержат гем. Их многообразие обусловлено:
В зависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами (b, b1, b2 и т.д.). Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных потенциалах. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов. Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3 каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гема цитохромов с и c1. Он содержит формильную группу вместо одной из метальных групп и углеводородную цепь вместо одной из винильных групп. Другая особенность комплекса а-а3 - наличие в нём ионов меди, связанных с белковой астью в так называемых CuA-центрах. Перенос электронов комплексом а-а3 включает реакции: Cu+ ↔ Cu2+ + e, Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом.
10. Окислительное фосфорилирование — синтез АТФ за счет энергии электронов мигрирующих по дыхательной цепи. Также окислительным фос-форилированием называют синтез АТФ за счет энергии трансмембранного электрохимического потенциала. Электрохимический потенциал является ре-зультатом переноса протонов из митохондриального матрикса в межмем-бранное пространство. Перенос протонов обусловлен движением электронов по дыхательной цепи. Окислительное фосфорилирование состоит из двух независимых, но функционально тесно связанных процессов: перенос электронов по дыхательной цепи, который катализируют фер-ментативные комплексы (от НАДН или QН2 к молекулярному кислороду), из-за высокой разности в электрохимических потенциалов доноров электро-нов (НАДН и QН2) и акцептора (О2) этот процесс является высоко экзергони-ческим и большая часть выделяющейся энергии используется для создания протонного градиента; синтез АТФ с помощью ферментативного комплекса (комплекс V), называемого протон-транспортирующая АТФ-синтаза, фосфорилирование АДФ с образованием АТФ процесс эндергонический, при этом используется энергия уже созданного протонного градиента. Коэффициент Р/О (коэффициент окислительного фосфорилирова-ния) является мерой эффективности дыхания как поставщика энергии для синтеза АТФ. Коэффициент Р/О (или Р/2е-) численно равен отношению ко-личества синтезированного АТФ к количеству атомов потребленного кисло-рода. Чем выше коэффициент, тем больше синтезируется АТФ в расчете на каждые 2 моль перенесенных электронов. В случае полной дыхательной цепи Р/О близок к 2,5 и в случае укороченной к 1,5.
Преобразование энергии электронов в энергию АТФ происходит в два этапа. На первом энергия электронов преобразуется в энергию протонного градиента. Концентрация протонов в межмембранном пространстве больше чем в матриксе митохондрии. Поскольку каждый протон несет положитель-ный заряд, вследствие этого появляется разность потенциалов по обе сторо-ны мембраны. В совокупности электрический и концентрационный градиен-ты составляют электрохимический потенциал (ΔμН+). ΔμН+ - Источник энер-гии для синтеза АТФ. Активный транспорт протонов происходит в трех участках дыхательной цепи, в ферментативных комплексах I, III и IV (рис. 21). Эти участки часто называют пунктами сопряжения дыхания и фосфорилирования, хотя правильнее считать пунктом сопряжения окисления (дыха-ния) и фосфорилирования комплекс V, в котором синтезируется АТФ. На втором этапе синтезируется АТФ. Синтез АТФ. Фермент Н+-транслоцирующая АТФ синтаза (комплекс V) состоит из двух крупных белковых комплексов, каждый из которых по-строен из многих субъединиц. В структуре этого фермента выделяют про-тонный канал (Fо) и каталитическую часть фермента (F1) содержащую три активных центра. В каждый из активных центров поступают молекулы АДФ и неорганического фосфата (Ф). Протонный канал пронизывает внутреннюю митохондриальную мембрану, а каталитическая часть фермента представляет собой крупное грибовидное образование, обращенное в сторону матрикса. Ультразвуковая обработка интактных (неповрежденных) митохондрий вызы-вает остановку синтеза АТФ, поскольку каталитическая часть фермента F1 отделяется от протонного канала. При этом поступление потока протонов из межмембранного пространства в митохондриальный матрикс не нарушается. Под действием потока протонов по каналу каталитическая часть АТФ синтазы (F1) вращается вокруг устья канала. Синтез АТФ проходит три ста-дии: 1) поступление АДФ и неорганического фосфата (Pi) в каталитический центр, 2) поворот на 120о и сжимающая деформация каталитического центра, сближающая отталкивающиеся группы остатков фосфорной кислоты; на этой стадии происходит образование АТФ и молекулы воды, 3) поворот на 120о и освобождение из активного центра молекулы АТФ. Затем следует поворот на 120о АТФ синтазы и в освободившийся ката-литический центр поступают новые молекулы АДФ и Pi (неорганического фосфата)
13. Нарушения энергетического обмена. Гипоэнергетические состояния
14. Образование токсических форм кислорода, механизм их повреждающего действия на клетки В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода. В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон. Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки. Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции. Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород. В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов. В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода. Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов и витаминов.
15.???
Если процесс катаболизма рассматривать с общей точки зрения, то можно выделить три основные его части: 1. Расщепление в пищеварительном тракте. Это гидролитические реакции, превращающие сложные пищевые вещества в относительно небольшое число простых метаболитов: глюкоза, аминокислоты, глицерин, жирные кислоты. 2. Специфические пути катаболизма. Простые метаболиты подвергаются специфическим реакциям расщепления, в результате которых образуется либо пировиноградная кислота, либо ацетил — КоА. Причем ацетил — КоА может образоваться из пирувата в результате окислительного декарбоксилирования. Могут также образоваться другие соединения, непосредственно включающиеся в цитратный цикл. 3. Цитратный цикл и дыхательная цепь завершают расщепление пищевых веществ до конечных продуктов — СО2 и Н2О. Следовательно, начиная со стадии образования пирувата происходит унификация путей катаболизма. Из большого числа исходных соединений образуется всего два — пируват и ацетил — СоА. Процесс, начинающийся от пирувата, называется общим путем катаболизма и в свою очередь включает:
Именно в общем пути катаболизма образуется основная масса субстратов для реакций дегидрирования. Совместно с дыхательной цепью и окислительным фосфорилированием общий путь катаболизма является основным источником энергии в форме АТР. 17. Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2 В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль. Строение пируватдегидрогеназного комплекса Процесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза. Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×106. В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа - FAD.Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой. Окислительное декарбоксилирование пирувата Превращение пирувата в ацетил-КоА включает 5 стадий
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
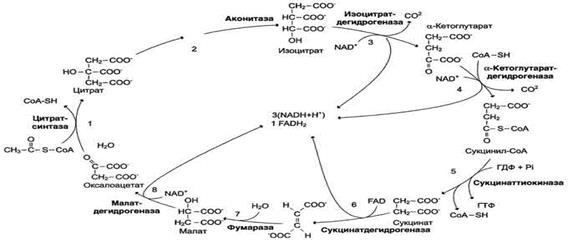
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА 18. Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
Последовательность реакций цитратногоцикла Образование цитрата
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 3455; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.248.208 (0.03 с.) |