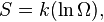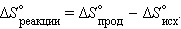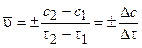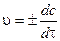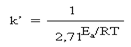Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие об энтропии. Уравнение Больцмана. Стандартная энтропия. Расчет стандартного изменения энтропии реакции.
Понятие энтропии было впервые введено в 1865 году Р. Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение изменения общего количества тепла ΔQ к величине абсолютной температуры T:
Уравнение Больцмана
где константу k=1,38•10–23 Дж/К мы знаем теперь как постоянную Больцмана, а Ω является числом микросостояний, которые возможны в имеющемся макроскопическом состоянии. Принцип Больцмана связывает микроскопические свойства системы (Ω) с одним из её термодинамических свойств (S). Изменение стандартной молярной энтропии в химической реакции определяется уравнением:
Для химической реакции изменение энтропии аналогично изменению энтальпии
Понятие об энергии Гиббса и ее изменение как мера реакционной способности. Критерий самопроизвольности процессов. Энтальпийный и энтропийный факторы процессов. Стандартная энергия Гиббса. Для того чтобы учесть действие обоих факторов в термодинамике используется функция состояния системы - энергия Гиббса (G). Она применяется для изобарно-изотермических условий и связана с энтальпией и энтропией простым соотношением: G = H - TS. Изменение энергии Гиббса в ходе химической реакции: ∆ G = ∆H - T∆S Характер этого изменения позволяет судить о принципиальной возможности или невозможности осуществления процесса. При постоянных давлении и температуре самопроизвольно протекают только такие химические реакции, которые сопровождаются уменьшением энергии Гиббса. Иными словами, ∆ G < 0 (т.е. энергия Гиббса системы в исходном состоянии больше, чем в конечном) свидетельствует о возможности самопроизвольного осуществления реакции. Если же ∆ G > 0, то процесс не может идти в данных условиях. Под стандартной энергией Гиббса образования понимают изменение энергии Гиббса при реакции образования 1 моль данного соединения из простых веществ. Подобно энтальпии и энтропии: стандартное изменение энергии Гиббса в ходе химической реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ.
Скорость химически реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость реакции. Закон действия масс. Константа скорости реакции. Зависимость скорости и константы скорости реакции от температуры. Правило Вант-Гоффа, уравнение Аррениуса. Понятие об активированном комплексе.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Средняя скорость реакции равна:
где с2 и с1 - концентрации исходных веществ в моменты времени t2 и t1. Знак минус «-» в этом выражении ставится при нахождении скорости через изменение концентрации реагентов. концентрации продуктов со временем нарастают, и в этом случае используется знак плюс «+». Скорость реакции в данный момент времени или мгновенная (истинная)скорость реакции v равна:
Гомогенные реакций – реакции, которые идут в какой-нибудь одной фазе – газовой или жидкой. Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. Факторы, влияющие на скорость химической реакции: природа реагирующих веществ, концентрация реагентов, температура, наличие катализатора. Еще в XIX веке голландский физико-химик Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
Здесь γ (греческая буква «гамма») - так называемый температурный коэффициент или коэффициент Вант-Гоффа, kt и kt+10 – константы скорости реакции при температурах t и (t + 10) оС. Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Здесь k – константа скорости, e равное приблизительно 2, R – газовая постоянная, T – абсолютная температура в Кельвинах, Ea – энергия активации,А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Если левую и правую части уравнения Аррениуса разделить на постоянную А и записать число e его приближенным численным значением, то уравнение примет вид:
Активированный комплекс, группировка атомов в решающий момент элементарного акта химической реакции. Понятием об активированном комплексе широко пользуются в теории скоростей химических реакций.
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 395; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.67.26 (0.006 с.) |