
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа №1. Выделение простых и сложных белков из пищевого сырья и их фракционированиеСтр 1 из 13Следующая ⇒
ПИЩЕВАЯ ХИМИЯ Методические указания по выполнению лабораторных работ
Дисциплина – «Пищевая химия» Специальности – 260202 «Технология хлеба, кондитерских и макаронных изделий» 260201 «Технология хранения и переработки зерна»
Орел 2008
Автор: к.б.н., доцент каф. «Технологии хлебопекарного, кондитерского и макаронного производств» Е.А. Кузнецова
Рецензент: к.т.н., доцент каф. «Технологии хлебопекарного, кондитерского и макаронного производств» Н.А. Березина
Настоящие методические указания по выполнению лабораторных работ по «Пищевой химии» предназначен для выполнения лабораторных работ по дисциплине «Пищевая химия» студентами специальностей 270300 «Технология хлеба, кондитерских и макаронных изделий» очной формы обучения и 260201 «Технология хранения и переработки зерна». Методические указания по выполнению лабораторных работ содержит теоретический материал, задания к лабораторным работам, контрольные вопросы, список литературы.
© ОрелГТУ, 2008 © Кузнецова Е.А., 2008
Содержание
Лабораторная работа №1. Выделение простых и сложных белков из биологического материала и их фракционирование…………………………………..….4 Лабораторная работа №2.Определение количества сахаров в сырье и продуктах растительного происхождения……………………………………………15 Лабораторная работа №3. Определение изменения перекисного числа и содержания изомеров кислот с сопряженными связями в пищевых продуктах в процессе технологической обработки………………………………………………….22 Лабораторная работа №4. Влияние температуры и рН среды на активность α-амилазы………………………...………………………..28 Лабораторная работа №5.Влияние продуктов жизнедеятельности дрожжей на клейковину и растворимость белков муки……………………………32 Лабораторная работа №6. Изучение перевариваемости белков хлеба методом Ансона…… …..…………………38 Лабораторная работа №7. Определение содержа- ния витаминов в растительном сырье при его переработке………………………………………………. 40 Литература………………………………………………….49
Лабораторная работа №1. Выделение простых и сложных белков из пищевого сырья и их фракционирование
1.1 Цель работы: освоить методики выделения и фракционирования белковых веществ из пищевого сырья.
Общие сведения Белки – необходимая составная часть продуктов питания. Отсутствие или недостаточное их количество в пище вызывает серьезные заболевания человека. Пищевая ценность белков зависит от их аминокислотного состава, от содержания в них незаменимых аминокислот, которые не синтезируются в организме человека. Потребляемые человеком в пищу белки можно разделить на полноценные, содержащие все незаменимые аминокислоты, и неполноценные, в которых отсутствует одна или несколько незаменимых аминокислот. Например, казеин – основной белок молока – является полноценным, в то время как желатин – белок, получаемый из костей и сухожилий (продукт частичного гидролиза коллагена), - неполноценным. Белки входят в состав практически всех продуктов животного и растительного происхождения. Белки являются высокомолекулярными биологическими полимерами, построенными из остатков аминокислот. В зависимости от формы молекулы белки делят на глобулярные и фибриллярные. Молекулы глобулярных белков состоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных, а часто и ковалентных связей в компактную частицу, называемую глобулой. Они имеют шарообразную или веретенообразную форму. Подавляющее большинство природных белков относится к глобулярному типу. Они растворимы в воде и в солевых растворах и выполняют в организме динамические функции (гемоглобин крови, сывороточный альбумин, ферменты, антитела, гормоны и другие). Фибриллярные белки состоят из вытянутых или спирализованных полипептидных цепей, расположенных параллельно и удерживаемых за счет многочисленных нековалентных, а иногда и ковалентных связей. Полипептидные цепи объединены в волокна (фибриллы). Эти белки в большинстве своем нерастворимы в воде и выполняют функцию структурных элементов (кератин волос, коллаген кожи, эластин связок, фиброин шелка и другие). Между глобулярными и фибриллярными белками существуют различные переходные формы.
По способу свертывания и ассоциации полипептидных цепей, согласно представлениям К.У. Линденштрема-Ланга, выделяют четыре уровня пространственной структуры белка: первичная, вторичная, третичная и чеивертичная. Эти уровни соответственно означают: линейную последовательность аминокислот; упорядоченное строение основной цепи полипептида; трехмерную структуру белков глобулы и структуры белковых агрегатов. У глобулярных белков выделяют еще два дополнительных уровня: сверхвторичную структуру, которая характеризует энергетически предпочтительные агрегаты вторичной структуры, и домены – части белковой глобулы, представляющие собой достаточно обособленные глобулярные области. Организация высших структур полностью закодирована в аминокислотной последовательности. Совокупность уровней организации называют конформацией белковой молекулы. Белки делят на простые (протеины) и сложные (протеиды). Продуктами гидролиза протеинов являются только аминокислоты. К ним относятся альбумины, глобулины, гистоны, проламины, протамины, глутелины. В состав продуктов гидролиза протеидов входят не только аминокислоты, но и небелковые вещества разнообразные по составу (простетические группы). Важнейшее свойство белков – их способность к денатурации (изменению природной пространственной структуры) под действием различных факторов внешней среды. Степень денатурации белка может быть различной в зависимости от характера белка, природы денатурирующего агента и времени его действия. Различают обратимую и необратимую денатурацию. Основные признаки денатурации – это снижение растворимости, потеря биологической активности, изменение оптических свойств, вязкости и другие. В процессе приготовления пищи белки, входящие в состав пищевых продуктов, денатурируются. Такие белки легче подвергаются действию ферментов пищеварительного тракта, и поэтому лучше и быстрее усваиваются организмом. Целый ряд технологических процессов получения пищевых продуктов (выпечки хлеба, производство макарон и другие) связан с частичной денатурацией белков, входящих в состав сырья. Выделение белков из пищевого сырья начинается из извлечения их соответствующим растворителем (экстракция). Каждый белок обладает определенной растворимостью, зависящей от природы самого белка и состава растворителя. На растворимость существенное влияние оказывает рН среды. Присутствие солей в растворе может либо увеличить, либо уменьшить растворимость того или иного белка. Из полученных экстрактов белки осаждают органическими растворителями, смешивающимися с водой. С этой целью обычно используют метанол, этанол, бутанол, глицерин и ацетон. Кроме того, применяют прием высаливания. Практическая часть
Методика выполнения работы В пробирку прилить 2-3 мл раствора яичного белка и равный объем насыщенного раствора сульфата аммония. Содержимое пробирки тщательно перемешать и оставить на 10 минут. Выпадает хлопьевидный осадок глобулина. Осадку дают отстояться, после чего отфильтровать. К фильтрату добавить кристаллический сульфат аммония на кончике шпателя до насыщения; выпадает хлопьевидный осадок альбуминов. Осадок отцентрифугировать в течение 5 минут при 3000 оборотах в минуту. С фильтратом провести биуретовую реакцию. Отрицательная реакция указывает на отсутствие белков в фильтрате и полноту осаждения. Осадок альбуминов из центрифужной пробирки перенести в пробирку и растворить в 2-3 мл воды. Раствор альбуминов отфильтровать и провести с ним биуретовую реакцию.
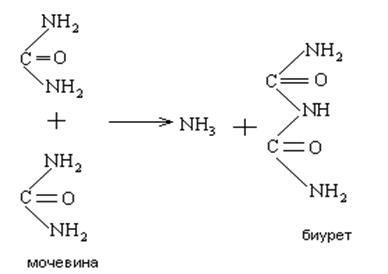
Свое название биуретовая реакция получила от производного мочевины – биурета, который дает эту реакцию. Биурет образуется при нагревании мочевины с отщеплением от нее аммиака:
В присутствии солей меди в щелочной среде белки дают фиолетовое окрашивание. Окраску дает комплексное соединение меди с пептидными группами -CO – NH-. Цвет комплекса, получаемый при биуретовой реакции с разными пептидами, зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий. В пробирку с фильтратом налить 1 мл раствора едкого натра и 1-2 капли раствора сернокислой меди. При взбалтывании в случае присутствия белков появляется фиолетовое окрашивание.
Оформление результатов опыта Полученные результаты записывают в таблицу 1. Таблица 1
Методика выполнения работы В 2 пробирки поместить по 1 г гороховой и соевой муки, прилить 10 мл 10 % раствора хлорида натрия и тщательно перемешать. Извлечение глобулинов проводится при температуре 350С в течение 30 минут в термостате. Через 30 минут жидкость отфильтровывают и с частью раствора проводят биуретовую реакцию.
Оформление результатов опыта Полученные результаты записывают в таблицу 2. Таблица 2
Методика выполнения работы В стакан емкостью 100 мл налить 20 мл молока и прилить равный объем дистиллированной воды. К этой смесим осторожно, по стеклянной палочке прилить 10% раствор уксусной кислоты до рН 4,6 (2-3 мл уксусной кислоты), рН раствора определить с помощью универсального индикатора. Для этого стеклянной палочкой наносят каплю на универсальную индикаторную бумагу и по шкале определить рН. При рН 4,6 казеин выпадает в осадок. Ему дают отстояться 10 минут. Слить без взбалтывания надосадочную жидкость. В оставшийся осадок добавить по каплям 10% раствор гидроксида натрия до растворения осадка. Полученный раствор отфильтровать через влажный фильтр. С фильтратом провести цветные реакции (биуретовую и ксантопротеиновую).
Подавляющее большинство белков и пептидов при нагревании с крепкой азотной кислотой дает желтое окрашивание, переходящее в оранжевое при добавлении щелочи или аммиака. Эта реакция характерна для бензольного ядра циклических аминокислот. При действии крепкой азотной кислоты на эти аминокислоты происходит нитрование бензольного кольца с образованием нитросоединений желтого цвета. В пробирку с фильтратом прилить 5-6 капель концентрированной азотной кислоты. Появляется осадок свернувшегося белка, который при осторожном нагревании окрашивается в желтый цвет. Дать пробирке охладиться и осторожно прибавить концентрированный аммиак.
Оформление результатов опыта Полученные результаты записывают в таблицу 3. Таблица 3
1.3.4 Опыт 4. Колориметрический метод определения содержания доступного лизина Метод основан на взаимодействии между отрицательно заряженными группами кислого красителя и положительно заряженными группами аминокислот, содержащими азот основных аминокислот – лизина, гистидина и аргинина с образованием нерастворимого комплекса «белок – краситель». В одном из двух параллельных определений предварительно проводят блокирование свободных ε-аминогрупп лизина пропионовым ангидридом. После удаления нерастворимого комплекса по оптической плотности раствора, используя градуировочный график, определяют количество непрореагировавшего красителя и расчетным путем устанавливают содержание доступного лизина в продукте. Приборы реактивы: колбы конические на 250 мл; лабораторный встряхиватель; стеклянные фильтры; пипетки Мора на 1мл; мерные цилиндры на 100 мл; спектрофотометр, работающий в области спектра, включающей длину волны 475 нм; краситель «Оранж Ж»; пропионовый ангидрид; кислота лимонная. Подготовка к анализу Методика выполнения работы Приготовить 2 пробы А и Б. Навески исследуемого продукта взять из расчета, что проба А должна содержать около 15 мг гистидин + аргинин + лизин, проба Б – 15 мг гистидин + аргинина (расчет провести, исходя из содержания белка в продукте и его аминокислотного состава). Навески продукта поместить в коническую колбу на 250 мл, прилить в каждую колбу по 6 мл дистиллированной воды и оставить на 10 минут. В колбу Б внести 0,4 мл пропионового ангидрида и помещают на лабораторный встряхиватель на 15 минут. Далее обработку проб А и Б проводят одновременно. В обе колбы добавить по 40 мл раствора красителя, встряхивать в течение 90 минут. Содержимое колб отфильтровать через стеклянные фильтры, отобрать пипеткой по 1 мл каждого фильтрата и внести в мерные цилиндры. Довести объем в цилиндрах до 75 мл дистиллированной водой и тщательно перемешать. Полученные растворы проб А и Б колориметрировать на спектрофотометре, при тех же условиях, что стандартные растворы для построения градуировочного графика. Для последующей обработки результатов используют только данные, находящиеся в приделах от 0,2 до 0,3 единицы оптической плотности, при этом разность между показателями А и Б не должна превышать 0,05 единицы оптической плотности.
На основании полученных для обеих проб величин оптической плотности по градуировочному графику устанавливают количество несвязанного красителя в ммолях (СА и СБ). Массовую долю доступного лизина (х) в мг/100г продукта вычислить по формуле: Х= С – исходное содержание красителя в рабочем растворе (С = 0,0784 ммоль) СА – содержание несвязанного красителя в пробе А, ммоль; СБ – содержание несвязанного красителя в пробе Б, ммоль;
М – молекулярная масса лизина, (М=146,19); 2 – коэффициент, учитывающий, что 1 молекула «Оранж Ж» связывает 2 молекулы лизина. Оформление результатов опыта Полученные результаты записываются в таблицу 4.
Таблица 4
1.4 Контрольные вопросы 1. Какие белки легче высаливаются – альбумины и глобулины? 2. В некоторых случаях перед высаливанием белков их приводят в состояние изоэлектрической точки. Зачем это делают? 3. Каков механизм образования гидрофильной оболочки белков? 4. Чем отличается денатурация от высаливания?
Литература [1, с.77-100]; [2].
Общие сведения В ряде пищевых продуктов содержится значительное количество углеводов. В естественных пищевых продуктах углеводы представлены в виде моно-, ди- и полисахаридов. К моносахаридам относятся глюкоза, фруктоза и галактоза. К дисахаридам – сахароза, лактоза, мальтоза, целлобиоза. Полисахариды представлены крахмалом, гликогеном, клетчаткой, пектиновыми веществами. Дисахариды и полисахариды распадаются под действием соответствующих ферментов в кишечнике до моносахаридов, всасываются в кровь и по воротной вене поступают в печень, где из глюкозы синтезируется гликоген. Содержание сахара в крови находится в пределах 0,8 – 1,2 г/л. Этот уровень поддерживается регулирующим влиянием центральной нервной системы и железами внутренней секреции. Источником сахара крови является гликоген печени. В ней он превращается в фосфорное соединение, из которого в результате метаболизма в кровь выделяется глюкоза, разносится по всем органам и тканям, где используется для энергетических нужд. При очень больших затратах энергии использование сахара в крови происходит быстрее, чем превращение гликогена в глюкозу в печени. В результате уровень сахара в крови понижается, наступает гипогликемия. Длительный недостаток сахара в крови приводит к сахарному голоданию мозговой ткани, в результате чего может наступить невротический синдром. Противоположное явление наблюдается после приема пищи, богатой сахаром, - алиментарная гепергликемия. Источником глюкозы являются плоды, фрукты, ягоды, мед. Источником дисахаридов является сахарная свекла и морковь. При гидролизе сахара органическими кислотами образуется инвертный сахар, обладающий гигроскопичностью благодаря присутствию фруктозы. При высокой температуре сахароза полимеризуется и образуется карамель или «жженый» сахар. Наибольшее пищевое значение имеют крахмал и сахароза, т.к. они хорошо усваиваются организмом. Крахмал усваивается медленнее, чем сахар и не создает гипергликемии. Сахар и моносахариды усваиваются чрезвычайно быстро.
Практическая часть
Методика выполнения работы В качестве объекта для исследования берут свежие растительное сырье и продукт, полученный из этого сырья в результате тепловой обработки. Объект для исследования (яблоки свежие и яблочное пюре; картофель свежий и вареный) измельчить, взять навеску 10 г и количественно перенести ее в мерную колбу на 500 мл. Добавить 400 мл дистиллированной воды. Экстракцию сахаров провести на водяной бане при температуре 70-75оС в течение 1 ч. По истечении 1 ч экстракт охладить до 20ОС, довести до метки дистиллированной водой и отфильтровать через бумажный фильтр. Фильтрат используют для анализа. Взять 5 мл фильтрата пипеткой и поместить в коническую колбу на 100 мл. Добавить 15 мл дистиллированной воды и 10 мл раствора железосинеродистого калия и в течение 20 минут нагревать этот раствор на кипящей водяной бане. Затем раствор охладить и добавить 10 мл смеси (1:1) растворов сернокислого цинка и йодистого калия, 10 мл раствора уксусной кислоты и 2-3 капли раствора крахмала. Провести титрование образовавшегося йода тиосульфатом до обесцвечивания раствора. Одновременно ставят контрольный опыт, в котором вместо исследуемого фильтрата берут 20 мл дистиллированной воды. По таблице 5 находят количество редуцирующих сахаров.
Массовую долю редуцирующих веществ в растительном сырье (Рв, %) находят по формуле:
А – количество редуцирующих веществ, найденные по таблице 7, мг;
Таблица 5
Оформление результатов опыта Полученные результаты записывают в таблицу 6. Таблица 6.
Методика выполнения работы В 2 колбы на 100 мл внести по 10 мл раствора йода. В одну из колб (опытный вариант) добавить 20 мл экстракта, приготовленного в опыте 2.3.1.1, в другую колбу (контрольный вариант) прилить 20 мл дистиллированной воды. Затем медленно добавить 15 мл раствора гидроксида натрия и оставить стоять при комнатной температуре 15 минут. После этого раствор подкислить 20 мл раствора серной кислоты и остаток йода оттитровать раствором тиосульфата натрия в присутствии растворимого крахмала (3 капли). Массовую концентрацию глюкозы в растительном сырье (г, %) рассчитать по формуле: Г =
Оформление результатов опыта Полученные результаты записывают в таблицу 7.
Таблица 7.
Методика выполнения работы Отобрать 50 мл экстракта пипеткой в мерную колбу на 100 мл, добавить 5 мл раствора соляной кислоты, поместить в кипящую водяную баню на 30 минут для инверсии сахарозы. Затем колбу охладить, добавить до метки раствор гидроксида натрия, перемешать и в 10 мл гидролизата определить редуцирующие сахара по Иссекутцу. Массовую долю сахарозы (С, %) в растительном сырье найти по формуле: С = (х – Рв) 0,95, где х, Рв – массовая доля редуцирующих сахаров в экстракте после и до инверсии, %; 0,95 – коэффициент пересчета редуцирующих веществ на сахарозу. Пример расчета. При определении Рв в экстракте методом Иссекутца на титрование контроля и опыта пошло соответственно 9,5 и 3,4 мл тиосульфата. Остаток не вошедшего в реакцию с сахарами железосинеродистого калия определяют по пропорции: 10:9,5 = х:3,4 х = 3,58 мл Объем К3Fe(СN)6, пошедший на реакцию с редуцирующими сахарами, составляет 10 – 3,58 = 6,42 мл По таблице 7 находят количество редуцирующих сахаров: 6,40 мл – 10,41 мг 0,02 мл – 0,03 мг 6,42 мл – 10,44 мг Рв Тогда массовая доля Рв в растительном сырье составит: Рв = По методу Вильштеттера и Шудля на титрование контроля и опыта пошло соответственно 10,0 и 8,0 мл тиосульфата натрия. Вычисляем массовую долю глюкозы в растительном материале по формуле: Г = Массовая доля фруктозы (Ф, %) в растительном сырье равна: Ф = Рв – Г В нашем примере это составит: Ф = 10,44 – 4,5 = 5,94 % Для определения количества редуцирующих сахаров в экстракте после инверсии известно, что на титрование контроля и опыта пошло соответственно 9,5 и 2,8 мл. Остаток железосинеродистого калия составляет х = 2,94 мл; пошедшего на реакцию с сахарами: 10 – 2,94 = 7,06 мл По таблице 7 находим количество редуцирующих сахаров – 11,57 мг. Следовательно, массовая доля их в экстракте после инверсии составляет: х = Массовая доля сахарозы в растительном сырье равна: С = (11,57 – 10,44) 0,95=1,07 % Оформление результатов опыта Полученные результаты записывают в таблицу 8. Таблица 8
2.4 Контрольные вопросы 1. Какие сахара называют редуцирующими? 2. На чем основан метод Иссекутца? Какие сахара можно определить этим методом? 3. Каким методом можно определить глюкозу в присутствии других сахаров? 4. Почему для определения сахарозы проводят инверсию? 5. Что такое инверсия сахарозы? Как проводят инверсию сахарозы? 6. Расскажите схему дифференцируемого определения сахаров в растительном сырье. 7. Отличается ли содержание редуцирующих сахаров в сырье и готовом продукте? Чем объяснить различие? Литература [1, с.255-281]; [2]
Общие сведения Липиды широко распространены в природе и вместе с белками и углеводами составляют основную массу органических веществ всех живых организмов. Они широко используются при получении многих продуктов питания, являются важными компонентами пищевого сырья и готовых продуктов, во многом определяя их пищевую ценность и вкусовые качества. Липиды нерастворимы в воде, но хорошо растворимы в органических растворителях (бензине, хлороформе, диэтиловом эфире и др.) По химическому строению липиды являются производными жирных кислот, спиртов, альдегидов. Наиболее важная и распространенная группа липидов – ацилглицерины или жиры. В маслах и жирах, выделенных из различных объектов, содержатся насыщенные и ненасыщенные углеводороды С10-С40 различного строения. В питании большое значение имеет химический состав употребляемых жиров, особенно содержание полиненасыщенных кислот с определенным положением двойных связей и цис-конфигурацией (линолевой С218, линоленовой С318, олеиновой С118, арахидоновой С420, полиненасыщенных жирных кислот семейства омега-3). Наиболее важные источники жиров в питании - растительные масла (в рафинированных маслах 99,7-99,8% жира), сливочное масло (61,5-82,5% липидов), маргарин (до 82,0% жира), молочные продукты (3,5-30% жира), сыры (25-50% жира), шоколад (35-40%) Жиры нестойки при хранении. Они являются наиболее лабильными компонентами пищевого сырья и готовых пищевых продуктов. Главными направлениями превращения липидов при хранении являются гидролиз, окислительное и биохимическое прогоркание. Приборы и реактивы: терки; ножи; разделочные доски; сковороды; весы лабораторные; электроплитка; баня водяная; мерные пипетки на 1-2 мл; мерные цилиндры на 10 мл; конические колбы с притертой пробкой; фотоэлектрокалориметр (спектрофотометр); гексан; хлороформ; ледяная уксусная кислота; насыщенный раствор йодистого калия; 1%-ный раствор крахмала; 0,01н. раствор тиосульфата натрия. Практическая часть 3.3.1 Приготовление образцов для проведения анализа. Картофель измельчить ножом, морковь измельчить на терке, взять навеску 50 г, залить 150 г подсолнечного масла. Поместить на сковороду и проводить обжаривание овощей в течение 40 – 60 минут, периодически помешивая. Через каждые 20 минут производить отбор проб растительного масла по 5 мл. Методика выполнения работы Для определения содержания диеновых (с двумя сопряженными связями) и триеновых (с тремя сопряженными связями) соединений 0,1 г пробы растительного масла растворяют в небольшом количестве гексана и разводят до концентрации 1 г/100мл. Затем проводят определение оптической плотности раствора на фотоэлектрокалориметре со светофильтрами, дающими длины волн 230 нм и 268 нм. Оформление результатов Полученные результаты записать в таблицу 9. Таблица 9.
Содержание соединений диеновых в пересчете на трансизолинолевую кислоту, и триеновых в пересчете на трансизолинолевую кислоту вычисляют в % по формуле:
Где D - оптическая плотность испытуемого раствора (среднее из двух параллельных определений) ед. прибора; C – концентрация раствора, г/л; 119 и 209,5 – средние значения коэффициента поглощения трансизолинолевой кислоты при длинах волн 230 нм и 268 нм соответственно. K – коэффициент пересчета, равный 58.
Методика выполнения работы В коническую колбу с притертой пробкой вносят навеску жира 0,8 г, взятую с точностью до 0,0001 г. Жир расплавляют на водяной бане и по стенке колбы, смывая следы жира. Вливают из мерного цилиндра 10 мл хлороформа для растворения жира, 10 мл ледяной уксусной кислоты, 0,5 мл насыщенного свежеприготовленного раствора KI. Закрывают пробкой колбу, перемешивают содержимое и ставят в темное место на 5 минуты. Затем вливают 100 мл дистиллированной воды, в которую заранее добавляют 1 мл 1%-ного раствора крахмала. Титруют полученную смесь 0,01н. раствором тиосульфата натрия до исчезновения синей окраски. Для проверки чистоты KI проводят контрольное определение (без жира) и, в случае выделения йода, последний титруют тиосульфатом натрия. Реактив пригоден, если на титровангие идет не более 0,07 мл 0,01н. раствора тиосульфата. Оформление результатов Полученные результаты записать в таблицу.
Таблица 10.
Перекисное число жира определяют по формуле: ПЧ =
0,00127 – количество граммов йода, эквивалентное 1 мл 0,01н. раствора тиосульфата натрия. Степень окислительной порчи в зависимости от перекисного числа определяют согласно ГОСТ 8285-91.
2.4 Контрольные вопросы 1. Какие соединения относятся к витамину С? 2. Какое влияние оказывает технологическая обработка сырья на сохранность витаминов в готовом продукте? 3. Приведите схему окисления аскорбиновой кислоты в присутствии кислорода воздуха 4. Какие факторы активируют процесс окисления аскорбиновой кислоты? 5. Назовите заболевания человека, возникающие при недостатке ил отсутствии в пище тех или иных витаминов 6. Как проводится витаминизация продуктов на предприятиях пищевой промышленности?
Литература [1, с.241, 266, 316]; [2, с.235-250]; [4, с.128-182].
Лабораторная работа №4. Влияние температуры и рН среды на активность α-амилазы
4.1 Цель работы: изучение некоторых свойств фермента α-амилазы. Общие сведения Ферменты – биологические катализаторы белковой природы. Они значительно повышают скорость химических реакций, которые в отсутствие ферментов протекают очень медленно. Фермент α-амилаза был открыт Кирхгофом в 1814 году. Он относится к классу гидролаз, подклассу гликозидаз. Этот фермент содержится в организме животных и человека (в слюне, соке поджелудочной железы), продуцируется плесневыми грибами и многими видами бактерий, содержится в солоде (проросшем зерне) пшеницы, ячменя, ржи, проса. α-амилаза катализирует гидролиз в молекуле крахмала, гликогена и родственных полисахаридов глубинных α-1-4-гликозидных связей без определенного порядка. При этом в качестве продуктов гидролиза образуются декстрины и небольшое количество мальтозы, в связи с этим α-амилазу называют ферментом декстринирующего действия. Ферментативные превращения крахмала лежат в основе многих пищевых технологий, в том числе в основе хлебопечения. Скорость гидролиза под действием ά-амилазы зависит от состояния крахмала (нативный или клейстеризованный крахмал), от фракционного состава крахмальных гранул (отношение мелких и крупных зерен, содержание поврежденных зерен), а также от от эффективности фермента. Характерная особенность всех ά-амилаз – наличие одного атома Са на молекулу фермента. Роль кальция заключается в том, что он стабилизирует вторичную и третичную структуру молекулы ά-амилазы, обеспечивая ее каталитическую активность и предохраняя ее от действия протеолитических ферментов и тепловой денатурации. Большое практическое значение имеет влияние температуры и рН среды на стабильность амилаз. Быстрое разрушение зерновой ά-амилазы при рН 3,3-4,0 дает возможность выпекать ржаной хлеб из муки, которая содержит избыток ά-амилаз, при низких значениях рН, чтобы предотвратить излишнее декстринирование крахмала и образование клейких веществ в мякише хлеба. Приборы и реактивы: конические колбы на 100 мл; водяная баня, термометр; фильтр; пипетка Мора на 20 мл; пробирки; солод; ферментный препарат α-амилазы; 2 % раствор крахмала; 1 м раствор уксусной кислоты; 1 м раствор уксуснокислого натрия; 1/15 м раствор Na2HPO4; 1/15 м раствор КН2РО4; 0,1 м раствор йода.
Практическая часть Метод определения активности α-амилазы основан на качественной реакции продуктов гидролиза – декстринов – с раствором йода. В результате гидролиза интенсивная синяя окраска крахмала с йодом переходит в винно-красную.
4.3.1 Приготовление препаратов α-амилазы Для приготовления солодовой вытяжки к 4 г тонко измельченного солода прибавить 100 мл дистиллированной воды и экстрагировать в течение 1 часа при 30оС. Затем суспензию отфильтровать через складчатый фильтр, возвращая обратно на фильтр первые порции мутного фильтрата. Прозрачный фильтрат используют как источник ферментов. При использовании ферментного препарата взять навеску 100 мг и растворить в 100 мл дистиллированной воды.
Методика выполнения работы В колбу на 100 мл внести пипеткой 20 мл раствора крахмала и 8 мл буферных растворов для создания определенного значения рН. Количество вносимых буферов приведено в таблице 11.
Таблица 11. Количество вносимых буферов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 898; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.39.23 (0.203 с.) |
 , где
, где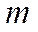 А – масса навески в пробе А, г;
А – масса навески в пробе А, г; - масса навески в пробе Б, г;
- масса навески в пробе Б, г; , где
, где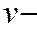 объем, в котором растворена навеска сырья (500 мл);
объем, в котором растворена навеска сырья (500 мл); навеска, мг;
навеска, мг; объем экстракта, взятый для определения, мл
объем экстракта, взятый для определения, мл мг
мг
 , мл
, мл
 ,мл
,мл
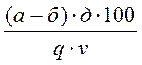 ,
, - объемы раствора тиосульфата натрия, пошедшие на титрование, соответственно контроля и опыта, мл;
- объемы раствора тиосульфата натрия, пошедшие на титрование, соответственно контроля и опыта, мл;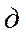 - масса глюкозы, мг, эквивалентная 1 мл раствора йода;
- масса глюкозы, мг, эквивалентная 1 мл раствора йода;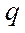 - навеска сырья (мг) в 1 мл экстракта;
- навеска сырья (мг) в 1 мл экстракта; - объем экстракта, взятый для определения, мл.
- объем экстракта, взятый для определения, мл. , мл
, мл
 , мл
, мл
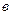 , мл
, мл
 ,
,

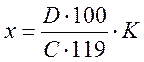 ;
; 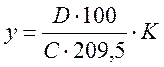
 ,
,


