
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Определение перекисного числа масла.
Метод состоит в том, что в результате действия перекисей на KI, выделяется йод, который оттитровывается тиосульфатом натрия. Реакцию проводят в кислой среде, используя уксусную кислоту (как устойчивую к окислению) и водный раствор KI. При этом образуется HI, реагирующая с перекисями, и выделяется свободный йод.
KI+ CH3COOH → HI + CH3COOK CH3(CH2)6CHOOH-CH=CH(CH2)7COOH+ HI→ гидроперекись олеиновой кислоты CH3(CH2)6CHOH-CH=CH(CH2)7COOH+I2+H2O Выделившийся йод оттитровывают тиосульфатом натрия в присутствии крахмала.
I2+2Na2S2O3→2NaI+Na2S4O6
Методика выполнения работы В коническую колбу с притертой пробкой вносят навеску жира 0,8 г, взятую с точностью до 0,0001 г. Жир расплавляют на водяной бане и по стенке колбы, смывая следы жира. Вливают из мерного цилиндра 10 мл хлороформа для растворения жира, 10 мл ледяной уксусной кислоты, 0,5 мл насыщенного свежеприготовленного раствора KI. Закрывают пробкой колбу, перемешивают содержимое и ставят в темное место на 5 минуты. Затем вливают 100 мл дистиллированной воды, в которую заранее добавляют 1 мл 1%-ного раствора крахмала. Титруют полученную смесь 0,01н. раствором тиосульфата натрия до исчезновения синей окраски. Для проверки чистоты KI проводят контрольное определение (без жира) и, в случае выделения йода, последний титруют тиосульфатом натрия. Реактив пригоден, если на титровангие идет не более 0,07 мл 0,01н. раствора тиосульфата. Оформление результатов Полученные результаты записать в таблицу.
Таблица 10.
Перекисное число жира определяют по формуле: ПЧ =
0,00127 – количество граммов йода, эквивалентное 1 мл 0,01н. раствора тиосульфата натрия. Степень окислительной порчи в зависимости от перекисного числа определяют согласно ГОСТ 8285-91.
2.4 Контрольные вопросы 1. Какие соединения относятся к витамину С? 2. Какое влияние оказывает технологическая обработка сырья на сохранность витаминов в готовом продукте? 3. Приведите схему окисления аскорбиновой кислоты в присутствии кислорода воздуха
4. Какие факторы активируют процесс окисления аскорбиновой кислоты? 5. Назовите заболевания человека, возникающие при недостатке ил отсутствии в пище тех или иных витаминов 6. Как проводится витаминизация продуктов на предприятиях пищевой промышленности?
Литература [1, с.241, 266, 316]; [2, с.235-250]; [4, с.128-182].
Лабораторная работа №4. Влияние температуры и рН среды на активность α-амилазы
4.1 Цель работы: изучение некоторых свойств фермента α-амилазы. Общие сведения Ферменты – биологические катализаторы белковой природы. Они значительно повышают скорость химических реакций, которые в отсутствие ферментов протекают очень медленно. Фермент α-амилаза был открыт Кирхгофом в 1814 году. Он относится к классу гидролаз, подклассу гликозидаз. Этот фермент содержится в организме животных и человека (в слюне, соке поджелудочной железы), продуцируется плесневыми грибами и многими видами бактерий, содержится в солоде (проросшем зерне) пшеницы, ячменя, ржи, проса. α-амилаза катализирует гидролиз в молекуле крахмала, гликогена и родственных полисахаридов глубинных α-1-4-гликозидных связей без определенного порядка. При этом в качестве продуктов гидролиза образуются декстрины и небольшое количество мальтозы, в связи с этим α-амилазу называют ферментом декстринирующего действия. Ферментативные превращения крахмала лежат в основе многих пищевых технологий, в том числе в основе хлебопечения. Скорость гидролиза под действием ά-амилазы зависит от состояния крахмала (нативный или клейстеризованный крахмал), от фракционного состава крахмальных гранул (отношение мелких и крупных зерен, содержание поврежденных зерен), а также от от эффективности фермента. Характерная особенность всех ά-амилаз – наличие одного атома Са на молекулу фермента. Роль кальция заключается в том, что он стабилизирует вторичную и третичную структуру молекулы ά-амилазы, обеспечивая ее каталитическую активность и предохраняя ее от действия протеолитических ферментов и тепловой денатурации. Большое практическое значение имеет влияние температуры и рН среды на стабильность амилаз. Быстрое разрушение зерновой ά-амилазы при рН 3,3-4,0 дает возможность выпекать ржаной хлеб из муки, которая содержит избыток ά-амилаз, при низких значениях рН, чтобы предотвратить излишнее декстринирование крахмала и образование клейких веществ в мякише хлеба.
Приборы и реактивы: конические колбы на 100 мл; водяная баня, термометр; фильтр; пипетка Мора на 20 мл; пробирки; солод; ферментный препарат α-амилазы; 2 % раствор крахмала; 1 м раствор уксусной кислоты; 1 м раствор уксуснокислого натрия; 1/15 м раствор Na2HPO4; 1/15 м раствор КН2РО4; 0,1 м раствор йода.
Практическая часть Метод определения активности α-амилазы основан на качественной реакции продуктов гидролиза – декстринов – с раствором йода. В результате гидролиза интенсивная синяя окраска крахмала с йодом переходит в винно-красную.
4.3.1 Приготовление препаратов α-амилазы Для приготовления солодовой вытяжки к 4 г тонко измельченного солода прибавить 100 мл дистиллированной воды и экстрагировать в течение 1 часа при 30оС. Затем суспензию отфильтровать через складчатый фильтр, возвращая обратно на фильтр первые порции мутного фильтрата. Прозрачный фильтрат используют как источник ферментов. При использовании ферментного препарата взять навеску 100 мг и растворить в 100 мл дистиллированной воды.
Методика выполнения работы В колбу на 100 мл внести пипеткой 20 мл раствора крахмала и 8 мл буферных растворов для создания определенного значения рН. Количество вносимых буферов приведено в таблице 11.
Таблица 11. Количество вносимых буферов
Смесь крахмала с буфером поместить на водяную баню и нагревать при температуре 30о, 40о, 50о в течение 5 – 8 минут. Затем в колбу (не вынимая из бани) добавить 2 мл солодовой вытяжки или раствора фермента. Перемешать. Записать время внесения фермента (начало гидролиза). Через 10, 20, 30, 45 минут отобрать по 1 мл гидролизной смеси, внести ее в пробирку с 5 мл йодного раствора, встряхнуть. Когда проба гидролизата дает винно-красную окраску с йодным раствором, гидролиз закончен. Декстринирующую активность (А, ед/г) определяют по формуле: А = 0,4 – навеска крахмала в 20 мл раствора; 60 – перевод минут в часы;
Пример расчета. В качестве источника фермента α-амилазы был использован солод. Для экстракции была взята навеска 4 г и добавлено 100 мл дистиллированной воды, что соответствует содержанию солода в 1 мл экстракта 0,04 г. Объем экстракта для гидролиза крахмала составил 2 мл. время окончания гидролиза – 20 мин. Следовательно декстринирующая активность солода равна:
Оформление результатов опыта Полученные результаты записывают в таблицу 12. Таблица 12.
4.4 Контрольные вопросы 1. Что является субстратом для α-амилазы и какие связи она гидролизует? 2. Какие продуктом образуются при действии α-амилазы; как это объяснить? Напишите уравнение гидролиза субстрата α-амилаз. 3. Что такое декстрины? 4. Какое значение имеет α-амилаза в технологии хлебопечения, пивоварения, спиртовом производстве? 5. Расскажите о применении α-амилазы в хлебопекарной промышленности.
Литература
[1, с.174-213]; [2]
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 539; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.102.112 (0.015 с.) |
 , мл
, мл
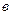 , мл
, мл
 ,
, - объемы раствора тиосульфата натрия, пошедшие на титрование, соответственно опыта и контроля, мл;
- объемы раствора тиосульфата натрия, пошедшие на титрование, соответственно опыта и контроля, мл;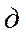 - коэффициент поправки к раствору 0,01н. раствора тиосульфата натрия, равный 1;
- коэффициент поправки к раствору 0,01н. раствора тиосульфата натрия, равный 1;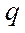 - навеска жира, г;
- навеска жира, г; ; где
; где - объем раствора фермента или экстракта, взятый для гидролиза, мл;
- объем раствора фермента или экстракта, взятый для гидролиза, мл; - время декстринизации, мин;
- время декстринизации, мин; - содержание фермента или солода в 1 мл раствора или экстракта, г.
- содержание фермента или солода в 1 мл раствора или экстракта, г.



