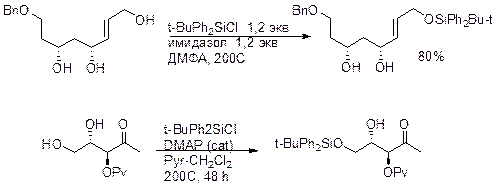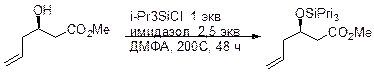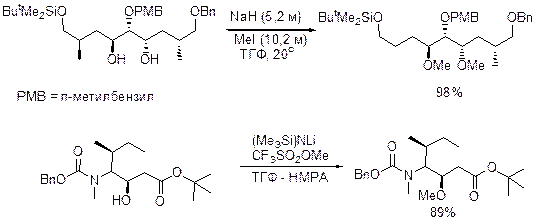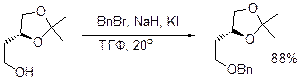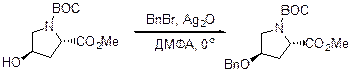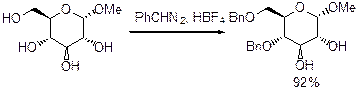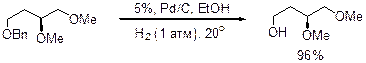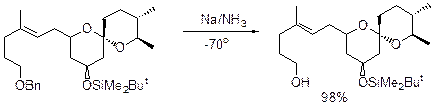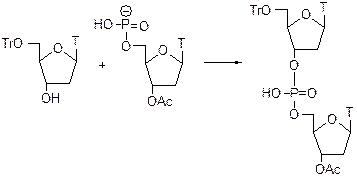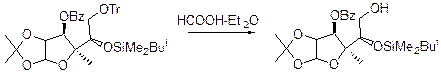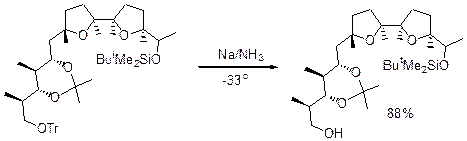Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Третбутилдифенилсилиловые эфиры TBDPS
Впервые использован в 1975 году. Это самая стабильная группа в условиях кислого гидролиза. Она в 100-250 раз более стабильна, чем SiMe2Bu- t и 5-10 раз по сравнению с i- Pr3Si. Однако TBAF расщепляется также как и SiMe2Bu- t.
SiPh2Bu- t группа выдерживает восстановление диизобутиламмоний гидрида, 80% НОАс (в этих условиях отщепляются тритил, TBS), водную CF3COOH в ТГФ, действие каталитических количеств NaOMe в MeOH, Me2BBr в CH2Cl2 при –780С.
Для расщепленияTBDPS эфиров используют те же условия, что и для TBS эфиров: TBAF - THF, HF - MeCN, HF * пиридин - ТГФ, но время для расщепления требуется несравненно больше. Поэтому можно селективно отщепить t- BuМе2Si в присутствии t- BuPh2Si.
Образование. Обычно для получения эфиров используют реакции первичных и вторичных спиртов с t- BuPh2SiCl в CH2Cl2 или ДМФА в присутствии имидазола или диметиламинопиридина. Третичные спирты не силилируются. Эта силильная группа позволяет более селективно силилировать первичную ОН группу.
Триизопропилсилиловые эфиры TIPS i-Pr3Si Высокий стерический объем позволяет высокоизбирательно силилировать первичные ОН группы. Эта защитная группа отличается высокой стабильностью в большом интервале реакционных условий. TIPS более устойчива, чем t- BuМе2Si и t- BuPh2Si (TBS и TBDPS) в условиях щелочного гидролиза и действию сильных нуклеофилов (однако менее стабильна, чем TBDPS) и кислому гидролизу.
Образование. Для введения используют i- Pr3SiCl в ДХМ или ДМФА в присутствии имидазола или диметиламинопиридина. Более быстро идет силилирование i- Pr3SiOSO2CF3 (IPSOTf), который получают из i- Pr3SiН и CF3SO3H с выходом 97%.
Снятие защиты производят TBAF – ТГФ, HF – MeCN, HF * пиридин – ТГФ. В химической практике находят применение и другие защитные группы, что позволяет изменять объем и электронные эффекты R3Si. Примеры: i- PrMe2Si, i- PrEt2S Алкильные защитные группировки – простые эфирные защитные группировки
Метильные, бензильные, п-метоксибензильные и 3,4-диметоксибензильные, тритильные, трет-бутильные, аллильные и аллилокси карбонильные
Из всего указанного многообразия мы рассмотрим метильные, бензильные, тритильные и трет-бутильные эфиры.
Метиловые эфиры Метокси-группа очень стабильная и требует для своего снятия жестких условий.
Получение метиловых эфиров: Для получения метиловых эфиров используются методы, которые вам уже известны. Это различные варианты реакции Вильямсона, в которой спирт реагирует с MeI, (MeO)2SO2 или CF3SO2Me в присутствие подходящих оснований. Для О-метилирования фенолов используют K2CO3 и (MeO)2SO2, для алифатических спиртов NaH, (Me3Si)2NLi.
В качестве метилирующего средства часто используют диазометан в присутствии протонных кислот HBF4 или кислот Льюиса (ZnCl2, BF3, SnCl4).
Бензиловые эфиры – Bn Как и метиловые эфиры – бензиловые стабильны. Они устойчивы в кислых и щелочных условиях, устойчивы к действию гидридов металлов и мягких окислителей. При повышенных температурах и особенно в присутствии кислот Льюиса бензиловые эфира расщепляются LiAlH4. n-BuLi в ТГФ может отщеплять бензильный протон из бензильной группы. s-BuLi и t-BuLi более подходят для таких целей. Получение: Методы получения аналогичны получению метиловых эфиров. Это алкилирование алкоксидов металлов с бензилбромидом или хлоридом. Алкоксиды обычно генерируют NaH и KH, при это часто необходимо действие катализаторов, KI или Bu4NI добавляют, чтобы из бромидов и хлоридов генерировать in situ иодид. В этих условиях даже третичные спирты могут бензилироваться.
Можно использовать BnBr в присутствии Ag2O.
Естественно можно использовать PhCHN2 при -40°С в присутствии HBF4 CH2Cl2.
Расщепление: Каталитическое гидрирование мягкий метод снятия O-Bn защиты. Катализаторы Pd/C в ТГФ, Ni-Ренея. Естественно при таком методе снятия в молекуле не должно быть кратных связей и групп, которые гидрируются и отравляют катализатор.
Можно осуществлять снятие защиты Na или Li в NH3.
Можно использовать кислоты Льюиса в CH2Cl2 или ClCH2CH2Cl и TMSI (SnCl4, BCl3, FeCl3, BF3).
Тритильные группы – Tr Эта защитная группа используется в синтезе нуклеотидов и нуклеозидов.
Получение: Защищает избирательно первичную OH-группу, вторичные и третичные не реагируют. Используют Ph3CCl в пиридине или диметиламинопиридин.
Можно использовать и TrOTf трифлат.
Расщепление: Использются протонные кислоты HCOOH в эфире. В этих условиях сохраняются изопропенилиденовые группы и tBuMe2Si: 80% кипящей уксусной кислоты, 1 М водной HCl в диоксане.
Для расщепления можно использовать кислоты Льюиса ZnBr2 в MeOH, EtAlCl2-CH2Cl2: FeCl3, а также Na в жидком аммиаке.
Третбутиловые эфиры – t-Bu Стабильны в сильно основной среде и атаке алкиллитиевыми соединениями. Расщепляются в сильно кислой среде по E1еханизму с элиминированием изобутилена. Это направление обусловлено стабильностью третбутилкатионы. Аналогичная трансформация имеет место третбутиловых сложных эфиров и N-третбутоксикарбонил (BOC) производных.
Получают действем избытка изобутилена на спирт в CH2Cl2 в присутствии концентрированной серной кислоты.
|
||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 311; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.97.189 (0.012 с.) |