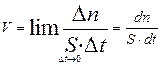Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Направление протекания реакций
Рассмотрим возможность самопроизвольного протекания химической реакции в зависимости от знака энтальпийного и энтропийного членов в выражении изменения свободной энергии. Если изменение свободной энергии меньше нуля, то реакция протекает самопроизвольно (экзоэргоническая реакция). Если ∆G = 0, начальные и конечные состояния могут существовать в равновесии. Если же изменение свободной энергии больше нуля, самопроизвольное протекание реакции невозможно (эндоэргонические реакции). Самопроизвольно протекает обратная реакция. А так как, изменение свободной энергии выражается через изменения энтальпии и энтропии (в предположении, что они не зависят от температуры), то их знаки будут определять знак ∆G. В ниже рассмотренных примерах принимается, что парциальные давления всех газообразных участников реакций равны по одной атмосфере, т.е. ∆Gг=∆G°г. В этом случае можно использовать в расчётах стандартные изменения энтальпии и энтропии. Возможны четыре случая. Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре. Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях. Если ΔH < 0 и ΔS < 0, то реакция возможна при низких температурах: ΔG = ΔH - ΔS∙T< 0, - ΔS∙T< - ΔH, T< ΔH / ΔS Если ΔH > 0 и ΔS > 0, то реакция возможна при высоких температурах: ΔG = ΔH - ΔS∙T< 0, ΔS∙T> ΔH, T>ΔH / ΔS Примеры:
Следует отметить, что стандартные величины образования изобарно-изотермического потенциала простых веществ (так же как и стандартные энтальпии образования простых веществ) принимаются равными нулю. Пример: ΔfG0(H2) = 0. Химические реакции обычно протекают в закрытой системе, обменивающейся с внешней средой энергией. Следовательно, свободная энергия Гиббса является критерием протекания химического процесса. Мерой химического сродства является убыль G, т.е. –ΔG. Чем ΔG меньше нуля, тем дальше система от состояния химического равновесия, тем более она реакционноспособна. В организме человека и животных протекание эндоэргонических реакций возможно лишь тогда, когда они сопряжены с экзоэргоническими реакциями.
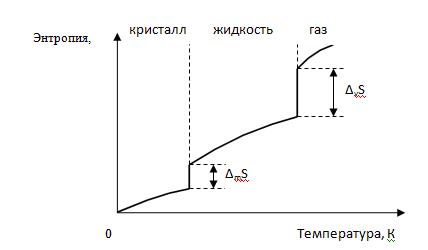
Фазовые переходы Фазовые переходы – это процесс скачкообразного изменения плотности и энтропии вещества. При этом выделяется или поглощается теплота фазового перехода. Примеры: испарение, плавление и обратные им процессы – конденсация, кристаллизация, а также полиморфные превращения. Полиморфизм – способность некоторых веществ одного и того же химического состава иметь различные кристаллические структуры (полиморфные модификации). Например, полиморфные модификации углерода: алмаз, графит, карбин. На Рис.6.1. представлен график изменения энтропии вещества в зависимости от температуры. При температурах фазовых переходов наблюдаются отрезки прямых параллельных оси ординат, которые соответствуют переходу вещества из кристаллического в жидкое (DmS), а из жидкого в газообразное состояние (DvS). При этом агрегатные состояния веществ находятся в равновесии и их энергии Гиббса равны и, поэтому изменение энергии Гиббса равно нулю (DG = 0). Тогда, DG = DН-ТDS =0 или DН = ТDS.
Рис. 6.1. Зависимость энтропии вещества от температуры.
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
В предыдущем разделе были сформулированы критерии самопроизвольного протекания химических реакций. Но это не означает, что если реакция с точки зрения термодинамики может идти самопроизвольно, то она мгновенно осуществится. Примером может служить существование человека в окружающей среде. Человеческие ткани в основном состоят из различных органических соединений. Возможно самопроизвольное протекание процесса взаимодействия практически любого органического соединения с кислородом с точки зрения термодинамики. Но человек на воздухе не сгорает, а существует достаточно долгое время, обеспечивая свое существование за счет реакций окисления органических соединений. В то же время процесс сгорания природного газа протекает достаточно быстро, а некоторые реакции сопровождаются взрывами, т. е. выделением большого количества энергии в доли секунды. Иными словами, существует какой-то другой барьер протекания химических реакций, помимо термодинамического.
Изучением скоростей протекания химических реакций и их механизмами занимается химическая кинетика. Все химические реакции имеют сложный механизм. Механизм реакции – это последовательность протекания промежуточных стадий реакции и промежуточных веществ, природа реагирующих частиц, характер разрыва связей, изменение энергии химической системы на всем пути ее перехода из исходного в конечное состояние, в результате которой происходит образование конечных веществ. Уравнение реакции практически никогда не отражает её механизм, а скорость протекания реакции в этом случае определяется скоростью наиболее медленной стадии, называемой лимитирующей стадией. Различают гомогенные и гетерогенные химические реакции. Гомогенные реакции протекают в однородной среде, например, в растворе, в газовой смеси т.е. в системе, в которой отсутствует поверхность раздела реагирующих веществ. Гетерогенные реакции протекают на поверхности раздела фаз, например, твердое вещество – жидкость или газ; две несмешивающиеся жидкости.
Скорость химической реакции
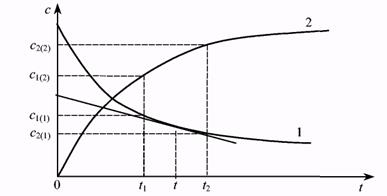
Запишем уравнение элементарной химической реакции в общем виде: аА + bВ = dD + еЕ, где А, В — исходные вещества, D, Е — продукты реакции, строчными буквами (а, b, d, е) обозначены стехиометрические коэффициенты. Напомним, что реакция, протекающая слева направо и отражающая процесс взаимодействия исходных веществ, называется прямой реакцией. Реакция, идущая в обратном направлении, называется обратной. Построим график, на оси ординат которого отложим концентрацию одного (любого) из компонентов системы, а на оси абсцисс — время (Рис.7.1). По мере протекания химической реакции концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются. Выберем два момента времени t1 и t 2. Им будут соответствовать концентрации с1 и с2. Скорость гомогенной химической реакции определяется как изменение концентрации любого из веществ в единицу времени, что математически можно выразить так: V =
Рис. 7.1. Зависимость концентраций одного из исходных веществ (I) и одного из продуктов реакции (2) от времени.
Если скорость реакции определять по одному из исходных веществ, то мы получим отрицательное значение, т.к. С2(1) < C11(1). Но это не означает, что скорость реакции отрицательная величина, чего не может быть по физическому смыслу. Знак «минус» показывает, что концентрация исходного вещества во времени уменьшается. В то же время скорость обратной реакции будет со знаком «плюс», т.е. концентрация продукта увеличивается. Приведенное выше уравнение определяет среднюю скорость реакции за выбранный промежуток времени. Если выбрать другой временной интервал, то ему будет соответствовать другая средняя скорость. Исследователя же интересует «истинная скорость» реакции в данный момент времени. К ее получению можно приблизиться, уменьшая временной интервал. Тогда истинная скорость реакции будет равна пределу отношения изменения концентрации к промежутку времени при ∆t→ 0:
Этот предел равен производной, которую можно найти как тангенс угла наклона касательной в точке, соответствующей данному моменту времени. Поэтому истинную скорость называют еще и мгновенной. Очевидно, что это определение не однозначно. Если определять скорость реакции по концентрациям различных веществ, мы получим разные результаты, поэтому необходимо указывать, по какому из веществ была определена скорость реакции, или использовать другое соотношение:
где νi - стехиометрический коэффициент в уравнении реакции. Скорость гетерогенной химической реакции определяется количеством молей образовавшегося вещества на единицу поверхности раздела фаз в единицу времени, что математически можно выразить так:
Для мгновенной скорости:
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 3060; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.173.166 (0.015 с.) |

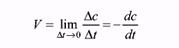
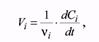
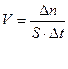 , где ∆n - количество молей образовавшегося вещества, S - площадь поверхности раздела фаз, время образования вещества.
, где ∆n - количество молей образовавшегося вещества, S - площадь поверхности раздела фаз, время образования вещества.