
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристаллические и аморфные тела.
Физические типы кристаллов.
Твердыми телами называются тела, которые обладают постоянством формы и объема. Различают кристаллические и аморфные твердые тела. Подавляющее большинство твердых тел в природе имеет кристаллическое строение (например, почти все минералы, металлы). Рассмотрим отличительные особенности кристаллического состояния. 1. Самой характерной чертой кристаллических веществ является свойство анизотропии. Она заключается в зависимости ряда физических свойств (например, механических, тепловых, электрических, оптических) от направления. Тела, свойства которых одинаковы по всем направлениям, называются изотропными. Газы, почти все жидкости и аморфные тела изотропны. Аморфные тела ведут себя как жидкости, но только потерявшие свойство текучести, или обладающие чрезвычайно высокой вязкостью. Некоторые вещества могут находиться и в кристаллическом, и в аморфном состоянии. Например, сера, которая в кристаллическом состоянии имеет минимальную энергию, поэтому кристаллическое состояние у серы устойчиво, а аморфное – нет. Существует большая группа веществ, которые аморфными не являются, но обладают свойством изотропии. Это поликристаллические вещества. К ним относятся все металлы. Поликристалл состоит из плотно расположенных кристалликов. Изотропия объясняется беспорядком в расположении этих кристалликов. Большие одиночные кристаллы, которые получают из расплава или раствора, называются монокристаллами. 2. Второй характерный признак, отличающий кристаллы от аморфных тел, – это поведение при расплавлении. Пусть тело равномерно нагревается и количество подводимого тепла постоянно. Тогда графически поведение 3. Кристаллические тела имеют правильную геометрическую форму. А аморфные нет. Если же форма кристалла нарушена условиями роста и механической обработки, то принадлежность образца к кристаллам может быть определена по следующим особенностям: 1) поверхность скола есть плоскость; 2) постоянство углов между плоскостями скола. Кристаллическое состояние – это предмет изучения современной физики. В основе теории твердого тела лежит модель бесконечного совершенного монокристалла. Закономерное расположение частиц в кристалле соблюдается на сотнях тысяч или миллионах межчастичных расстояний. Поэтому говорят о существовании в кристаллах «дальнего порядка» расположения частиц в отличие от ближнего порядка в жидкостях и аморфных телах.
Вследствие правильного расположения атомов кристалл обладает свойствами симметрии. Симметрия кристаллической решетки – ее свойство совмещаться с собой при некоторых пространственных перемещениях, например параллельных переносах, поворотах, отражениях или их комбинациях и т. д. Например, правильный шестиугольник. Применительно к кристаллам имеются операции симметрии: поворот вокруг оси; зеркальное отображение в плоскости; зеркальное отображение в точке; зеркальное отражение в плоскости с последующим поворотом вокруг оси. Идеальный монокристалл можно представить себе как периодическую структуру, называемую кристаллической решеткой. С геометрической точки зрения такую структуру можно получить с помощью операции параллельного переноса, которая называется трансляцией. Она описывается вектором:
При перемещении кристалла вдоль трех направлений на отрезки a, b, c параллельно самому себе, будет воспроизводиться конфигурация частиц, образующих кристалл. Всякая пространственная решетка может быть составлена повторением в трех различных направлениях одного и того же структурного элемента – элементарной ячейки. Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят параллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячейки. Элементарная кристаллическая ячейка представляет собой параллелепипед, построенный на ребрах а, b, с с углами a, b и g между ребрами. Величины а, b, с и a, b и g называются параметрами элементарной ячейки. В зависимости от рода частиц, расположенных в узлах кристаллической решетки, и характера сил взаимодействия (притяжения) между ними кристаллы разделяются на четыре типа: ионные, атомные, молекулярные, металлические. Силы отталкивания обусловлены деформациями электронных оболочек ионов, атомов, молекул, то есть имеют единую природу для всех типов кристаллов.
1. Ионными называют кристаллы, в узлах которых находятся ионы чередующихся знаков. Силы притяжения обусловлены электростатическим притяжением зарядов. Связь, обусловленная кулоновскими силами притяжения между разноименными заряженными ионами называется ионной (или гетерополярной). В ионной решетке нельзя выделить отдельные молекулы: кристалл представляет собой как бы одну гигантскую молекулу. Примерами ионных кристаллов являются такие соединения как NaCl, CsCl, MgO, CaO. 2. Атомными называют такие кристаллы, в узлах кристаллической решетки которых расположены атомы. Силы притяжения обусловлены существующими между атомами ковалентными связями (или гомеополярными). Эти связи имеют квантово-механическое происхождение (когда два электрона принадлежат двум атомам и они неразличимы). Примеры ковалентных кристаллов – алмаз и графит (два различных состояния углерода), кремний, германий, некоторые неорганические соединения (ZnS, BeO и др.) 3. Молекулярные кристаллы – в узлах кристаллической решетки расположены нейтральные молекулы. Силы притяжения в них обусловлены силами Ван-дер-Ваальса, то есть незначительным смещением электронов в электронных оболочках атомов. Примеры молекулярных кристаллов – кристаллы инертных газов (Ne, Ar, Kr, Xe), лед, сухой лед СО2, а также газы О2, N2 в твердом состоянии. Ван-дер-ваальсовы силы довольно слабые, поэтому молекулярные кристаллы легко деформируются и разрушаются. 4. Решетки металлов – в узлах кристаллической решетки расположены положительные ионы металла, то есть элементы, потерявшие 2 или 3 электрона. Эти электроны находятся в движении и образуют своего рода идеальный газ электронов, которые удерживаются в электростатическом поле, создаваемом решеткой положительно заряженных ионов металлов. Это т.н. электроны проводимости. Они обусловливают электропроводность металлов. Кроме того, по структуре металлы являются поликристаллическими, этим объясняется шероховатая поверхность скола. Кроме вышеуказанных типов связей между частицами в кристаллах возможны смешанные связи. Различные комбинации взаимодействий создают многообразие в строении кристаллов. В различных плоскостях, которые можно провести в кристалле, расстояния между частицами окажутся различными. Так как силы, действующие между частицами, зависят от расстояния, то разнообразные физические свойства кристаллов зависят от направления, то есть кристалл является анизотропным.
Дефекты в кристаллах.
Микродефекты делятся на точечные и линейные. Точечные дефекты бывают трех типов (рис. 9.16): 1) вакансия – отсутствие атома в узле кристаллической решетки (рис. 9.16, a) (дефект по Шоттки);
2) междоузельный атом – атом, внедрившийся в междоузельное пространство (рис. 9.16, б) (дефект по Френкелю); 3) примесный атом – атом примеси, либо замещающий атом основного вещества в кристаллической решетке (рис.9.16. в), либо внедрившийся в междоузельное пространство (примесь внедрения, рис. 9.16, б; только в междоузлии вместо атома основного вещества располагается атом примеси). Точечные дефекты нарушают лишь ближний порядок в кристаллах, не затрагивая дальнего порядка, – в этом состоит их характерная особенность. Линейные дефекты нарушают дальний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида – дислокациями. Дислокации – линейные дефекты, нарушающие правильное чередование атомных плоскостей. Дислокации бывают краевые и винтовые. Если одна из атомных плоскостей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию. В случае винтовой дислокации ни одна из атомных плоскостей внутри кристалла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из одной атомной плоскости, изогнутой по винтовой поверхности. Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов составляет 102–103см2, для деформированных кристаллов – 1010 –1012 см2. Дислокации никогда не обрываются, они либо выходят на поверхность, либо разветвляются, поэтому в реальном кристалле образуются плоские или пространственные сетки дислокаций. Дислокации и их движение можно наблюдать с помощью электронного микроскопа, а также методом избирательного травления – в местах выхода дислокации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации. Наличие дефектов, особенно при внедрении атомов, приводит к изменению физических свойств, например электропроводности.
Теплоемкость твердых тел.
Тепловое движение в твердых телах заключается в колебаниях атомов относительно положений равновесия, расположенных в узлах кристаллической решетки. Атомы в решетке взаимодействуют, поэтому и колебания атомов являются не свободными, а связанными, однако по мере повышения температуры связь между атомами играет все меньшую роль в колебательных процессах и при достаточно высоких температурах можно принять, что колебания становятся свободными.
Рассмотрим по классической теории. На каждую степень свободы приходится энергия: Однако атом, находящийся в узле кристаллической решетки, обладает не только кинетической энергией теплового движения, но и потенциальной энергией взаимодействия с соседними частицами, причем вклад этого вида сравним с кинетической: Внутренняя энергия одного моля одноатомного кристалла:
Объем твердого тела при нагревании изменяется слабо (b~10-5 1/К), то можно считать:
т.е. теплоемкость одного моля всех одноатомных кристаллов есть величина постоянная. При комнатной температуре закон Дюлонга и Пти выполняется и примерно принимает значения около С=3R=25 Дж/(моль.К), то есть имеется соответствие с теорией. Но с классической точки зрения теплоемкость металлов должна быть значительно больше. В металлах имеются электроны проводимости, с классической точки зрения они обладают тремя степенями свободы. Если считать, что число их равно числу атомов, то электроны (как свободные частицы) должны внести в теплоемкость вклад Сэ=1,5 R, то есть увеличить ее на 50%. В действительности этого нет, и закон Дюлонга и Пти справедлив и для металлов. Расхождение опытных и теоретических значений теплоемкостей, вычисленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкости А. Эйнштейн и П. Дебай.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.127.232 (0.018 с.) |
 будет выглядеть следующим образом (9.15).
будет выглядеть следующим образом (9.15).

 ; на i степеней свободы в одной молекуле:
; на i степеней свободы в одной молекуле:  =
=  . Рассмотрим атомную решетку, для каждого атома в ней i=3:
. Рассмотрим атомную решетку, для каждого атома в ней i=3:  . Внутренняя энергия одного моля:
. Внутренняя энергия одного моля:  .
.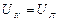
 .
. , тогда:
, тогда: ,
, - закон Дюлонга и Пти
- закон Дюлонга и Пти


