Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Для практических работ по химии
УЧАЩЕГОСЯ ГРУППЫ __________________ __________________________________________ ПРЕПОДАВАТЕЛЬ ______________ Саяпина Н.В.
Мозырь Общие правила безопасного поведения в кабинете химии
1. Прежде чем приступить к выполнению практических работ, необходимо подробно изучить порядок их проведения и далее при выполнении строго следовать указаниям, приведенным при описании опытов. 2. Следует строго соблюдать все указания преподавателя по безопасному обращению с приборами и реактивами. 3. В кабинете химии ЗАПРЕЩАЕТСЯ: Fпринимать пищу и напитки; Fпробовать реактивы на вкус; Fиспользовать химическую посуду не по назначению; Fбрать руками твердые сыпучие реактивы (для этого используются специальные ложечки, совочки и шпатели); Fоставлять открытыми склянки с реактивами; Fвыливать и высыпать избыток реактивов обратно в сосуд с основным количеством реактива; Fвыливать содержимое пробирок в раковину после проведения эксперимента; Fсамостоятельно проводить опыты, не предусмотренные практической работой; Fпри нагревании жидкостей направлять отверстие сосуда на себя или на соседа; Fзажигать спиртовку от зажигалки или другой спиртовки (для этого используют зажженную лучину или спички); Fзадувать пламя спиртовки (гашение пламени спиртовки производится с помощью специального колпачка); Fрезко вдыхать пары вещества при обнаружении его по запаху (для этого необходимо осторожно направит поток газа от отверстия пробирки к себе); Fвыбрасывать в урну использованные фильтры, реактивы, битое стекло, обрывки бумаги и т.п. (перечисленные материалы собираются в специально отведенные емкости). 4. Если вы случайно разлили (рассыпали) реактивы, или реактив попал на кожу или одежду, необходимо об этом сразу сообщить преподавателю или лаборанту и далее следовать их указаниям. 5. По окончании опытов рабочее место необходимо привести в порядок и вымыть руки с мылом. Практическая работа № 1 «____»_____________________20____ г.
ПОЛУЧЕНИЕ ЭТИЛЕНА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ Цель: получить лабораторным способом этилен и исследовать его свойства. Оборудование: лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, спиртовка. Реактивы: смесь этанола и концентрированной серной кислоты, иодная вода (с массовой долей 1 – 3%), раствор перманганата калия (с массовой долей 1 – 3%), центры кипения (кисочки фарфора или пемзы).
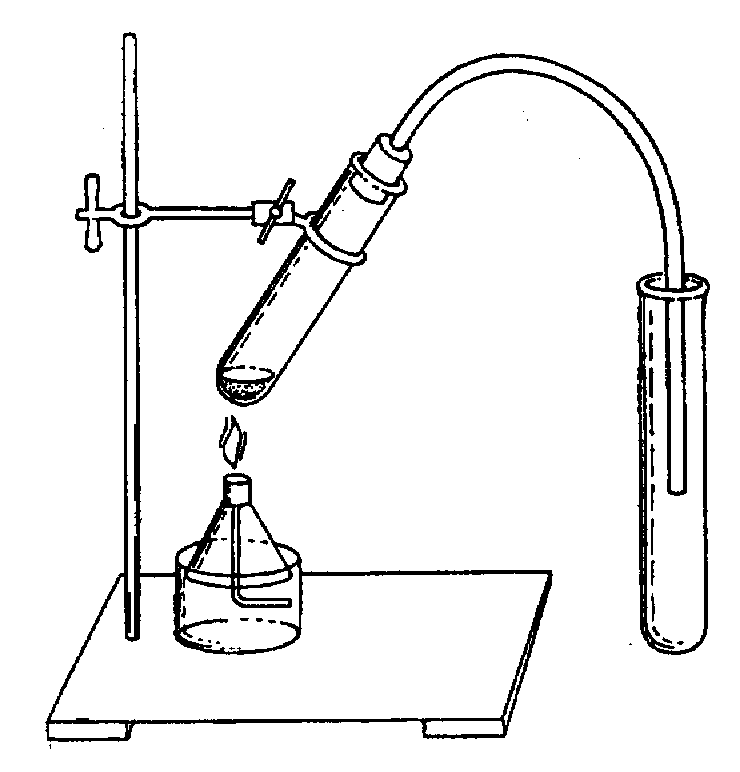
G Соблюдайте правила техники безопасности! Ход работы Задание 1. Получение этилена 1. Поместите в пробирку с заранее приготовленной преподавателем смесью этилового спирта и концентрированной серной кислоты несколько крупинок фарфора для равномерного кипения смеси при нагреванию 2. Соберите прибор для получения этилена как показано на рисунке.
3. Нагревайте пробирку со смесью в пламени спиртовки до появления пузырьков газа в пробирке с иодной водой. Задание 2. Изучение химических свойств этилена. 1. Пропустите выделяющийся газ сначала в пробирку с иодной водой, опустив свободный конец газоотводной трубки до дна пробирки (но, не касаясь дна), до изменения окраски раствора, и затем сразу же – через раствор перманганата калия в другой пробирке – до изменения окраски раствора. 2. Достаньте из прибора пробирка с обесцвеченным раствором перманганата калия, поверните газоотводную трубку отверстием вверх и подожгите выделяющийся этилен. 3. Отметьте цвет пламени.
Сделайте вывод о лабораторном способе поучения этилена, используемом в данной работе и причинах обесцвечивания йодной воды и раствора перманганата калия. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Решите задачу: Определите объем этилена, который можно получить путем дегидратации этанола массой 110 г в присутствии концентрированной серной кислоты. Выход продукта реакции составляет 65%.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа № 2 «____»_____________________20____ г.
ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ И ИССЛЕДОВАНИЕ ЕЕ СВОЙСТВ Цель: получить лабораторным способом уксусную кислоту и исследовать ее свойства. Оборудование: лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, ложечка, спиртовка, рН-шкала, универсальная индикаторная бумага). Реактивы: растворы уксусной кислоты (с массовой долей 6 – 9%), серной кислоты (с массовой долей 10%), гидроксида натрия (с массовой долей 5%); ацетат натрия (кристаллический), гидрокарбонат натрия (кристаллический), магний, оксид магния. G Соблюдайте правила техники безопасности! Ход работы Задание 1. Получение уксусной кислоты. 1. Поместите в пробирку ложечку кристаллического ацетата натрия. 2. Прибавьте по каплям раствор серной кислоты, чтобы он слегка смочил соль. 3. Соберите прибор для получения уксусной кислоты, как показано на рисунке.
4. Нагревайте смесь веществ в пламени спиртовки до появления капелек конденсата в пробирке-приемнике. 5. Отметьте появление запаха образующейся кислоты. 6. Составьте уравнение реакции получения уксусной кислоты. 7. Заполните таблицу.
Задание 2. Исследование химических свойств уксусной кислоты. 1. В две чистые пробирки налейте по 0,5 – 1 мл раствора уксусной кислоты, выданного для проведения опыта. 2. В одну пробирку поместите полоску универсальной индикаторной бумаги, затем нейтрализуйте кислоту раствором щелочи. 3. В другую пробирку внесите щепотку порошка магния. 4. Отметьте явления, происходящие в пробирках. 5. В две чистые пробирки налейте по 0,5 – 1 мл выданного раствора уксусной кислоты. 6. В одну пробирку добавьте щепотку порошка оксида магния. 7. В другую пробирку добавьте щепотку кристаллического гидрокарбоната натрия. 8. Отметьте явления, происходящие в пробирках. 9. Составьте соответствующие уравнения реакций в молекулярном и ионном виде. Дайте названия основным продуктам реакции. 10. Заполните таблицу.
Сделайте вывод о способе получения уксусной кислоты в лаборатории и кислотно-основных свойствах уксусной кислоты. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа № 3 «___»________________20____ г.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 834; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.26.176 (0.015 с.) |