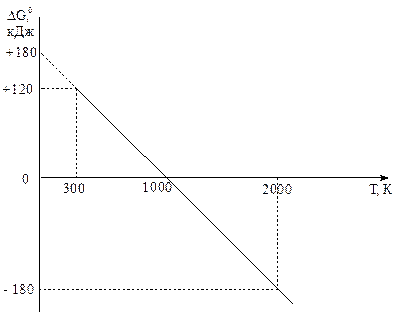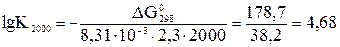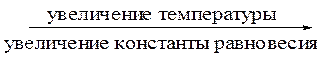Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика химических процессов
Критерием возможности самопроизвольного протекания реакции в данных условиях является изменение энергии Гиббса (ΔG): ΔG = ΔH – TΔS, где ΔH и ΔS – изменения энтальпии и энтропии в ходе химической реакции, T – абсолютная температура, ΔH – энтальпийный фактор, TΔS – энтропийный фактор. Если ΔG < 0, то прямая реакция может протекать самопроизвольно. Если ΔG = 0, то ΔH = TΔS, т.е. энтропийный и энтальпийный факторы уравновешивают друг друга и система находится в состоянии истинного химического равновесия. Если ΔG > 0, то самопроизвольно может протекать обратная реакция. Для проведения термодинамических расчетов используют справочные данные (таблицы термодинамических величин), в которых приводятся чаще всего стандартные энтальпии образования, энергии Гиббса образования и энтропии различных веществ: ΔН0298, ΔG0298, DS0298. Стандартная энтальпия образования и энергия Гиббса образования простых веществ принимаются равными нулю. Если элемент образует несколько простых веществ, то стандартным считается состояние элемента в виде наиболее устойчивой в данных условиях модификации (кислород, ромбическая сера, графит, кристаллический йод, жидкий бром и др.). Энтропии простых веществ не равны нулю. Для расчета ΔН0, ΔG0, DS0 химических реакций применяют закон Гесса или его следствия. Расчетные данные относятся к мольным соотношениям веществ, которые указаны стехиометрическими коэффициентами химического уравнения. Если нужно рассчитать энергию Гиббса для температуры, отличной от стандартной, то используют уравнение ΔG0т = ΔН0т – TDS0т, (1) где ΔН0 и DS0 – величины, зависящие от температуры. Например, ΔG0298 = ΔН0298 – TDS0298, (2) ΔG01000 = ΔН01000 – TDS01000, (3) Для ориентировочных расчетов можно принять, что ΔН0 и DS0 мало зависят от температуры (что часто имеет место в действительности), т.е. ΔН0т ≈ ΔН0298, DS0т ≈ DS0298. Тогда уравнение примет вид: ΔG0298 ≈ ΔН0298 – TDS0298 (4) Для ориентировочных приближенных расчетов. Например, ΔG01000 ≈ ΔН0298 – 1000DS0298, для состояния истинного химического равновесия ΔG0т = 0, тогда ΔН0298 ≈ TDS0298, отсюда:
ориентировочная температура установления истинного химического равновесия. Эту температуру иногда называют температурой начала реакции. Вблизи этой температуры энергия Гиббса изменяет знак, т.е. изменяется направление процесса.
Энергия Гиббса связана с константой химического равновесия следующим соотношением: ΔG0т = – RT ln Kт (6) где R – универсальная газовая постоянная, 8,31·10-3 кДж/моль·К. Так как ln k = 2,3·lgK, то
Обратите внимание, что для расчета константы при температуре Т используется ΔGт при этой же температуре. Например,
В состоянии истинного химического равновесия ΔGт = 0, Kт = 1. Пример. Провести термодинамический расчет реакции: СО2(г) + С(графит) ↔ 2 СО(г). Исходные данные из приложения удобно оформить в виде следующей таблицы.
Стандартные энтальпия образования, энтропия и энергия Гиббса образования веществ
1. (ΔН0298)х.р. = 2 2. (ΔS 0298)х.р. = 2 = 175,6 · 10-3 кДж/моль > 0. Прямая реакция сопровождается увеличением энтропии, беспорядок в системе увеличивается – благоприятный фактор для протекания химической реакции в прямом направлении. 3. Рассчитываем стандартную энергию Гиббса реакции двумя способами. При выполнении задания можно считать только одним способом «а»: а) по закону Гесса: (ΔG 0298)х.р. = 2 б) по уравнению (2): (ΔG 0298)х.р. = 172,5 – 298 · 175,6 · 10-3 = 172,5 – 52,3 = 120,2 кДж > 0. Оказалось, что (ΔН0298)х.р. > (ΔS 0298)х.р.·Т и тогда (ΔG 0298)х.р. > 0, т.е. при стандартных условиях энтальпийный фактор сыграл решающую роль. Таким образом, прямая реакция при стандартных условиях самопроизвольно протекать не может. Может протекать обратная реакция. В данных условиях в системе преобладают процессы агрегации по сравнению с процессами дегазации частиц, т.е. упорядоченность системы возрастает (из двух молей газообразного вещества получается 1 моль газа и 1 моль твердого вещества). 4. Обратите внимание: если ΔН0 выражено в кДж, то и ΔS 0 должно быть в кДж/К.
5. По уравнению (4): (ΔG 02000)х.р. ≈ ΔН0298 – 2000·ΔS 0298 ≈ ≈ 172,5 – 2000·175,6·10-3 ≈ - 178,7 кДж < 0. Т.е. при 2000 К: ΔS 0х.р.·Т > ΔН0х.р. Энтропийный фактор стал решающим, самопроизвольное протекание прямой реакции стало возможно: из одного моля газа и 1 моля твердого вещества образуется 2 моля газа. 6. lg К298 = -21,1; К298 ≈ 10-21 << 1. Система далека от состояния истинного химического равновесия, в ней преобладают исходные вещества.
Зависимость ΔG 0 от температуры для реакции СО2(г) + С(графит) ↔ 2 СО(г).
7. lg К2000 = 4,8·104 >> 1 – система также далека от состояния равновесия, при этой температуре в ней преобладают продукты реакции. 8. СО2(г) + С(графит) ↔ 2 СО(г), ΔН0 > 0
По принципу Ле Шателье при повышении температуры равновесие должно смещаться в сторону прямой реакции, константа равновесия должна увеличиваться. 9. Рассмотрим, как согласуются наши расчетные данные с принципом Ле Шателье. Представим некоторые данные, показывающие зависимость энергии Гиббса и константы равновесия указанной реакции от температуры:
Таким образом, полученные расчетные данные соответствуют нашим выводам, сделанным на основании принципа Ле Шателье.
Задания к разделу Термодинамика химических процессов
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.111.183 (0.01 с.) |
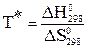 – (5)
– (5)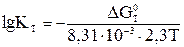 . (7)
. (7)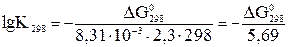 , (8)
, (8) . (9)
. (9)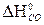 –
– 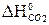 = 2 (-110,5) + 393,5 = 172,5 кДж > 0 - эндотермическая реакция – неблагоприятный фактор для протекания химической реакции, особенно при низких температурах.
= 2 (-110,5) + 393,5 = 172,5 кДж > 0 - эндотермическая реакция – неблагоприятный фактор для протекания химической реакции, особенно при низких температурах.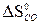 –
– 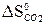 –
– 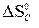 = 2 · 197,5 – 213,7 – 5,7 = 175,6 Дж/К =
= 2 · 197,5 – 213,7 – 5,7 = 175,6 Дж/К =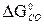 –
– 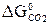 = 2 (-137,1) + 394,4 = 120,2 кДж > 0;
= 2 (-137,1) + 394,4 = 120,2 кДж > 0;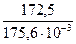 ≈ 982 К.
≈ 982 К.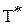 ≈ 982 К – ориентировочная температура, при которой устанавливается истинное химическое равновесие, выше этой температуры прямая реакция может протекать самопроизвольно.
≈ 982 К – ориентировочная температура, при которой устанавливается истинное химическое равновесие, выше этой температуры прямая реакция может протекать самопроизвольно. ;
;