
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическая роль комплексных соединений ⇐ ПредыдущаяСтр 8 из 8
Комплексные соединения, рассмотренные нами выше, содержали лиганды, в основном, неорганической природы. Однако, в биологи-ческих системах огромную роль играют комплексные соединения, в которых в качестве лигандов выступают сложные органические молекулы, обладающие полидентатными свойствами (т. е., способны образовывать с комплексообразователем несколько связей). Металлопротеины К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов. Отдельную группу металлопротеинов составляют гемопро-теины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя - координационной. Координа-ционное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN- и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота - метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.
где R - остаток белковой молекулы. Схема образования связей в гемоглобине Гем в виде гем-порфирина является простетической группой производных гемоглобина: миоглобина, каталазы, пероксидазы и цитохромов. Отличительной особенностью гемоглобина (миоглобина) являет-ся постоянство степени окисления железа Fe2+. Равновесие: О2 + гемоглобин ⇄ оксигемоглобин в легких смещено вправо, а в клетках – влево. Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2). Транспортные функции выполняют и цитохромы, в которых связь между гемом и полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи.
Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на изменении степени окисления железа: Fe2+ - Fe3+ + Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования. С кислородом и СО цитохромы не взаимодействуют. Витамины Единственным витамином, содержащим в своей структуре металл, является витамин В12 (кобаламин). В его состав входит ион Со3+, который находится в центре плос-кой корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плос-кости корриновой системы расположен нуклеотидный лиганд, состо-ящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион. Витамин В12 содержится в ферментных системах в виде В12-ко-ферментов или кобамидных коферментов - метилкобаламина, содер-жащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5¢-дезоксиаденозинкобаламин. Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов. Недостаток витамина12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудоч-ного сока.
Схема образования связей в витамине B12 (кобаламине) Ферменты Ферментами называют класс веществ белковой природы, катали-зирующих большое число химических реакций. Ферменты обеспечи-вают реализацию генетической информации, а также обмен веществ и энергии. Ферменты отличаются от неорганических катализаторов значительно большей активностью и высокой специфичностью действия: один фермент, как правило, катализирует только одну химическую реакцию. Действующим началом фермента карбоксипептидазы, катализи-рующего процессы гидролиза, является ион Zn2+. Ион цинка оттягивает на себя электроны карбонильной группы С = O в пептиде (- СО - NH -), в результате связь С = O еще больше поляризуется, что облегчает гидролиз и разрыв С-N связи.
Ионы цинка также входят в состав фермента карбоангидразы, который катализирует гидратацию СО2, т. е. образование иона НСО3-, и в тоже время участвует в каталитическом разложении НСО3-, которое сопровождается выделением СО2. Первая реакция протекает в альвеолах легких, вторая (обратная) - в клетках. Некоторые другие комплексные соединения металлов, играющие определенную биологическую роль, приведены в таблице 2. Таблица 2. Биологически важные комплексы металлов.
Токсикологическая роль комплексообразования Токсическое действие большинства тяжелых металлов (ртуть, свинец, таллий и др.) объясняется способностью ионов этих металлов образовывать прочные комплексы с белками, ферментами и амино-кислотами, В результате подавляется активность ферментов и происходит свертывание белков. Например, ионы ртути Hg2+ образуют прочные комплексы с белками, имеющими в своем составе SH-группы. Таким образом, ртуть концентрируется в тканях и органах, богатых этими белками, а именно в почках, головном мозге, слизистой оболочке рта. Свинец удерживается белками эритроцитов, затем поступает в плазму крови в виде комплексов с гамма-глобулином и, наконец, достигает почек, печени и других органов. Свинец также накапли-вается в костной ткани. Некоторые лиганды, способные образовывать прочные комплек-сы с ионами металлов, используются в качестве антидотов при бытовых и профессиональных отравлениях соединениями тяжелых металлов, а также при хронических интоксикациях, вызванных передозировкой лекарственных препаратов. Так, внутривенное введение ЭДТА позволяет вывести из организма избыточные ионы Ca2+ в виде прочного комплекса, что снижает вероятность образования камней в почках и в желчном пузыре. При отравлениях соединениями ртути, сурьмы и мышьяка внутривенно вводят димеркапрол (2,3-димеркаптопропанол-1), кото-рый не только снижает токсическое действие этих элементов, но и выводит их из организма в виде комплексов:
Позднее в употребление была введена 2,3-димеркаптоянтарная кислота, которую вводят перорально:
При отравлениях соединениями меди используют пеницилламин:
Комплекс меди с пеницилламином выводится вместе с мочой. Эталоны решения задач 1. Для комплексного соединения [Сr(NН3)5С1]С12 определить заряд комплексообразователя, указать координационное число (к.ч.), дать название по международной номенклатуре, написать уравнения первичной и вторичной диссоциации и составить выражение для константы нестойкости комплексного иона. Решение. 1) заряд комплексного иона равен +2, следовательно, алгебраи-ческая сумма зарядов внутренней сферы:
x + 0 - 1 = 2, x = +3; 2) все лиганды монодентатные, следовательно, к.ч. = 6; 3) название: хлорид хлоропентамминхрома (III); 4) уравнения диссоциации: [Сr(NН3)5С1]С12 [Сr(NН3)5С1]2+ ⇄ Сr3+ + 5NН3 + С1- (вторичная). 5) выражение для константы нестойкости:
2. При добавлении к водному раствору, содержащему комплек-сное соединение состава PtCl2SO4×4NH3, нитрата бария выпадает белый осадка. Последующее добавление раствора нитрата серебра не привело к выпадению осадка. Установить координациионную формулу комплексного соединения до и после добавления Ba(NO3)2. Привести формулы возможных ионизационных изомеров исходного комплекса для координационного числа платины равного 6. Решение. Из всех компонентов комплексного соединения ионы Ba2+ обра-зуют белый осадок только с сульфат-ионами. При этом Ba(NO3)2 может осадить только те сульфат-ионы, которые находятся во внешней сфере. Отсутствие осадка при добавлении нитрата серебра свидетельствует о том, что все хлорид-ионы находятся во внутренней сфере.
Таким образом, координационная формула исходного комплекс-ного соединения имеет вид: [Pt(NH3)4Cl2]SO4, а после добавления Ba(NO3)2 - [Pt(NH3)4Cl2](NO3)2. Формулы ионизационных изомеров: [Pt(NH3)4Cl2]SO4 и [Pt(NH3)4SO4]Cl2. 3. Для полного осаждения галогенид-ионов, составляющих внешнюю сферу комплексного соединения, из 100 мл раствора CrCl3Br×4NH3 с концентрацией комплекса 0,02 моль/л потребовалось 20 мл раствора нитрата серебра с C(AgNO3) = 0,2 моль/л. Установить координационную формулу комплексного соединения, если в результате реакции образовался только белый осадок. Возможно ли в данном комплексе возникновение геометрической, ионизационной и координационной изомерии? Решение. Из условия задачи следует, что образуется только осадок AgCl (белого цвета), тогда как осадок AgBr (светло-желтого цвета) не образуется. Это означает, что бромид-ионы находятся во внутренней сфере комплекса. Там же находятся и молекулы аммиака, так как их присутствие в растворе привело бы к образованию растворимого комплекса [Ag(NH3)2]Cl и отсутствию осадка AgCl. Для того, чтобы установить соотношение хлорид-ионов, находя-щихся во внешней и во внутренней сфере, рассчитаем количества реагирующих веществ:
Мольное соотношение показывает, что с 1 моль комплекса реагирует 2 моль AgNO3. Это возможно только в том случае, когда во внешней сфере находятся 2 хлорид-иона. Таким образом, координационная формула комплексного соеди-нения имеет вид: [Cr(NH3)4BrCl]Cl2.
Возникновение геометрической изомерии возможно, так как комплекс является смешанным и содержит три вида лигандов. Так как в соединении имеются различные отрицательно заряжен-ные ионы, то при условии постоянства к.ч. ионизационные изомеры выглядят так: [Cr(NH3)4BrCl]Cl2 и [Cr(NH3)4Cl2]ClBr. Координационных изомеров у данного комплекса нет, так он содержит только одну внутреннюю сферу. 3. Образец комплексного соединения состава CrCl3∙6H2O массой 533 г был высушен в эксикаторе до постоянной массы, которая составила 461 г. Установить координационную формулу соединения, если координационное число хрома равно 6. Какие типы изомерии возможны для данного комплексного соединения? Решение. Из всех компонентов комплексного соединения летучестью обладают только молекулы воды. Масса потерянной воды равна:
что составляет Количество комплексного соединения равно: Таким образом, на 1 моль комплексного соединения приходится 2 моль потерянной воды. Так как испаряться при сушке могут только те молекулы воды, которые находятся во внешней сфере, то с учетом значения координационного числа формула соединения выглядит следующим образом: [Cr(H2O)4Cl2]Cl·2H2O. В данном случае возможно образование сольватных (гидратных) изомеров: [Cr(H2O)6]Cl3, [Cr(H2O)5Cl]Cl2×H2O и [Cr(H2O)4Cl2]Cl×2H2O. Кроме того, октаэдрический комплекс состава [MeA4B2] может иметь два геометрических изомера. Оптических изомеров у него нет, так как во внутренней сфере не имеется четырех различных заместителей. Данный комплекс не образует различных анионов при диссоциации, поэтому ионизационных изомеров у него также нет. Координационных изомеров не возникает по причине отсутствия второй внутренней сферы. 4. Рассчитать концентрации всех ионов в растворе K3[Fe(CN)6] с концентрацией комплексной соли 0,001 моль/л, если Решение. Запишем уравнения первичной и вторичной диссоциации комп-лексной соли: K3[Fe(CN)6] [Fe(CN)6]3− ⇄ Fe3+ + 6CN−. Так как первичная диссоциация протекает полностью, а вторичная - в пренебрежимо малой степени, то концентрация малодиссоциированного комплексного иона примерно равна концентрации комплексной соли:
Концентрации ионов Fe3+ и CN− найдем из выражения для
Из стехиометрических соотношений видно, что:
Тогда выражение для константы нестойкости принимает вид:
Отсюда:
5. Определить, как и во сколько раз изменится концентрация ионов Ag+ в растворе K[Ag(CN)2] с концентрацией комплексной соли 0,01 моль/л при добавлении к 100 мл раствора 6,5 г KCN, если Решение. Ионы Ag+ образуются в растворе в результате вторичной диссоциации комплексной соли: [Ag(CN)2]- ⇄ Ag+ + 2CN-. Рассчитаем концентрацию ионов Ag+ в исходном растворе:
Аналогично решению предыдущей задачи:
Тогда выражение для константы нестойкости принимает вид:
Отсюда:
При добавлении избытка KCN равновесие вторичной диссо-циации, согласно принципу Ле Шателье, сместится влево. Это означает, что концентрация ионов Ag+ в растворе уменьшится, а концентрация комплексных ионов [Ag(CN)2]- - увеличится.
Обозначим изменившиеся концентрации ионов [ ]¢ и из выражения для
Так как степень диссоциации комплексного иона очень мала, то концентрацию ионов CN- в растворе можно принять равной концентрации KCN, т.е.:
Так как диссоциация комплексного иона в присутствии CN- практически подавлена, то изменением ее величины можно пренеб-речь и считать:
Отсюда:
Таким образом, соотношение концентраций ионов Ag+ в растворах составит:
6. Имеется раствор комплексной соли [Cu(NH3)4]Cl2 с молярной концентрацией 0,01 моль/л, в 100 мл которого дополнительно содержится 0,034 г аммиака. Рассчитать массу ионов Cu2+ в 10 л этого раствора, если Решение. Поскольку первичная диссоциация [Cu(NH3)4]Cl2 протекает полностью: [Cu(NH3)4]Cl2 а диссоциация комплексного иона протекает в незначительной степени (ввиду малой величины [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3, то в растворе концентрация комплексных ионов практически равна концентрации самой соли:
Количество аммиака, образовавшегося в результате диссоциации комплексного иона, также пренебрежимо мало по сравнению с уже имеющимся в растворе. Поэтому:
Из выражения для
получим:
Отсюда:
7. Рассчитать концентрации катионов калия и ртути в растворе K2[HgI4] с молярной концентрацией 0,025 моль/л, содержащем 16,6 г KI в 800 мл этого раствора, если Решение. Ионы K+ образуются в результате первичной диссоциации комплекса: K2[HgI4] и диссоциации KI: KI Из стехиометрических соотношений видно, что:
Таким образом, концентрация ионов K+ равна:
Концентрацию ионов Hg2+ найдем из выражения для
Аналогично решению предыдущей задачи:
Отсюда:
8. Найти соотношение концентраций ионов комплексообразова-телей в растворах [Co(NH3)4]2+ и [Cd(CN)4]2- с равными концентра-циями комплексных ионов, если значения констант нестойкости, соответственно, равны: 8,5·10-6 и 7,8·10-18. Решение. Из уравнений вторичной диссоциации: [Co(NH3)4]2+ ⇄ Co2+ + 4NH3, [Cd(CN)4]2- ⇄ Cd2+ + 4CN-. видно, что: [NH3] = 4∙[(Co2+], [CN-] = 4∙[Cd2+]. Таким образом, выражения для констант нестойкости имеют вид:
Разделив одно выражение на другое с учетом того, что
Отсюда:
9. Сравнить концентрации ионов Al3+ в растворах K[Al(OH)4] с pH = 9 и с pH = 11, если молярная концентрация комплекса в обоих случаях равна 0,01 моль/л. Решение. Ионы Al3+ образуются в растворе в результате вторичной диссоциации комплексной соли: [Al(OH)4]- ⇄ Al3+ + 4OH-. Концентрацию ионов Al3+ в растворе можно рассчитать из выражения для константы нестойкости:
Концентрацию комплексного иона можно считать приблизи-тельно равной концентрации комплексной соли:
Концентрации гидроксид-ионов в обоих растворах найдем, исходя из значений pH:
Тогда в первом растворе:
Во втором растворе
Таким образом, соотношение концентраций ионов Al3+ в растворах составляет:
10. Вычислить изменение энергии Гиббса при 250С для процесса диссоциации комплексного иона [Cd(CN)4]2-, если Решение. В соответствии с формулой (3):
Положительная величина 11. Диссоциация комплексного иона [Cu(CN)2]- при 250С сопровождается изменением энергии Гиббса DG0 = 137,0 кДж/моль. Рассчитать величины Решение. В соответствии с формулой (3):
Отсюда:
Вопросы для самоконтроля 1. Какие химические соединения называются комплексными? Назовите составные части комплексного соединения. Приведите при-меры. 2. Из каких компонентов состоит внутренняя сфера комплексного соединения? 3. Какие частицы могут выступать в роли комплексообразо-вателя? Укажите основные характеристики комплексообразователя. 4. Какие частицы могут выступать в роли лигандов? Могут ли ионы H+ входить в состав комплексного соединения в виде лигандов? 5. Что такое дентатность? Приведите примеры монодентатных, бидентатных, полидентатных и амбидентатных лигандов. 6. От каких факторов зависит координационное число? 7. Какой механизм образования химической связи реализуется во внутренней сфере? 8. Определить заряд и координационное число комплексообразо-вателя в следующих комплексных соединениях: K3[Cr(C2O4)3], [Pt(NH3)2Cl2], KFe3+[Fe(CN)6], [Al(H2O)6]2(SO4)3, Cs[Co(H2O)3Br3], K[AuCl3OH], Na2[Pd(CN)4], K4[Co2(C2O4)4(OH)2] 9. Что входит в состав внешней сферы? 10. Каким типом химической связи связаны между собой внут-ренняя и внешняя сферы? 11. Встречаются ли комплексные соединения, не содержащие внешней сферы? 12. Какие способы классификации комплексных соединений вам известны? Приведите примеры. 13. Какие типы гибридизации электронных орбиталей вам известны? Приведите примеры. 14. Комплексный ион [Cu(NH3)2]+ имеет линейное строение. Какой тип гибридизации реализуется в данном случае? 15. Комплексный ион [Zn(NH3)4]2+ имеет тетраэдрическую струк-туру. Какой тип гибридизации реализуется в данном случае? 16. Почему ион [Ni(NH3)4]2+ имеет тетраэдрическое строение, а [Ni(CN)4]2- представляет собой плоский квадрат? 17. Какие типы изомерии комплексных соединений вам известны? Определите тип изомерии в следующих парах комплекс-ных соединений: а) [Cr(H2O)6]Cl3 и [Cr(H2O)5Cl]Cl2×H2O б) [Co(NH3)4ClNO3]Cl и [Co(NH3)4Cl2]NO3 в) цис-K2[PtCl2(NO2)4] и транс-K2[PtCl2(NO2)4] г) [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6] 18. Сформулируйте правила номенклатуры комплексных соеди-нений и назовите следующие соединения: Na3[FeF6], [Ni(NH3)6]Cl2, K2[Co(C2O4)3], Na3[Ag(S2O3)2], H[AuCl4], Ca[Cr(NH3)2(SCN)4], K3[Al(OH)4(H2O)2], K[Pt(NH3)Cl3], K2[PbBr4], [Co(NH3)4ClNO2], Li[AlH4], (NH4)2[Pt(OH)2Cl4], Sr2[Cu(OH)6] 19. Составьте формулы комплексных соединений: гексахлоропалладат (IV) аммония, дихлороаргентат (I) цезия, пентакарбонилжелезо, гидроксотрихлороаурат (III) калия, сульфат дихлоротетраамминкобальта (III), пентахлороакваферрат (III) кальция, тетрагидридоборат (III) натрия, гексаамминосмий, хлорид карбонатодекаамминдикобальта (III) 20. Все ли комплексные соединения являются электролитами? Определить, какие из перечисленных комплексов относятся к неэлек-тролитам: K3[Fe(CN)6], [Cu(NH3)4]SO4, [Pt(NH3)2Cl2], H[AuCl4], [Co2(CO)8] 21. Как протекает диссоциация комплексных соединений? Чем обусловлен такой характер диссоциации? 22. Какие величины характеризуют устойчивость комплексных ионов в водных растворах? Как они связаны между собой? 23. К раствору, содержащему комплексный ион [Ag(NH3)2]+, добавили 1 моль избытка аммиака. а) Как изменится равновесная концентрация ионов Ag+? б) Как изменится равновесная концентрация ионов [Ag(NH3)2]+? в) Как изменится величина константы нестойкости?
24. Константы нестойкости комплексных ионов [Ag(CN)2]-, [Ag(NH3)2] 25. Константы устойчивости комплексных ионов [Cо(CN)4]2-, [Нg(CN)4]2- и [Cd(CN)4]2- соответственно равны 1,3·1019, 2,5·1040, 1,3·1017. В каком растворе, содержащем эти ионы (при одинаковой молярной концентрации), ионов CN- меньше (больше)? 26. Какими способами можно разрушить комплексные соедине-ния? Приведите примеры. 27. Иодид калия осаждает серебро из раствора [Ag(NH3)2]NO3, но не осаждает его из раствора K[Ag(CN)2]. Каково соотношение констант нестойкости ионов [Ag(NH3)2]+ и [Ag(CN)2]-? 28. Можно ли разрушить комплексный ион [Cu(NH3)4]2+ добавлением сульфида натрия, если 29. Почему, в отличие от FeCl3, K3[FeCl6] практически не гидро-лизуется? 30. Какие комплексные соединения называют хелатами? Какие внутрикомплексными? Что такое комплексоны? Приведите примеры. 31. На чем основано комплексонометрическое титрование? Как фиксируют точку эквивалентности в комплексонометрии? 32. Что является комплексообразователем в гемоглобине, миогло-бине, хлорофилле, витамине B12? 33. Какие металлы и как участвуют в процессах клеточного метаболизма? 34. Какие комплексоны используют для выведения из организма тяжелых металлов? Варианты задач для самостоятельного решения Вариант №1 1. К раствору, содержащему 2,335 г комплексной соли CoCl3×4NH3, добавили избыток нитрата серебра. При этом выпало 1,435 г белого осадка. Установить координационную формулу соеди-нения, если координационное число кобальта равно 6. Какие типы изомерии возможны для данного комплексного соединения? 2. Рассчитать концентрации всех ионов и молекул в растворе [Ag(NH3)2]Cl с молярной концентрацией комплексной соли 0,001 моль/л, если 3. Найти концентрации катионов натрия и алюминия в растворе Nа[Al(ОН)4] с молярной концентрацией соли 0,02 моль/л, содержащем 0,16 г гидроксида натрия в 400 мл этого раствора, если 4. Вычислить изменение энергии Гиббса для процесса диссоциации комплексного иона [HgCl4]2- при 200С, если Вариант №2 1. Для осаждения хлорид-ионов из 150 мл раствора CrCl3×6H2O с молярной концентрацией комплекса 0,01 моль/л потребовалось 15 мл раствора нитрата серебра с C(AgNO3) = 0,3 моль/л. Установить координационную формулу комплексного соединения, если коорди-национное число хрома равно 6. Какие типы изомерии возможны для данного комплексного соединения? 2. Рассчитать концентрацию ионов Al3+ в растворе Na3[AlF6] с молярной концентрацией 0,01 моль/л. Определить, как и во сколько раз изменится концентрация ионов Al3+ при добавлении к 0,5 л раствора 2,1 г NaF. 3. Найти концентрации катионов цинка и лития в растворе Li2[Zn(ОН)4] с молярной концентрацией 0,15 моль/л, содержащем 0,48 г гидроксида лития в 500 мл этого раствора, если 4. Диссоциация комплексного иона [Ag(NH3)2]+ при 250С сопровождается изменением энергии Гиббса DG0 = 41,2 кДж/моль. Рассчитать величины Вариант №3 1. Образец комплексного соединения состава PtCl4∙6H2O и массой 445 г был высушен в эксикаторе до постоянной массы, которая составила 427 г. Установить координационную формулу соединения, если координационное число платины равно 6. Написать формулы сольватных изомеров этого комплекса. 2. Имеется раствор комплексной соли [Ni(NH3)6]Cl2 с молярной концентрацией 0,01 моль/л, в 50 мл которого дополнительно содержится 0,085 г аммиака. Рассчитать массу ионов Ni2+ в 5 л этого раствора, если 3. Рассчитать концентрации катионов золота и анионов брома в растворе [Аu(NН3)2]Br с молярной концентрацией 0,06 моль/л, содержащем 1,36 г аммиака в 750 мл этого раствора, если 4. Вычислить изменение энергии Гиббса для процесса образования комплексного иона [Bi(SCN)6]3- при 150С, если Вариант №4 1. Рассчитать объем раствора AgNO3 с С(AgNO3) = 0,2 моль/л, который потребуется для осаждения хлорид-ионов комплексного соединения CoCl3×5H2O из 200 мл раствора с молярной концентра-цией комплексной соли 0,001 моль/л, если координационное число кобальта равно 6 и комплекс не содержит воду во внешней сфере. Написать формулы сольватных изомеров этого комплекса. 2. Рассчитать концентрации всех ионов в растворе K3[Cu(CN)4] с молярной концентрацией комплексной соли 0,01 моль/л, если 3. Найти концентрации катионов натрия и галлия в растворе Nа3[Ga(ОН)6] с молярной концентрацией 0,19 моль/л, содержащем 16 г гидроксида натрия в 900 мл этого раствора, если 4. Диссоциация комплексного иона [Cd(NH3)4]2+ при 250С сопровождается изменением энергии Гиббса DG0 = 37,3 кДж/моль. Рассчитать величины Вариант №5 1. К раствору, содержащему 0,1 моль комплексной соли CrCl3×6H2O, добавили избыток нитрата серебра. При этом выпало 28,7 г белого осадка. Установить координационную формулу соединения, если координационное число хрома равно 6. Написать формулы сольватных изомеров этого комплекса. 2. Найти соотношение концентраций ионов комплексообразо-вателей в растворах [Ag(NH3)2]+ и [Ag(CN)2]- с равными концентра-циями комплексных ионов, если значения констант нестойкости, соответственно, равны 5,9·10-8 и 1,1·10-21. 3. Вычислить концентрации катионов ртути и нитрат-ионов в растворе [Нg(NН3)4](NО3)2 с молярной концентрацией 0,05 моль/л, содержащем 0,02 г аммиака в 150 мл этого раствора, если 4. Вычислить изменение энергии Гиббса для процесса диссоциации комплексного иона [Сd(CN)4]2- при 250С, если Вариант №6 1. К раствору, содержащему осадок AgCl массой 14,35 г, добавили избыток KCN и наблюдали растворение осадка. Установить координационную формулу образующегося комплексного соедине-ния, если комплекс не является смешанным и имеет линейное строение. Найти минимальную массу KCN, которая была израс-ходована для растворения осадка. 2. Имеется раствор комплексной соли K2[Cd(CN)4] с молярной концентрацией 0,01 моль/л, в 100 мл которого дополнительно содержится 0,65 г KCN. Рассчитать массу ионов Cd2+ в 20 л этого раствора, если 3. Определить концентрации катионов серебра и нитрат-ионов в растворе [Ag(NH3)2]NO3 с молярной концентрацией 0,08 моль/л, содержащем 0,68 г аммиака в 550 мл этого раствора, если 4. Диссоциация комплексного иона [Co(NH3)4]2+ при 250С сопровождается изменением энергии Гиббса DG0 = 28,9 кДж/моль. Рассчитать величины Вариант №7 1. Образец комплексного соединения состава CrCl3∙6H2O массой 26,65 г был высушен в эксикаторе до постоянной массы, которая составила 24,85 г. Установить координационную формулу соедине-ния, если координационное число хрома равно 6. Написать формулы сольватных изомеров этого комплекса.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.129.19 (0.194 с.) |
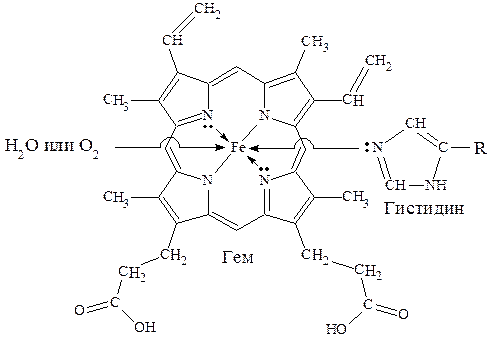

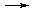 Fe3+,
Fe3+,


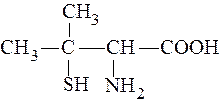
 .
.
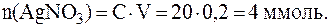


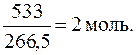
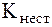 (K3[Fe(CN)6]) = 1,3·10−44.
(K3[Fe(CN)6]) = 1,3·10−44.

 .
. .
. .
.

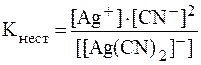
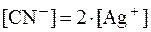 ;
; .
. .
.
 .
.
 .
.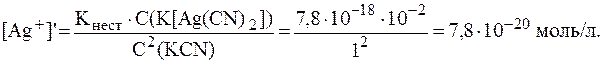

 .):
.):

 ,
,

 ([НgI4]2-) = 6,7·1029.
([НgI4]2-) = 6,7·1029.





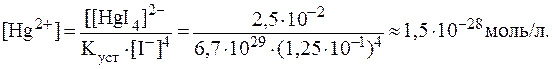

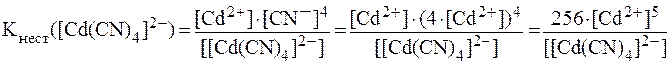
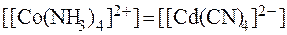 получим:
получим: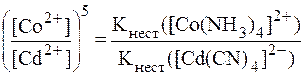 .
.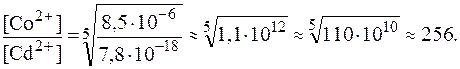
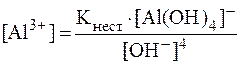 .
.



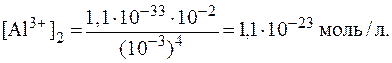

 .
.
 означает, что диссоциация комплексного иона [Cd(CN)4]2- при стандартной температуре возможна лишь в очень незначительной степени.
означает, что диссоциация комплексного иона [Cd(CN)4]2- при стандартной температуре возможна лишь в очень незначительной степени. .
.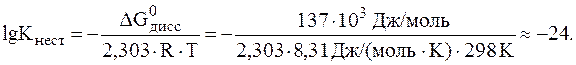


 , [Ag(SCN)2]- и [Ag(NО2)2]- соответственно равны 1,1·10-21, 5,8·10-8, 2,1·10-11, 1,3·10-3. Указать в каком растворе, содержащем эти ионы (при одинаковой молярной концентрации), находится больше (меньше) ионов серебра.
, [Ag(SCN)2]- и [Ag(NО2)2]- соответственно равны 1,1·10-21, 5,8·10-8, 2,1·10-11, 1,3·10-3. Указать в каком растворе, содержащем эти ионы (при одинаковой молярной концентрации), находится больше (меньше) ионов серебра. ([Cu(NH3)4]2+) = 2,1×10-13,
([Cu(NH3)4]2+) = 2,1×10-13,  = 6,0×10-36?
= 6,0×10-36?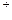 ) = 1,7·107.
) = 1,7·107.


