
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическая роль буферных систем
Буферные системы крови Нормальное значение рН крови составляет 7,40 ± 0,05. Это означает, что значения активной кислотности а (Н+) должны нахо-диться в интервале от 3,7×10-8 до 4,0×10-8 моль/л. Присутствующие в крови электролиты (НСО3–, Н2СО3, Н2РО4–, НРО42–, белки, аминокис-лоты) диссоциируют в такой степени, что активность а (Н+) находится в рамках приведенного выше диапазона. Однако в ряде физиологических процессов в кровь поступают вещества в количествах, достаточных для того, чтобы вызвать заметные отклонения рН крови от нормы. Наиболее сложной и часто встречаемой причиной нарушения кислотно-основного равновесия крови является ацидоз. Различают две формы ацидоза: газовую и метаболическую. Газовая форма ацидоза обычно бывает вызвана увеличением парциального давления СО2 в плазме крови. Метаболическая форма ацидоза отражает такое состояние, когда кислые метаболиты уже проникли в ткани и вызвали стойкую гипоксию (снижение содер-жания О2). Способы подавления этих форм ацидоза в плазме и клетках крови различны, поэтому целесообразно отдельно рассмот-реть процессы, протекающие в этих составляющих крови. Плазма крови Кислотно-основное равновесие в плазме крови человека в основном обеспечивается гидрокарбонатной, фосфатной, белковой и аминокислотной буферными системами. 1. Гидрокарбонатная буферная система. В плазме крови наиболее важной буферной системой в поддер-жании постоянства рН является гидрокарбонатная Н2СО3/НСО3-. Особенность этой буферной системы заключается в том, что один из ее компонентов - угольная кислота Н2СО3 - образуется при взаимо-действии растворенного в воде СО2 с водой: CO2(р-р) + H2O ⇄ Н2СО3 Концентрация растворенного СО2 определяется равновесием: CO2(р-р) ⇄ CO2(газ), которое описывается законом Генри:
где S - постоянная Генри [моль/(л∙давление)]; P - парциальное давление CO2, [атм; Па; мм рт. ст.]. Таким образом, в плазме крови устанавливается равновесие: CO2 + H2O ⇄ Н2СО3 ⇄ H+ + НСО3- Диссоциация угольной кислоты по первой ступени описывается уравнением:
В стандартных условиях Учитывая довольно низкую растворимость CO2 в воде [S = 0,033 ммоль/(л∙мм рт. ст.)], в физиологических условиях весь CO2, растворенный в плазме крови, рассматривают как гидратиро-ванный до Н2СО3, поэтому выражение для
Отсюда Так как концентрация Н2СО3 в гидрокарбонатной буферной си-стеме зависит от парциального давления СО2 в газовой фазе, значение рН гидрокарбонатного буфера в конечном счете определяется кон-центрацией ионов НСО3- в растворе и парциальным давлением СО2:
Гидрокарбонатная буферная система действует как эффективный физиологический буфер вблизи рН = 7,4. В этих условиях отношение концентраций компонентов в гидрокарбонатной системе составляет:
Таким образом, в плазме крови в норме отношение концентраций компонентов в системе сопряженного основания НСО3- и угольной кислоты Н2СО3 составляет примерно 20:1. Вследствие того, что концентрация NaHCO3 в крови значительно превышает концен-трацию Н2СО3, буферная емкость этой системы по кислоте (40 ммоль/л плазмы крови) значительно выше, чем по щелочи (1-2 ммоль/л плазмы крови). В норме парциальное давление СО2 в крови составляет 5,3 кПа (40 мм. рт. ст.) и содержание СО2 в плазме не достигает максималь-ной величины, определяемой растворимостью газа. Поэтому избыток СО2 в атмосфере приводит к дополнительному растворению СО2 в крови, что в соответствии с уравнением (11) может сопровождаться снижением рН крови и вызывать газовую форму ацидоза:
Между СО2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается равновесие:
При поступлении в кровь, протекающую через сосуды тканей, кислот - доноров Н+ - равновесие «3» в соответствии с принципом Ле Шателье смещается в сторону образования молекул Н2СО3. При этом концентрация Н2СО3 повышается, а концентрация ионов НСО3- соответственно понижается. В свою очередь, повышение концентра-ции Н2СО3 приводит к смещению равновесия «2» в сторону образования СО2 при разложении Н2СО3, т.е. к увеличению концен-трации растворенного в плазме СО2. В результате равновесие «1» смещается в сторону образования газообразного СО2, что приводит к повышению давления СО2 в легких и выведению последнего за счет изменения объема легочной вентиляции. При поступлении в кровь оснований - акцепторов Н+ - сдвиг рав-новесий происходит в обратной последовательности: равновесие «3» смещается в сторону усиления диссоциации Н2СО3, т.е. уменьшения ее концентрации, что в свою очередь смещает равновесие «2», а затем и равновесие «1» вправо и сопровождается растворением в плазме крови дополнительного количества СО2(газ), содержащегося в легких.
В результате рассмотренных процессов гидрокарбонатная систе-ма крови быстро приходит в равновесие с СО2 в альвеолах и эффекти-вно обеспечивает поддержание постоянства рН плазмы крови. Гидрокарбонатная буферная система крови способна компенси-ровать и не только газовую, но и другие формы ацидоза, возникаю-щие в процессах жизнедеятельности организма. Так, избыток молоч-ной кислоты HLac, образующийся в результате интенсивной физичес-кой нагрузки, также нейтрализуется ионом НСО3-: HCO3- + HLac ⇄ Lac- + H2CO3 ⇄ H2O + CO2(p-p) ⇄ СО2(газ) Гидрокарбонатная буферная система, обеспечивая около 55% всей буферной емкости крови, является основной буферной системой плазмы крови и содержится также в эритроцитах, интерстициальной жидкости, почечной ткани. 2. Фосфатная буферная система. В поддержании постоянства рН плазмы принимает участие и фосфатная буферная система, состоящая из слабой кислоты Н2РО4- и сопряженного основания НРО42-. Фосфатная буферная система спо-собна поддерживать постоянство рН в интервале 6,2-8,2 и обеспечи-вает значительную долю буферной емкости крови. Для фосфатной буферной системы уравнение Гендерсона-Гассельбаха выглядит так:
Подставив физиологическое значение
Отсюда:
Таким образом, соотношение концентраций Na2HPO4 и NaH2PO4 в фосфатной буферной системе крови приблизительно равно 4, поэтому фосфатная буферная система имеет более высокую емкость по кислоте, чем по щелочи и более эффективно нейтрализует кислые метаболиты плазмы крови, например молочную кислоту и продукты переработки мясной пищи: НРО42- + HLac ⇄ Н2РО4- + Lac- Образующееся в результате нейтрализации избыточное количест-во дигидрофосфат-иона H2PO4- выводится почками. Однако, в отличие от гидрокарбонатной буферной системы, различия буферной емкости фосфатной системы по кислоте и по щелочи не столь существенны. Эти величины составляют: Фосфатная буферная система менее мощная, чем гидрокарбонат-ная, что объясняется малым содержанием фосфатов в плазме крови. Фосфатная буферная система содержится также в тканях, особенно в почках, и внутри клеток, например, в эритроцитах. 3. Белковая буферная система. Белковая буферная система представляет собой совокупность альбуминов и глобулинов - белков, составляющих основную часть плазмы крови (~90%). Изоэлектрические точки этих белков лежат в интервале значений рН = 4,9-6,3, т. е., в слабокислой среде. Поэтому в физиологических условиях (при рН = 7,4) белки находятся преимущественно в формах «белок-основание» и соль «белка-основания». Соответствующее кислотно-основное равновесие:
смещено в сторону преобладания формы «белок-основание». Буферная емкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протонакцепторных групп. Эта система может нейтрали-зовать как кислые, так и основные продукты. Однако вследствие преобладания формы «белок-основание», ее буферная емкость значи-тельно выше по кислоте и составляет: для альбуминов
4. Аминокислотная буферная система. Буферная емкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связано с тем, что почти все аминокислоты имеют значения Таким образом, мощность буферных систем плазмы крови уменьшается в ряду:
гидрокарбонатная > белковая > фосфатная > аминокислотная Эритроциты Во внутренней среде эритроцитов норме соответствует рН = 7,25. Здесь также действуют гидрокарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах большую роль играет белковая система гемоглобин-оксигемоглобин, на долю которой приходится около 75% всей буферной емкости крови. Гемоглобин является слабой кислотой ( HHb ⇄ H+ + Hb- При физиологическом значении рН = 7,25 этот описывается уравнением Гендерсона-Гассельбаха:
из которого видно, что:
Таким образом, при рН = 7,25 кислота HHb диссоциирована только на 10% и концентрация солевой формы гемоглобина (Hb-) значительно меньше, чем концентрация кислоты (HHb). Система HHb/Hb- может активно нейтрализовать кислые и основные продукты метаболизма, однако обладает более высокой емкостью по щелочи, чем по кислоте. В легких гемоглобин реагирует с кислородом. При этом образуется оксигемоглобин HHbО2: HHb + O2 ⇄ HHbО2, который переносится артериальной кровью в капиллярные сосуды, откуда кислород попадает в ткани. Оксигемоглобин - слабая кислота ( HHbО2 ⇄ H+ + HbО2- соответствует уравнение Гендерсона-Гассельбаха:
Отсюда можно заключить, что С(HbО2-)/С(HHbО2) = 2:1 и доля продиссоциировавших молекул HHbО2 составляет примерно 65%. При добавлении кислот нейтрализовать ионы H+ в первую очередь будут анионы гемоглобина Hb-: Hb- + H+ ⇄ HHb, так как они имеют большее сродство к протону, чем ионы HbO2-.
При действии оснований в первую очередь будет реагировать более сильная кислота оксигемоглобин HHbO2: HHbO2 + OH- ⇄ HbO2- + H2O, однако и кислота гемоглобин также будет участвовать в нейтрализации поступающих в кровь ионов OH-: HHb + OH- ⇄ Hb- + H2O. Система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболического СО2), так и в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом. В организме человека все буферные системы взаимосвязаны. Так, в эритроцитах гемоглобин-оксигемоглобиновая буферная система тесно связана с гидрокарбонатной буферной системой. Поскольку внутри эритроцитов рН равен 7,25, то соотношение концентраций соли (НСО3-) и кислоты Н2СО3 здесь несколько меньше, чем в плазме крови. Действительно, из уравнения Гендерсона-Гассельбаха следует, что в эритроцитах C(НСО3-)/С(Н2СО3) = 14:1. Тем не менее, несмотря на то, что буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН. Фосфатная буферная система играет в клетках крови гораздо более важную роль, чем в плазме крови. Прежде всего это связано с тем, что в эритроцитах содержится большое количество неорганичес-ких фосфатов, главным образом, KH2PO4 и K2HPO4. Кроме того, большую роль в поддержании постоянства рН имеют эфиры фосфорных кислот - главным образом, фосфолипиды, составляющие основу мембран эритроцитов. Фосфолипиды являются относительно слабыми кислотами. Значения В случаях, когда буферная и выделительная защита организма исчерпывает свои возможности и развивается тяжелая форма ацидоза (алкалоза), прибегают к медикаментозному подавлению этих наруше-ний. Так, при газовой форме ацидоза внутривенно вводят препараты основного характера, представляющие собой соли слабых кислот: 4%-й раствор NaHCO3, раствор натриевой соли лимонной кислоты - цитрат натрия (Na3Cit) и др., которые нейтрализуют избыточную кислотность, связывая ионы H+ в слабые кислоты: H+ + HCO3- Ликвидацию метаболической формы ацидоза также проводят пу-тем введения солей слабых кислот и других препаратов, обладающих свойством проходить через фосфолипидные мембраны. При алкалозе вводят растворы слабых кислот, например, 4%-й раствор аскорбиновой кислоты. Однако перечисленные методы медикаментозного вмешательства не имеют, строго говоря, лечебного эффекта: они позволяют лишь «выиграть время» для более детального установления причин возник-новения отклонений и назначения курса лечения или профилактики.
Буферные системы слюны Поддержание постоянства pH слюны в пределах нормы (6,35-6,85) обеспечивается, главным образом, тремя буферными системами: гидрокарбонатной, фосфатной и белковой. Главную роль в нейтрализации кислотно-основных метаболитов играет гидрокарбо-натная буферная система, которая обеспечивает 80% буферной емкости слюны. Второй по значимости является фосфатная система, третьей - белковая. Буферная емкость слюны может варьировать и зависит от характера питания, состояния желудочно-кишечного тракта и других факторов. Эталоны решения задач 1. Вычислить рН буферного раствора, в 100 мл которого содержится 1,2 г уксусной кислоты и 5,88 г ацетата калия, если для уксусной кислоты Решение. Молярные концентрации кислоты и соли в буферном растворе равны:
Подставив эти значения в уравнение (7), получим:
2. Рассчитать рН буферной смеси, если для ее приготовления были взяты растворы муравьиной кислоты и формиата натрия одинаковой молярной концентрации в соотношении 7:3. Решение. Так как молярные концентрации кислоты и соли равны, то при расчете pH по формуле (5) можно использовать только объемное соотношение компонентов:
3. Рассчитать значение pH буферного раствора, полученного при сливании 20 мл раствора аммиачной воды с С(NH3·H2O) = 0,02 моль/л и 10 мл раствора хлорида аммония с С(NH4Cl) = 0,01 моль/л. Решение. В случае буферной системы II типа pH раствора рассчитывают по уравнению (6¢):
Подставив соответствующие значения, получим:
При разбавлении рН буферных растворов не изменяется. Следовательно, рН буферного раствора, разбавленного в 5 раз, будет равен 9,86. 4. Буферный раствор получен сливанием 100 мл раствора СН3СООН с С(СН3СООН) = 0,02 моль/л и 50 мл раствора CH3COONa с С(CH3COONa) = 0,01 моль/л. а) рН полученного буфера; б) изменение рН буфера при добавлении 5 мл раствора HCl c C(HCl) = 0,01 моль/л. в) буферную емкость раствора по щелочи. Решение. Для расчета рН полученного буфера воспользуемся формулой (5):
При добавлении кислоты протекает реакция: СН3СОONa + HCl в результате которой изменяются количества компонентов буферной системы. С учетом соотношения n(x) = C(x)×V(x) уравнение (7) может быть представлено в виде:
Так как количества прореагировавших и образовавшихся веществ равны, то изменение количеств кислоты и соли в буферном растворе составит одну и туже величину x:
В исходной буферной смеси количества компонентов составляют:
Найдем величину x:
Отсюда:
Таким образом, разность значений рН составит Буферная емкость раствора по щелочи определяется количеством эквивалента щелочи n( Следовательно, после добавления NaOH:
При добавлении щелочи протекает реакция: СН3СОOH + NaOH в результате которой изменяется количество компонентов буферного раствора:
где x - количество NaOH. Отсюда:
Решая полученное уравнение, получим: x» 1,3 ммоль. Подставляя значения n(NaOH) = 1,3 ммоль, V(буфера) = 0,15 л и DpH = 1 в уравнение (9), получим:
5. Рассчитать, объемы растворов Na2HPO4 и NaH2PO4 одинаковой молярной концентрации, которые необходимо взять для приготовле-ния 300 мл буферного раствора с pH = 7,5. Для фосфорной кислоты: Решение. В фосфатном буферном растворе протолитическое равновесие имеет вид: H2PO4– ⇄ HPO42- + H+, поэтому с учетом равных концентраций компонентов уравнение (5) запишется:
Подставляя значения pH и
Отсюда:
Решая систему уравнений:
получим: V0(Na2HPO4) = 200 мл и V0(NaH2PO4) = 100 мл.
6. Найти объем раствора ацетата натрия с С(CH3COONa) = 0,04 моль/л, который надо добавить к 500 мл раствора уксусной кислоты с С(CH3COOH) = 0,1 моль/л, чтобы получить буферный раствор с рН = 3,74, если Решение. Используя уравнение (7), получим:
Отсюда:
7. Найти массу гидрофосфата калия, которую надо добавить к 1500 мл раствора дигидрофосфата калия с С(KH2PО4) = 0,4 моль/л, чтобы приготовить буферный раствор c рН = 6,5. Решение. В данном случае формула (5) принимает вид:
Отсюда:
8. Буферный раствор приготовили смешиванием 50 мл раствора уксусной кислоты с концентрацией 0,1 моль/л и 80 мл раствора гидроксида калия с концентрацией 0,05 моль/л. Определить рН полученного раствора, если Решение. В процессе приготовления раствора протекает реакция нейтрали-зации кислоты щелочью: СН3СООН + КOH Количества взятых для реакции реагентов составляют:
Количества прореагировавших между собой реагентов равны, поэтому количество оставшейся после реакции кислоты:
Количество образовавшейся соли равно количеству прореагиро-вавших реагентов и составляет 0,004 моль. Используя уравнение (5), получаем:
9. Найти объем раствора гидроксида калия с концентрацией 0,05 моль/л, который надо прилить к 50 мл раствора муравьиной кислоты с концентрацией 0,1 моль/л, чтобы получить буферный раствор с рН = 4. Решение. Используя уравнение Гендерсона-Гассельбаха получаем:
Следовательно:
Количества взятых для реакции реагентов составляют:
Количество прореагировавших реагентов равны между собой, поэтому количество оставшейся после реакции кислоты:
Количество образовавшейся соли равно количеству прореагиро-вавших реагентов и составляет 0,05 х моль. Таким образом:
Решая уравнение, получаем:
10. На титрование 50 мл буферного раствора с рН = 7,0 в присут-ствии индикатора HInd с Решение. В соответствии с теорией кислотно-основных индикаторов, в точке перехода окраски индикатора рН = Тогда:
11. Буферная емкость гидрокарбонатной буферной системы по щелочи составляет 20 ммоль/л. Найти изменение pH буфера при добавлении к 100 мл буферного раствора 10 мл раствора KOH с С(KOH) = 0,1 моль/л. Решение. Изменение pH буфера найдем по формуле (9):
11. На титрование 50 мл фосфатного буфера, содержащего рав-ные количества Na2HPO4 и NaH2PO4, в присутствии индикатора HInd с Решение. Значение рН буфера до титрования найдем по уравнению Гендерсона-Гассельбаха. Поскольку количества компонентов равны:
В соответствии с теорией кислотно-основных индикаторов, в точке перехода окраски индикатора рН = Тогда:
12. Рассчитать буферную емкость крови, если добавление к 50 мл крови 20 мл раствора HCl c C(HCl) = 0,05 моль/л вызвало снижение pH крови от 7,4 до 7,0. Решение. Буферную емкость крови по кислоте рассчитаем по формуле (8):
13. Определить, какие изменения произойдут в плазме крови человека, если парциальное давление СО2 над кровью увеличится на 10 мм рт. ст. по сравнению с нормой. Норме соответствуют значе-ния: pH = 7,4; С(НСО3-) = 24 ммоль/л; Решение. Самая мощная буферная система крови - гидрокарбонатная. Она первой реагирует на изменения, происходящие в плазме крови и в эритроцитах. Таким образом, pH плазмы крови в указанных условиях можно рассчитать по уравнению (11):
Незначительное снижение pH плазмы крови по сравнению с нормой свидетельствует о газовой (дыхательной) форме ацидоза. 14. Определить, какого типа буферная система находится в растворе валина, 1 л которого содержит 0,2 моль катионной формы и 0,4 моль биполярной формы. Рассчитать pH раствора, если для валина Решение. В данном случае раствор валина представляет собой буферную систему I типа: катионная форма является слабой кислотой, а биполярный ион - сопряженным основанием. Равновесию между катионной и биполярной формами валина отвечает константа
15. Определить, какого типа буферная система образуется при добавлении к 50 мл раствора аланина с молярной концентрацией 0,1 моль/л 20 мл раствора NaOH с С(NaOH) = 0,05 моль/л. Рассчитать рН раствора, если для аланина Решение. В водном растворе аланин присутствует преимущественно в виде биполярного иона. При добавлении щелочи от группы -NH3+ биполярного иона аланина отщепляется протон и образуется форма «белок-основание»:
Таким образом, образуется буферная система II типа - слабое основание и его катион В/ВН+. Количества взятых для реакции реагентов составляют:
Количества прореагировавших между собой реагентов равны, поэтому количество аланина в форме биполярного иона (кислоты в уравнении Гендерсона-Гассельбаха) равно:
а количество сопряженного основания (формы «белок-основание»):
Равновесию соль «белка-основания»
16. Найти соотношение форм глутамина при физиологических условиях (рН = 7,4), если для этой a-аминокислоты: Решение. Найдем величину pI глутамина:
Так как pH > pI, то в растворе присутствуют анионная («белок-основание») и биполярная (соль «белка-основания») формы (буферная система II типа). Их соотношение определяется по уравнению Гендерсона-Гассельбаха:
Таким образом, соотношение форм аминокислоты составляет 50:1. При таком соотношении количеств компонентов система буферного действия не проявляет. Вопросы для самоконтроля 1. Что такое буферная система? 2. Что такое буферный раствор? 3. Что называется буферным действием? 4. Какие вам известны основные типы буферных систем? Приведите примеры. 5. Какие компоненты содержат буферные системы с точки зрения протолитической теории? 6. В чем заключается механизм действия буферных систем? Рассмотрите в качестве примеров ацетатную и аммонийную буферные системы. 7. Что называется буферной емкостью? От каких факторов зависит буферная емкость? 8. Как определяют величины буферной емкости по кислоте ( 9. Запишите уравнение Гендерсона-Гассельбаха в общем виде, а также для ацетатной, гидрокарбонатной, фосфатной и аммиачной буферных систем. 10. От чего зависит величина рН буферных растворов? 11. Что такое зона буферного действия? Как она определяется? 12. Какие буферные системы поддерживают постоянство кислотно-основного равновесия плазмы крови? Какова их буферная емкость по кислоте и по щелочи? 13. Какие буферные системы поддерживают постоянство кислотно-основного равновесия внутри эритроцитов? Какова их буферная емкость по кислоте и по щелочи? 14. Что такое алкалоз и ацидоз? Как можно ликвидировать газовую и метаболическую формы ацидоза? 15. Какие количественные показатели характеризуют буферные свойства крови? 16. К 10 мл ацетатного буфера с рН = 6 добавили 90 мл воды. Чему равен рН раствора после разбавления? Изменилась ли буферная емкость системы после добавления воды? 17. Ацетатные буферные системы получены смешиванием: 1) 1 мл раствора кислоты с С(к-ты) = 0,1 моль/л и 9 мл раствора соли с С(соли) = 0,1 моль/л; 2) 1 мл раствора кислоты с С(к-ты) = 0,01 моль/л и 9 мл раствора соли с С(соли) = 0,01 моль/л. Будет ли отличаться окраска растворов при добавлении индика-тора метилрот? 18. Для приготовления буферных растворов использовали: 1) 7 мл раствора NН3·Н2О с С(NH3·Н2О) = 0,2 моль/л и 3 мл раствора NН4С1 с С(NH4Cl) = 0,2 моль/л); 2) 5 мл раствора NН3·Н2О с С(NН3·Н2О) = 0,2 моль/л и 5 мл раствора NH4C1 с С(NH4Cl) = 0,2 моль/л. Какой из приготовленных растворов имеет большую буферную емкость? 19. Можно ли приготовить буферную смесь: 1) аммиачную с рН = 7; 9; 11, если 2) ацетатную с рН = 2; 4; 8, если 3) гидрокарбонатную с рН = 5; 7; 9, если 4) фосфатную буферную смесь с рН = 1; 4; 7, если 20. Исходные растворы компонентов аммиачной буферной системы одинаковой молярной концентрации смешаны в следующих соотношениях:
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться: 1) наибольшее значение рН; 2) максимальная буферная емкость; 3) наибольшая буферная емкость по щелочи. Варианты задач для самостоятельного решения Вариант № 1 1. Фосфатный буфер приготовили, смешав 20 мл раствора NaH2PO4 с С(NaH2PO4) = 0,01 моль/л и 30 мл раствора Na2HPO4 с С(Na2HPO4) = 0,03 моль/л. Рассчитать рН полученного раствора, если 2. Определить, в каком объемном соотношении следует смешать растворы аммиачной воды и хлорида аммония одинаковой молярной концентрации, чтобы получить буферный раствор с рН = 10, если 3. На титрование 20 мл буферного раствора с рН = 7 в присут-ствии индикатора HInd ( 4. Определить, какого типа буферная система находится в растворе глицина, 1 л которого содержит 0,3 моль катионной формы и 0,15 моль биполярной формы. Рассчитать pH раствора, если для глицина Вариант №2
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.251.154 (0.194 с.) |
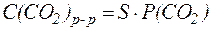 ,
,
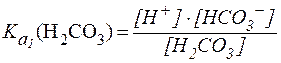
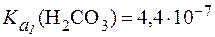 , соответственно
, соответственно 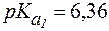 .
.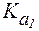 имеет вид:
имеет вид: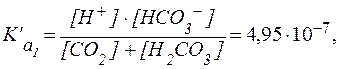
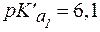 .
.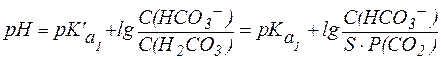 .
.
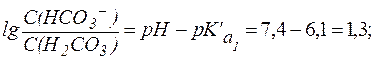
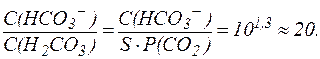
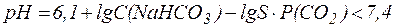
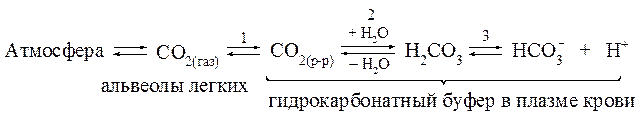
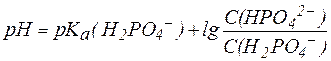 .
.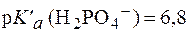 и значение рН крови в норме, равное 7,4, получим:
и значение рН крови в норме, равное 7,4, получим: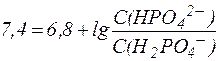 .
.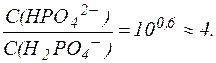
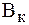 = 1-2 ммоль/л,
= 1-2 ммоль/л, 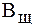 = 0,5 ммоль/л.
= 0,5 ммоль/л.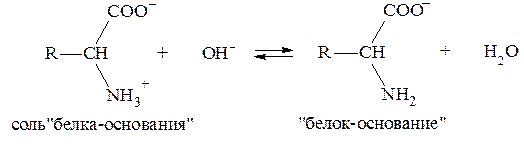
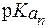 , заметно отличающиеся от 7,4. Поэтому при физиологическом значении рН = 7,4 их мощность мала. Практически только одна аминокислота - гистидин (
, заметно отличающиеся от 7,4. Поэтому при физиологическом значении рН = 7,4 их мощность мала. Практически только одна аминокислота - гистидин (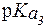 = 6,0) - обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
= 6,0) - обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
 = 8,2) и диссоци-ирует по уравнению:
= 8,2) и диссоци-ирует по уравнению: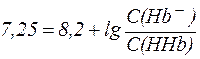 ,
,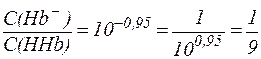 .
.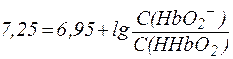 .
. H2CO3
H2CO3 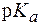 = 4,74.
= 4,74.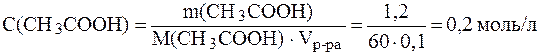 ;
;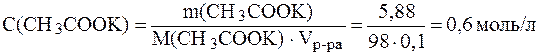 .
.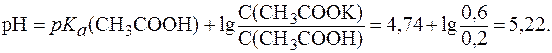
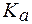 (НСООН) = 1,8×10-4.
(НСООН) = 1,8×10-4.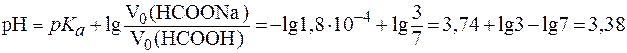 .
.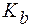 (NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.
(NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.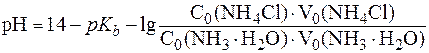 .
.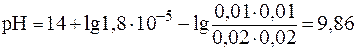 .
.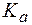 (СН3СООН) = 1,8×10-5. Рассчитать:
(СН3СООН) = 1,8×10-5. Рассчитать: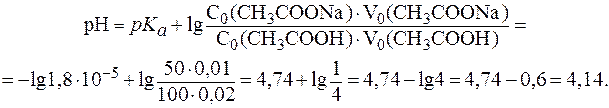
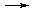 CH3COOH + NaCl,
CH3COOH + NaCl,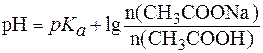 .
.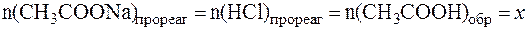 ,
,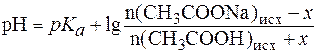 .
.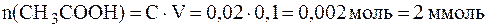 ;
;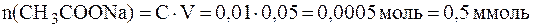 .
.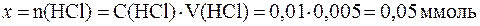 .
.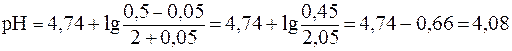 .
. , т.е. изменение рН пренебрежимо мало.
, т.е. изменение рН пренебрежимо мало.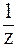 x) (для однокислотного основания - n(x)), добавление которого к 1 л раствора увеличивает pH раствора на 1 единицу.
x) (для однокислотного основания - n(x)), добавление которого к 1 л раствора увеличивает pH раствора на 1 единицу.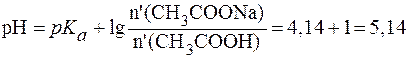 .
.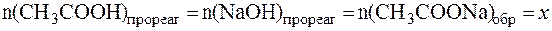 ;
;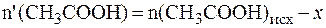 ;
;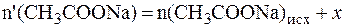 ,
,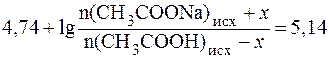 ;
;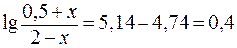 ;
;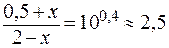 .
.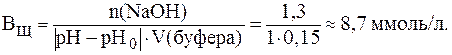
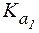 = 7,6×10-3;
= 7,6×10-3; 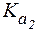 = 6,2×10-8,
= 6,2×10-8, 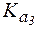 = 3,3×10-13.
= 3,3×10-13.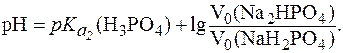
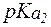 , получим:
, получим: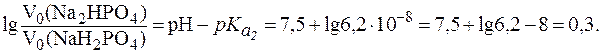

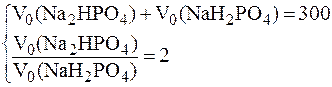
 (СН3СООН) = 4,74.
(СН3СООН) = 4,74.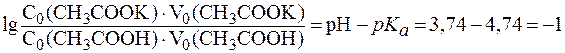 .
.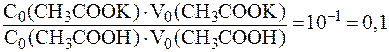 ;
;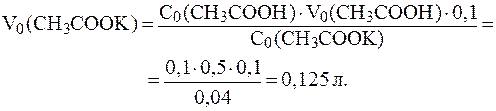
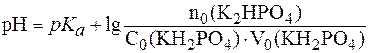 .
.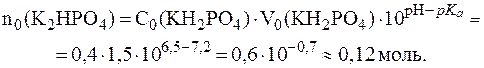
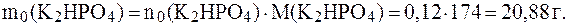
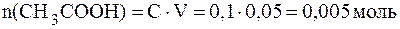 ;
;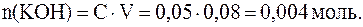
 .
.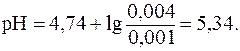
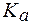 (НСООН) = 1,8∙10-4.
(НСООН) = 1,8∙10-4.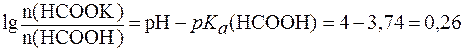 .
.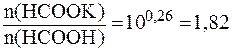 .
.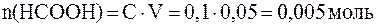 ;
;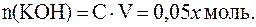
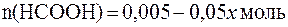 .
.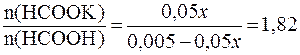 .
.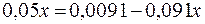 ;
;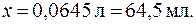
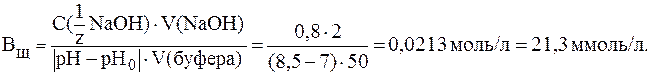
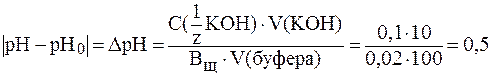 .
.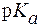 = 8,5 затрачено 2 мл раствора NaOH с С(NaOH) = 0,65 моль/л. Вычислить буферную емкость раствора, если
= 8,5 затрачено 2 мл раствора NaOH с С(NaOH) = 0,65 моль/л. Вычислить буферную емкость раствора, если 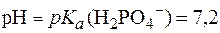 .
.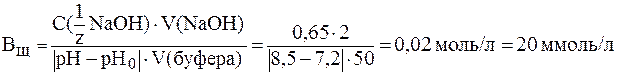 .
.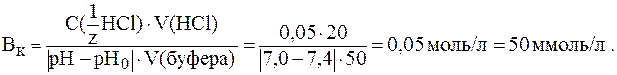
 Физио-логическое значение
Физио-логическое значение 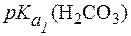 составляет 6,1.
составляет 6,1.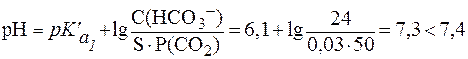 .
.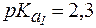 ,
, 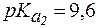 .
.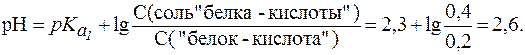
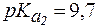 .
.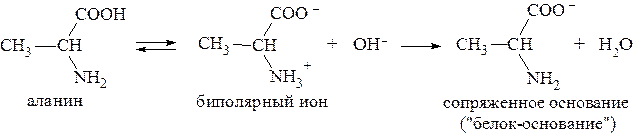
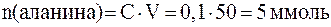 ;
;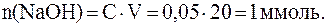
 .
.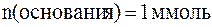 .
. «белок-основание» соот-ветствует константа
«белок-основание» соот-ветствует константа 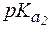 = 9,7, поэтому уравнение Гендерсона-Гассельбаха запишется:
= 9,7, поэтому уравнение Гендерсона-Гассельбаха запишется: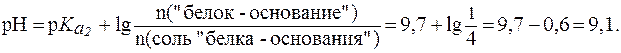
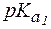 = 2,2;
= 2,2; 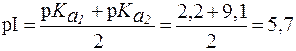 .
.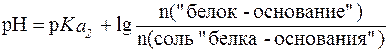
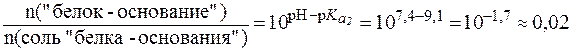 .
.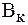 ) и по щелочи (
) и по щелочи (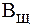 )? Для известных вам буферных систем укажите компонент, определяющий буферную емкость раствора по кислоте (по щелочи).
)? Для известных вам буферных систем укажите компонент, определяющий буферную емкость раствора по кислоте (по щелочи).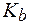 (NH3·H2O) = 1,8·10-5;
(NH3·H2O) = 1,8·10-5; (СН3СООН) = 1,8·10-5;
(СН3СООН) = 1,8·10-5;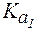 (Н2СО3) = 4,5·10-7;
(Н2СО3) = 4,5·10-7;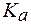 (Н2РО4-) = 6,3∙10-8.
(Н2РО4-) = 6,3∙10-8.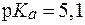 ) было затрачено 10 мл раствора кислоты с С(HCl) = 0,02 моль/л. Рассчитать буферную емкость раствора по кислоте.
) было затрачено 10 мл раствора кислоты с С(HCl) = 0,02 моль/л. Рассчитать буферную емкость раствора по кислоте.


