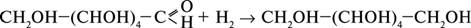Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы получения и химические свойства карбоновых кислот.
ПОЛУЧЕНИЕ.
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
46. Сложные эфиры, состав, строение, номенклатура, химические свойства, получение и применение. Сложные эфиры являются наиболее важными функциональными производными кислот с общей формулой R – CO – O – R’, т.е. их можно рассматривать как производные кислот, у которых гидроксил замещен алкоксильной группой. Изомерия сложных эфиров обусловлена строением радикалов, связанных с ацилатной группой
Сложные эфиры широко распространены в природе. Аромат многих цветов, плодов, ягод обусловлен присутствием в них сложных эфиров. Чрезвычайно распространены в растительном и животном мире относящиеся к сложным эфирам жиры. Эфиры низших одноатомных спиртов и низших кислот – летучие жидкости с приятным запахом цветов, ягод. Этилформиат имеет запах рома, изоамилацетат – запах груш, этилбутират – запах абрикосов, изоамилбутират – запах ананасов, бензилацетат – запах жасмина и др. Из-за их запаха эти эфиры используются в парфюмерной и пищевой промышленности как «фруктовые эссенции». Эти эфиры мало растворимы в воде, хорошо растворяются в органических растворителях, сами являются растворителями. Температуры кипения сложных эфиров ниже, чем у соответствующих кислот, так как им не присуща ассоциация. Важнейший способ получения сложных эфиров – взаимодействие карбоновых кислот со спиртами – реакция этерификации. RCOOH + R’OH ↔ RCOOR’ + H2O. Химические свойства 1. Реакция гидролиза или омыления. Как уже было сказано выше, реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате которой образуются исходные жирные кислоты и спирт: Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим: так как получающаяся карбоновая кислота со щелочью образует соль:
R – COOH + NaOH 2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород. 3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов: 4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты: R'-CO-OR" + NH3 Применение Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов.
47 . Жиры, состав, строение, номенклатура, химические свойства, получение и применение.
Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами — так же, как и сливочное масло. Состав жиров Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода (содержание «нечетных» кислотных радикалов в жирах обычно менее 0,1 %). Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и частично растворимы в этаноле (5—10 %)[1]. Природные жиры чаще всего содержат следующие жирные кислоты: Насыщенные: · стеариновая (C17H35COOH) · маргариновая (C16H33COOH) · пальмитиновая (C15H31COOH) · капроновая (C5H11COOH) · масляная (C3H7COOH) Свойства жиров Энергетическая ценность жира приблизительно равна 9,3 ккал на грамм, что соответствует 39 кДж/г. Таким образом, энергия, выделяемая при расходовании 1 грамма жира, приблизительно соответствует, с учетом ускорения свободного падения, поднятию груза весом 39000 Н (массой ≈ 4000 кг) на высоту 1 метр. При сильном взбалтывании с водой жидкие (или расплавленные) жиры образуют более или менее устойчивые эмульсии (см. гомогенизация). Природной эмульсией жира в воде является молоко.
Физические свойства
Жиры — вязкие жидкости или твёрдые вещества, легче воды. Их плотность колеблется в пределах 0,9—0,95 г/см³. В воде не растворяются, но растворяются во многих органических растворителях (бензол, дихлорэтан, эфир и др.) Номенклатура По тривиальной номенклатуре глицериды называют, добавляя окончание -ид к сокращенному названию кислоты и приставку, показывающую, сколько гидроксильных групп в молекуле глицерина проэтерифицировано. Химические свойства Гидролиз жиров Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло). Применение жиров · Пищевая промышленность (в частности, кондитерская). · Фармацевтика · Производство мыла и косметических изделий · Производство смазочных материалов
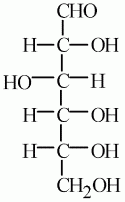
48 . Углеводы, классификация, номенклатура, химические свойства, получение и применение Углево́ды (сахара́, сахариды) — органические вещества, содержащие карбонильную группу и несколькогидроксильных групп. Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира, составляя (по массе) основную часть органического вещества на Земле. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями. Простые и сложные Все углеводы состоят из отдельных «единиц», которыми являются сахариды. По способности к гидролизу на мономеры углеводы делятся на две группы: простые и сложные. Углеводы, содержащие одну единицу, называются моносахариды, две единицы – дисахариды, от двух до десяти единиц — олигосахариды, а более десяти — полисахариды. Моносахариды быстро повышают содержание сахара в крови, и обладают высоким гликемическим индексом, поэтому их ещё называют быстрыми углеводами. Они легко растворяются в воде и синтезируются в зелёных растениях. Углеводы, состоящие из 3 или более единиц, называются сложными. Глюкоза. Физические свойства Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий): Особенности строения глюкозы 1. Состав глюкозы выражается формулой: С6Н12O6, она принадлежит к многоатомным спиртам.Глюкоза одновременно и альдегид, и многоатомный спирт: она альдегидоспирт.
В растворе глюкозы содержатся молекулы не только с открытой цепью атомов, но и циклические, в которых нет альдегидной группы. Химические свойства глюкозы Молекула глюкозы является Альдегидоспирты. Поэтому глюкоза вступает в реакции, характерные для многоатомных спиртов и альдегидов. Как многоатомный спирт глюкоза реагирует с меди (II) гидроксидом, образуя раствор синего цвета.
Как альдегид глюкоза окисляется (например, в реакции «серебряного зеркала») до глюконовой кислоты.
глюконовая кислота и восстанавливается водородом до шестиатомного спирта сорбита:
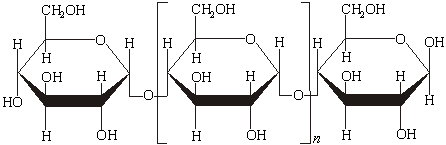
сорбит Большое значение имеют процессы брожения глюкозы, которые происходят под действием органических катализаторов-ферментов. Известно несколько видов брожения. Спиртовое брожение происходит под действием ферментов дрожжей. Продуктами являются этиловый спирт С2H5OH и углекислый газ СО2: C6H12O6 → 2C2H5OH + 2CO2. Молочнокислое брожение глюкозы происходит под действием молочнокислых бактерий: C6H12O6 → CH3-CHOH-COOH молочная кислота При конденсации большого числа моносахаридов друг с другом образуются полисахариды, состав которых выражается общей формулой (С6Н10 О5)n, где n достигает величины сотен и тысяч. Важнейшие из полисахаридов – крахмал и глюкоза. Крахмал образуется в растениях пи фотосинтезе и откладывается в корнях, клубнях и семенах. Внешний вид крахмала хорошо известен: это белое вещество, состоящее из мелких зерен. Он нерастворим в холодной воде, набухает и постепенно растворяется в горячей. Образующиеся вязкие растворы при охлаждении превращаются в студневидную массу – клейстер. Крахмал представляет собой смесь полисахаридов – амилопектина и амилозы. Применяя особую обработку растворителями, из крахмала можно выделить чистую, кристаллическую амилозу. Чистая амилоза не образует при набухании клейстера, с йодом дает характерное темно-синее окрашивание; амилопектин ответственен за образование клейстера, а с йодом дает слабое фиолетовое окрашивание. И амилоза, и амилопектин состоят из остатков, связанных α- гликозидными связями, однако они различаются формой молекул. Амилоза представляет собой линейный полисахарид, построенный из нескольких тысяч остатков глюкозы, соединенных α-глюкозидной связью. Строение амилозы схематически выражается следующей формулой:
По данным рентгеноструктурного анализа, молекула амилозы свернута в спираль. Внутри спиралевой молекулы остается канал диаметром около 0,5 нм, в котором могут располагаться подходящие по размеру молекулы, образуя особого типа комплексы – так называемые соединения включения. Одним из них является упомянутое ранее соединение амилозы с йодом синего цвета. Молекула
аминопектина, в отличие от амилозы, имеет разветвленное строение, приближающееся к шарообразной форме. Определенная физическими методами молекулярная масса амилопектина имеет величину порядка 10 - это значит, что степень полимеризации равна примерно 6000. Подвергая крахмал гидролизу кислотами, можно получить глюкозу в виде чистого кристаллического препарата или в виде патоки – окрашенного некристаллизующегося сиропа. Наибольшее значение крахмал имеет в качестве пищевого продукта: в виде хлеба, картофеля, круп, являясь главным источником углеводов в нашем рационе питания. Значительные количества крахмала употребляются для проклеивания (шлихтования ) тканей, склеивания бумаги и картона, производства канцелярского декстринового клея. В аналитической химии крахмал служит индикатором в йодометрическом методе титрования. Целлюлоза представляет собой полисахарид, построенный из глюкозных звеньев. Ее строение напоминает строение амилозы, т.е. она тоже состоит из остатков глюкозы, но связаны они между собой β-гликозидными связями, а не α-гликозидными, как в амилозе.
Молекулярная масса целлюлозы очень велика – порядка 500 тыс., она может достигать и нескольких миллионов, т.е. в приведенной формуле n равно десяткам тысяч. Клетчатка - главный «строительный материал» растений, из которого состоят стенки растительных клеток. Целлюлоза не плавится и не переходит в парообразное состояние: при нагревании примерно до 350°С она разлагается – обугливается. Она нерастворима в воде и большинстве других неорганических и органических растворителей. Нерастворимость целлюлозы объясняют тем, что ее волокна представляют собой как бы «пучки» расположенных параллельно нитевидных молекул, связанные множеством водородных связей, которые образуются в результате взаимодействия гидроксильных групп. Внутрь подобного «пучка» растворитель проникнуть не может, а следовательно, не происходит и отрыва молекул друг от друга
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.79.59 (0.045 с.) |
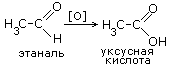
 (CH3COO)2Ca+H2
(CH3COO)2Ca+H2


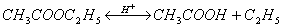

 R – COOH + H2O
R – COOH + H2O
 Жиры или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновныхжирных кислот; входят в класс липидов.
Жиры или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновныхжирных кислот; входят в класс липидов.