Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория химического строения органических соединений А.М. Бутлерова, ее основные положения
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений Создателем теории химического строения был великий русский химик А.М.Бутлеров. Основные положения своей теории он сформулировал в 1858-1861 г.г. Некоторая трудность для нас заключается в том, что создатель теории строения не формулировал пункт за пунктом положения своей теории в одном месте: они пронизывают все научное творчество самого Бутлерова и его учеников. 1. Атомы в органических молекулах связаны друг с другом в определенном порядке химическими силами. Этот порядок Бутлеров и называл химическим строением. Во времена Бутлерова лишь в общих словах называли эти силы «силами валентности»: в наше время выяснено, что силы валентности имеют электронную природу. 2. Строение можно изучить экспериментально, используя химические методы – анализ и синтез. В наше время при установлении строения широко используют также физические методы – разные виды оптической спектроскопии, рентгенографию, электронографию, определение дипольных моментов. Физические методы, в первую очередь рентгенография и электронография, позволяют определить реальное положение каждого атома в молекуле, получать как бы его фотографию. Это расположение согласуется с найденным чисто химическим путем. Поэтому мы чаще говорим просто о строении молекул, опуская прилагательное «химическое», которое обязательно употреблял Бутлеров. 3. Формулы строения выражают порядок химической связи атомов. В формулах строения (структурных формулах) символы элементов соединяют черточками, условно изображающими химическую связь, например:
Структурные формулы в развернутой записи (т.е. с обозначением каждого атома и каждой связи) уже при небольшом усложнении молекулы становится трудно читаемыми. Поэтому с самого начала необходимо привыкнуть к структурным формулам в сокращенной записи, например:
Как видно из приведенных примеров, при сокращенной записи рядом с атомом углерода помещают непосредственно связанные с ним атомы и группы, затем ставят черточку и после нее переходят к другому атому углерода, со стоящими при нем заместителями. Чтобы еще более сократить запись, иногда совсем опускают
черточки: например, СН3СН(ОН)СН3. При построении структурных формул органических соединений необходимо учитывать найденную опытным путем валентность элементов-органогенов. Так, валентность углерода 4, водорода 1, кислорода 2, галогенов 1. Азот, сера и фосфор могут находиться в разных валентных состояниях. 4. Каждое вещество имеет одну определенную формулу строения, отражающую порядок химической связи атомов в реально существующей молекуле. Это положение глубоко материалистично, философски правильно: в основе лежит реально существующий в природе объект – молекула, и структурная формула должна возможно точнее отразить этот объект. Выполнению этого требования подчинены все современные «усовершенствования» в написании формул органических веществ – введение в них обозначений электронных пар, стрелок, пунктиров, знаков заряда. Все это улучшает соответствие между формулой и реальной молекулой, т.е. отвечает принципам теории строения. 5. Связанные в молекуле атомы оказывают друг на друга взаимное влияние: свойство каждого атома в составе молекулы зависит не только от его собственной природы, но и от окружения, в котором этот атом находится. С взаимным влиянием атомов мы постоянно встречались во всем курсе органической химии. Пока ограничимся простейшим примером: и в молекуле воды, и в молекуле хлористого водорода имеется атом водорода, но сколь различны его свойства в обоих веществах! 6. Физические и химические свойства органических соединений определяются составом и строением их молекул. Во времена Бутлерова можно было судить лишь о химическом строении – порядке химической связи атомов. В настоящее время имеется возможность определять пространственное строение; определять распределение электрических зарядов – электронное строение. Все три особенности строения важны при рассмотрении свойств органических соединений. Теория химического строения позволила понять природу изомерии: молекулы структурных изомеров имеют одинаковый состав, но различаются порядком связи
атомов. Например, формула С2Н6О отвечает двум различным веществам: диметиловому эфиру и этиловому спирту. Бутлеров не ограничился лишь теоретическим объяснении изомерии на основе теории строения. Он провел и ряд экспериментальных работ, подтвердив предсказания теории получением изобутана и третичного бутилового спирта.
35 Классификация химических реакций в органической химии. Многообразие органических реакций сводится к пяти типам: замещения, присоединения, отщепления, перегруппировки и окислительно-восстановительные.
36 Алканы. Состав и химическое строение. Гомологический ряд. Номенклатура. Физические и химические свойства, получение, применение.
37. Циклоалканы. Состав, гомологический ряд. Номенклатура. Физические и химические свойства, получение, применение.
Циклоалканы, также полиметиленовые углеводороды, нафтены, цикланы, или циклопарафины — циклические насыщенные углеводороды, по химическим свойствам близки к предельным углеводородам... К циклоалканам относят предельные углеводороды с общей формулой СnH2n, n имеющие циклическое строение. Названия циклоалканов строятся из названий соответствующих алканов с добавлением приставки цикло - (циклопропан, 1,3-диметилциклогексан).
Для циклоалканов характерны следующие виды изомерии: Изомерия углеродного скелета Пространственная Межклассовая изомерия с алкенами Все атомы углерода в молекулах циклоалканов имеют sp³-гибридизацию. Однако величины углов между гибридными орбиталями в циклобутане и особенно вциклопропане не 109°28', а меньше из-за геометрии, что создает в молекулах напряжение, поэтому малые циклы очень реакционноспособны. Циклопропан применяют для наркоза, но его применение ограничено из-за взрывоопасности. Физические свойства При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 — С11) — жидкости, начиная с С12 — твёрдые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов. Циклоалканы в воде практически не растворяются. При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления Получение циклоалканов 1. Дегалогенирование дигалогенпроизводных: Br-СН2-СН2-СН2-Br + Mg = циклопропан + MgBr2 2. Гидрирование бензола и его гомологов (образуются циклогексан или его производные): С6Н6 +3Н2 = С6Н12 Химические свойства По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и Циклобутан склонны к реакциям присоединения, то есть сходны в этом отношении с алкенами. Циклопентан и Циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения. 1. Циклопропан и циклобутан способны присоединять бром: С3H6 + Br2 → BrCH2—CH2—CH2Br 2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора: С4H8 + H2 → CH3—CH2—CH2—CH3 38 Алкены. Состав и химическое строение. Гомологический ряд. Номенклатура. Физические и химические свойства. Правило Марковникова. Механизм реакции электрофильного присоединения. Получение и применение алкенов. . Алкенами называются ненасыщенные углеводороды, содержащие вмолекулах одну двойную связь. Простейшим представителем алкенов является этилен С2Н4, в связи, с чем соединения этого ряда называются также углеводородами ряда этилена. Часто применяется для них название олефины. Гомологический ряд алкенов имеет общую формулу СnН2n, т. е. как у циклоалканов. Таким образом, алкены и циклоалканы – изомеры, относящиеся к разным классам. Характерной особенностью строения алкенов является наличие в молекуле двойной связи >C=C<. Двойная связь образуется при помощи двух пар обобщенных электронов. Углеродные атомы, связанные двойной связью, находятся в состоянии sp²-гибридизации, каждый из них образует три σ-связи, лежащие в одной плоскости под углом 120º. Негибридизованные р-орбитали расположены перпендикулярно к плоскости σ-связей и параллельно друг другу и вследствие «бокового» перекрывания образуют вторую связь, называемую π-связью. Электронное облако
π-связи лежит частично над плоскостью и частично под плоскостью, в которой лежат атомы. Для алкенов характерна структурная изомерия: различия в разветвлении цепи и в положении двойной связи, а также пространственная изомерия (цис- и трансизомеры). Тривиальные названия олефинов характеризуются добавлением окончания илен: этилен, пропилен и т.д., большое количество алкенов образуется при крекинге и пиролизе нефти. Другой важный способ – дегидрирование алканов (Cr2O3, t=450°–460°). Лабораторными способами получения является дегидратация спиртов и дегидрогалогенирование. Способы получения алкенов Составить уравнения реакций, подтверждающих способы получения алкенов – крекинг алканов C8H18 ––> C 4 H 8 + C4H10; (термический крекинг при 400-700 oС) Химические свойства 1. CH2=CH2 + Cl2 → CH2Cl–CH2Cl 2. CH3–CH=CH2 + HBr → CH3–CHBr–CH3 Далее, когда Марковников рассматривал присоединение галогеноводородов к алкенам, содержащим галоген при двойной связи, он добавлял, что «атом галогена присоединяется к атому углерода, уже содержащему атом галогена»
3. CH2=CH2 + H2O → CH3–CH2OH 4. CH2=CH2 + H2 → CH3–CH3 (Pt) 5. 3СН2=CH2 + 2KMnO4 + 4H2O → 3HOCH2CH2OH + 2MnO2 + 2КОН Этилен является одним из важнейших полупродуктов для промышленности органического синтеза. Многие вещества, получаемые непосредственно из этилена, имеют практическое применение или используются для дальнейших синтезов. Пропилен используется для производства изопропилового спирта, ацетона, глицерина, полипропилена. Изобутилен используется для синтеза изооктана, полиизобутилена. Бутилены применяются для получения бутадиена – продукта для получения синтетического каучука. Применение углеводородов: 1) благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ; 2) этиленовые углеводороды не используются в качестве горючего; 3) особенно широко этилен используется для получения органических веществ; 4) этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ;
39 Диеновые углеводороды. Строение, классификация. Химические свойства. Получение и применение. Алкадиены – соединения, содержащие в открытой углероднойцепи две двойные связи. Общая форма алкадиенов СnН2 n-2 (как и ацетиленов). Следовательно, алкадиены изомерны алкинам. Изомерия алкадиенов в свою очередь обусловлена строением углеродного скелета и относительным расположением двойных связей. По взаимному расположению двойных связей различают следующие алкадиены: с кумулированными двойными связями (С=С=С), с сопряженными двойными связями (С=С–С=С), с изолированными двойными связями (С=С–С–С–С=С). Наиболее промышленно важными алкадиенами являются бутадиен-1,3 и изопрен. Промышленными способами получения бутадиена-1,3 является дегидрирование бутана, а также по способу Лебедева (из этанола); изопрена – дегидрирование изобутилена. Как и для алкенов, для алкадиенов характерны реакции полимеризации и присоединения. Наиболее практически важными являются реакции полимеризации, т.к. в их основе лежит получение синтетических каучуков. При полимеризации изопрена получают полимер, похожий по строению элементарного звена на природный каучук. nCH2=CH–CH=CH2 ® (–CH2–CH=CH–CH2–)n nCH2=CH–CH(CH3)=CH2 ® (–CH2–C(CH3)=CH–CH2–)n Чтобы получить каучук с определенными свойствами, часто используют реакцию сополимеризации – совместной полимеризации двух и более полимеров. Каучуки широко применяются в производстве резины. Чтобы превратить каучук в резину, его наполняют сажей, глиной и подвергают вулканизации. Вулканизация – сшивание различных цепей полимера. Чаще всего вулканизируют каучук с целью повышения прочности, эластичности, снижения растворимости. Физические свойства Низшие диены — бесцветные легкокипящие жидкости (температура кипения изопрена 34 °C; температура кипения 2,2-диметил-1,3-бутадиена 68,78 °C; температура кипения 1,3-циклопентадиена 41,5 °C). 1,3-Бутадиен и аллен (1,2-пропадиен) — газы (Tкип −4,5 °C и −34 °C соответственно). Электрофильность sp-гибридизованного атома алленов повышается электроноакцепторными группами, в этом случае присоединение нуклеофила идет исключительно по этому атому: CH2=C=CHCOOR + NuH Гидратации аллена в условиях кислотного катализа присоединение протона идёт по терминальному углероду, образующийся при этом енол далее таутомеризуется вацетон: CH2=С=CH2 + H2O Под действием щелочей или кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены: RCH2CH=C=CH2 Получение Синтез Лебедева: CH3-CH2-OH+CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2 40. Алкины, состав, строение, номенклатура, химические свойства, получение и применение. Алкины – ненасыщенные углеводороды, содержащие в молекуле одну тройную связь. Общая формула – СnH2n-2. Главным фактором, характеризующим алкины, является наличие в молекуле тройной связи – С ≡ С – Углеродные атомы, образующие тройную связь, находятся в состоянии sp-гибридизации. Каждый из них образует две σ-связи, две негибридизованные р-орбитали расположены под прямым углом друг к другу и соответствующим орбиталям другого атома. Они попарно перекрываются, образуя две π-связи, расположенные в двух взаимно перпендикулярных плоскостях. Изомерия алкинов обусловлена разветвлением цепи и положением тройной связи: в этом у них сходство с алкенами. Но для алкинов невозможно существование цис-транс -изомеров, т.к. две σ-связи лежат на одной прямой. Физические свойства Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства 1. CH≡CH + Cl2 → CHCl=CHCl CHCl=CHCl+ Cl2 → CHCl2–CHCl2 2. CH≡СH + HF → CH2=CHF 3. CH≡CH + H2 → CH2=CH2 + H2 → CH3–CH3 4. CH≡CH + HOH → [CH2=CHOH] → CH3CHO Реакция протекает легче, чем для алкенов. Катализатором служит разбавленная серная кислота и соли двухвалентной ртути. Эта реакция была открыта М. Г. Кучеровым в 1881 г. и носит его имя. На основе ацетилена развились многие отрасли промышленности органического синтеза.
ПОЛУЧЕНИЕ АЦЕТИЛЕНА. Ацетилен получают из предельных углеводородов дегидрированием: C2H6 —> C2H2 + 2H2. Ацетилен получают из карбида кальция: CaC2+2H20 -> Ca(OH)2 + C2H2 и из метана: 2CH4 =C2H2 + ЗH2.
41. Арены, гомологический ряд бензола, физические и химические свойства, строение, получение, применение
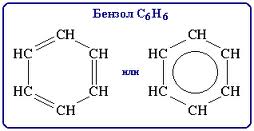
Ароматическими углеводородами называются вещества, в молекулах которого содержится одно или более бензольных колец. Простейшим представителем аренов является бензол. В 1865г. ученым Кекуле была предложена структура молекулы бензола. Главной особенностью ядра является то, что в нем нет ни настоящих простых, ни настоящих двойных связей: все шесть С–С связей одинаковы, а шесть π-электронов образуют устойчивую группировку – электронный секстет. Эта устойчивость создается сопряжением всех π-электронов. Объяснение эквивалентности всех связей было дано лишь с развитием квантовой теории химических связей. Каждый атом углерода находится в состоянии sp²-гибридизации, причем у каждого атома одна из негибридизованных р-орбиталей расположена перпендикулярно плоскости молекулы. При этом все они эквивалентны и образуют общую сопряженную π-систему. Оставшаяся от связи с соседними атомами углерода р-орбиталь каждого атома сориентирована в плоскости кольца и используется для связи с атомом водорода. Бензол – прозрачная бесцветная жидкость с характерным запахом. Не смешивается с водой, но смешивается со многими органическими растворителями, сам бензол является хорошим растворителем. Горит коптящим пламенем. Ядовит. В промышленности получают риформингом нефти. В чистом виде основная реакция – дегидрогенизация гексана: С6Н14 → С6Н6 + 4Н2 (t, p). Другим важным методом является тримеризация ацетилена под давлением. Химические свойства: 1. AlCl3 + Cl2 ↔ Clδ+ [AlCl4]δ– С6Н6 + Cl2 → C6H5Cl + HCl 2. HNO3 + H2SO4 ↔ NO2δ+[HSO4]δ– + H2O С6Н6 + HNO3 → C6H5NO2 + H2O 3. 2H2SO4 ↔ SO3Hδ+[HSO4]δ– + H2O С6Н6 + H2SO4 → C6H5SO3H + H2O 4. AlCl3 + RCl ↔ Rδ+[AlCl4]δ– С6Н6 + RCl → C6H5R + HCl 5. С6Н6 + 3H2 → C6H12 Pt; t, p. 6. С6Н6 + 3Cl2 → C6H6Cl6 УФ-облучение. Производные бензола, которые можно рассматривать как продукты замещения атомов водорода бензола алкильными радикалами, называются гомологами. Заместители оказывают влияние на физические свойства бензола: температура кипения изомеров с разветвленными боковыми цепями ниже, чем с нормальными. К химическим свойствам добавляются химические свойства заместителей. Арены применяются как химическое сырье для получения лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ, широко используются арены как растворители.
42 Спирты и фенолы, строение и изомерия. Механизм нуклеофильного замещения. Ядовитость спиртов, их влияние на организм человека. Получение и применение спиртов Продукты замещения водорода в углеводородах гидроксильной группой называют спиртами. Общая формула спиртов R–OH. Гидроксильные производные ароматических углеводородов называют ароматическими спиртами в том случае, если гидроксильная группа находится в боковой цепи, и фенолами, если гидроксогруппа связана с углеродом ядра. По характеру углеводородного радикала алифатические спирты делятся на насыщенные и ненасыщенные. В зависимости от числа гидроксогрупп в молекуле различают одноатомные, двухатомные и многоатомные спирты. Углеродный атом способен прочно удерживать только одну гидроксильную группу; не может гидроксил стоять и при кратной связи, хотя из этих правил есть исключения. Изомерия спиртов обусловлена строением радикала (изомерия углеродного скелета) и положением гидроксила (изомерия положения). По положению гидроксила в молекуле, в зависимости от того, с каким атомом углерода связан (с первичным, вторичным или третичным) различают первичные, вторичные и третичные спирты. По современным международным правилам к названию углеводорода добавляется окончание ол и цифра, обозначающая атом углерода, у которого стоит гидроксил. Общими свойствами получения спиртов является гидратация олефинов в кислой среде, гидролиз галогенпроизводных, восстановление карбонильных соедининий. Функциональная группа спиртов – гидроксил – обуславливает главные химические свойства этих соединений. Спирты отличаются большой химической активностью. Вследствие многообразия реакций спиртов и доступности сырья для их получения спирты являются ценным исходным материалом для синтеза многих алифатических соединений. Связи С–О–Н поляризованы, причем отрицательным концом диполя является кислород, как наиболее электроотрицательный элемент. На атомах углерода и водорода имеются частичные положительные заряды. Такой электронный характер гидроксогруппы предопределяет ее склонность к реакциям гетеролитического типа, в ходе которых может разрываться либо связь С–О, либо связь О–Н. Спирты - практически нейтральные вещества: они не изменяют окраски индикаторов, не вступают в реакции ни с водными растворами щелочей, ни с разбавленными кислотами. Однако в определенных реакциях они проявляют свойства очень слабых кислот и оснований, т.е. являются амфотерами, подобно воде. Кислотные свойства спиртов выражены несколько слабее, чем у воды, хотя связь кислород–водород поляризована: Оδ––Нδ+. Алкильные группы отталкивают от себя электроны, снижая тем самым легкость отщепления протона по сравнению с водой.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 88; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.101.60 (0.169 с.) |



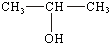
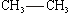
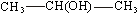 или
или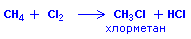




 2. Частичное окисление
2. Частичное окисление
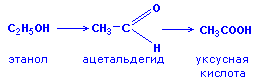

 CH2=CNuCH2COOR + CH3C(Nu)=CHCOOR
CH2=CNuCH2COOR + CH3C(Nu)=CHCOOR