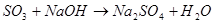Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Амфотерными называют такие оксиды. Которые в зависимости от условий проявляют основные или кислотные свойства.
Имеется небольшая группа оксидов, которые не проявляют ни основных, ни кислотных свойств и не образуют солей. Такие оксиды называют безразличными или индифферентными - Получение:
Химические свойства.
3.Взаимодействуют между собой:
а) с кислотами б) с основаниями 7. Классификация химических реакций.
8. Теория строения атома. Распределение электронов в оболочках атомов Ядерная модель строения атомов. До конца XIX в. атомы считались недилимыми. Резерфорд предложил в 1911 г. ядерную модель строения атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Размер атома 10-8 см., а ядра 10-13 см. Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Положительный заряд ядра атома численно равен порядковому номеру элемента ПС. Число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равен порядковому номеру элемента. Состав атомных ядер. В настоящее время в ядре атома открыто большое число элементарных частиц. Важнейшими из них являются протоны (р) и нейтроны (n). Протон обладает массой ≈ 1 а.е. м и зарядом +1. Масса нейтрона ≈ 1 а.е. м, а заряд 0. Таким образом Ar = N + P Разновидности атомов одного элемента, обладающих одинаковыми зарядами ядер, но разными атомными массами называются изотопами. Каждый изотоп характеризуется массовым числом и порядковым номером С. Атомная масса элемента равна среднему значению масс всех его природных изотопов с учетом их распространенности. Современная модель состояния электрона в атоме. При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки, строением которых объясняются многие химические свойства элементов.
Состояние электрона в атоме описывается квантовой механикой. Быстро движущийся электрон может находиться в любой части пространства, окружающей ядро и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено ≈ 90% электронного облака. Электроны, которые движутся в орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Их нумеруют, начиная от ядра. Целое число n, обозначающее номер уровня, называется главным квантовым числом. Оно характеризует энергию электронов, занимающих уровень. Наименьшей энергией обладают электроны 1 уровня. Показывает длину орбитали и равно номеру периода. Орбитальное квантовое число показывает пространственную форму орбитали и равно номеру периода, показывает число подуровней на каждом уровне. 1s; 2 s, p; 3 s, p, d; 4 s, p, d, f. S – О P 8
Магнитное квантовое число показывает пространственную ориентацию орбитали в прострастве.
Спин электрона. В одной орбитали может находиться не более 2х орбиталей с антипараллельными спинами. Построение электронных оболочек происходит по принципу заполнения. Мысленно добавляя по одному электрону на атомные орбитали, (в последовательности 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p и так далее) в соответствии с принципом запрета Паули (в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел) и правилом Гунда (на орбиталях с одинаковой энергией электроны по возможности расселяются поодиночке), можно описать орбитальное электронное строение всех атомов в их основном состоянии.
9. Периодический закон и периодическая система Д.И. Менделеева в свете современных представлений о строении атома. Сходство и различие в строении атомов элементов одного периода, группы, подгруппы.
10 . Виды химических связей. Ковалентная связь (полярная, неполярная). Донорно-акцепторная связь. Ионная и металлическая связь.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 56; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.21.5 (0.024 с.) |
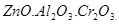
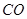 ,
,  ,
, 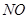 ,
,  .
.


 .
.