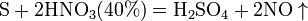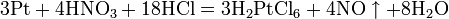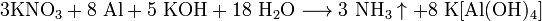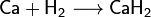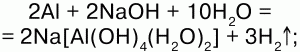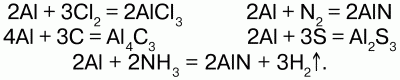Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атомно – молекулярное учение.Стр 1 из 15Следующая ⇒
Основные понятия Химия – наука, изучающая состав, свойства и превращения веществ, а также явления, сопровождающие эти превращения. Основные понятия и законы химии. М о л е к у л а – наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и химическим строением. А т о м – это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Вопрос 2 Кислоты, номенклатура, классификация, получение, свойства Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация кислот 1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот: n = 1 одноосновная HCl n = 2 двухосновная H2S n = 3 трехосновная H3PO4 Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д. Способы получения кислот бескислородные HCl, HBr, HI, HF, H2S кислородсодержащие HNO3, H2SO4 и другие Получение:
Свойства кислот: 1) Взаимодействуют с металлами:
Металлы, стоящие в ряду стандартных электродных потенциалов правее водорода, из кислот его не вытесняют. Водород не выделяется и при взаимодействии металлов с концентрированными азотной и серной кислотами. 2) С основными оксидами:
3) С основаниями:
4) С солями:
5. Реагируют с солями слабых, летучих кислот - если образуется кислота, выпадающая в осадок или выделяется газ: Каждая предыдущая кислота может вытеснить из соли последующую 6. Разложение кислородсодержащих кислот при нагревании КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА 3 Гидроксиды, классификация, получение, свойства.
Основаниями (основными гидроксидами) с позиции теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов ОН-. По современной номенклатуре их принято называть гидроксидами элементов с указанием, если необходимо, валентности элемента КОН – гидроксид калия, гидроксид натрия NaOH, гидроксид кальция Ca(OH)2, гидроксид хрома (II) – Cr(OH)2, гидроксид хрома (III) – Cr(OH)3. Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами - Li, Na, K, Cs, Rb, Fr, Ca, Sr, Ba и поэтому называемые щелочами) и нерастворимые в воде. По числу гидроксильных групп (кислотность), способных замещаться на кислотный остаток, различают: - однокислотные основания – KOH, NaOH; - двухкислотные основания – Fe(OH)2, Ba(OH)2; - трехкислотные основания – Al(OH)3, Fe(OH)3.
Получение:
2) Взаимодействие оксидов с водой:
3) Взаимодействие щелочей с солями:
Свойства: Свойства солей. Химические свойства.
3.Взаимодействуют между собой:
а) с кислотами б) с основаниями 7. Классификация химических реакций.
8. Теория строения атома. Распределение электронов в оболочках атомов Ядерная модель строения атомов. До конца XIX в. атомы считались недилимыми. Резерфорд предложил в 1911 г. ядерную модель строения атома. Согласно этой модели атом состоит из массивного положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена вся масса атома. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Размер атома 10-8 см., а ядра 10-13 см. Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Положительный заряд ядра атома численно равен порядковому номеру элемента ПС. Число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равен порядковому номеру элемента. Состав атомных ядер. В настоящее время в ядре атома открыто большое число элементарных частиц. Важнейшими из них являются протоны (р) и нейтроны (n). Протон обладает массой ≈ 1 а.е. м и зарядом +1. Масса нейтрона ≈ 1 а.е. м, а заряд 0. Таким образом Ar = N + P Разновидности атомов одного элемента, обладающих одинаковыми зарядами ядер, но разными атомными массами называются изотопами. Каждый изотоп характеризуется массовым числом и порядковым номером С. Атомная масса элемента равна среднему значению масс всех его природных изотопов с учетом их распространенности. Современная модель состояния электрона в атоме. При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки, строением которых объясняются многие химические свойства элементов. Состояние электрона в атоме описывается квантовой механикой. Быстро движущийся электрон может находиться в любой части пространства, окружающей ядро и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено ≈ 90% электронного облака. Электроны, которые движутся в орбиталях близкого размера, образуют электронные слои. Электронные слои называют также энергетическими уровнями. Их нумеруют, начиная от ядра. Целое число n, обозначающее номер уровня, называется главным квантовым числом. Оно характеризует энергию электронов, занимающих уровень. Наименьшей энергией обладают электроны 1 уровня. Показывает длину орбитали и равно номеру периода. Орбитальное квантовое число показывает пространственную форму орбитали и равно номеру периода, показывает число подуровней на каждом уровне. 1s; 2 s, p; 3 s, p, d; 4 s, p, d, f. S – О P 8
Магнитное квантовое число показывает пространственную ориентацию орбитали в прострастве.
Спин электрона. В одной орбитали может находиться не более 2х орбиталей с антипараллельными спинами. Построение электронных оболочек происходит по принципу заполнения. Мысленно добавляя по одному электрону на атомные орбитали, (в последовательности 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p и так далее) в соответствии с принципом запрета Паули (в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел) и правилом Гунда (на орбиталях с одинаковой энергией электроны по возможности расселяются поодиночке), можно описать орбитальное электронное строение всех атомов в их основном состоянии.
9. Периодический закон и периодическая система Д.И. Менделеева в свете современных представлений о строении атома. Сходство и различие в строении атомов элементов одного периода, группы, подгруппы.
10 . Виды химических связей. Ковалентная связь (полярная, неполярная). Донорно-акцепторная связь. Ионная и металлическая связь. Сероводород и сульфиды Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных. Получение: 1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой. Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота. Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты: 1) горит голубоватым пламенем на воздухе:
2) при высокой температуре разлагается:
3) вступает в реакцию с галогенами:
4) взаимодействует с окислителями:
5) серебро при взаимодействии с сероводородом темнеет:
Получение: основным методом производства серной кислоты из SO3 является контактный метод. Вначале получают диоксид серы SO2 (сжигание серы и др.). Самый распространенный способ получения – обжиг серного колчедана FeS2, затем диоксид серы SO2 окисляют в триоксид серы SO3 контактным методом Физические свойства: Серная кислота – бесцветная вязкая жидкость, имеющая температуру плавления 10 °C, температура кипения 296 °C (с разложением на H2O и SO3). Серная кислота – сильная кислота. Концентрированная серная кислота в большом количестве поглощает пары воды, поэтому ее используют для осушения газов. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ. Изменяет цвет индикатора: Аммиак Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3* Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода. Химические свойства: 1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию. 2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4; 3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О; 4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2 + 6Н2О; Используется хлорид аммония (NH4Cl) – нашатырь.
Аммиак – NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации смоноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Химические свойства Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот: увеличение концентрации кислоты Продукты взаимодействия железа с HNO3 разной концентрации С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой. Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором ихлоридом нитрозила:
Нитраты HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом: а) нитраты металлов, стоящих в ряду напряжений левее магния: 2NaNO3 = 2NaNO2 + O2 б) нитраты металлов, расположенных в ряду напряжений между магнием и медью: 4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2 в) нитраты металлов, расположенных в ряду напряжений правее ртути: 2AgNO3 = 2Ag + 2NO2 + O2 г) нитрат аммония: NH4NO3 = N2O + 2H2O Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например: Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ. Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно. С азотной кислотой не реагируют стекло, фторопласт-4.
26 Общая характеристика элементов подгруппы углерода. Оксиды углерода. Угольная кислота, физико-химические свойства. В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева. Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств. Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками). В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2.Степень окисления -4 в последовательности C – Pb становится все менее характерной. Металлы и сплавы В периодической системе из 110 известных элементов 88 – металлы. Сплавы – системы, в состав которых входят два или более металлов, реже могут входить неметаллы (углерод, кремний, бор). Все сплавы на основе железа (чугун, сталь), в том числе и само железо называют черными металлами. Все остальные – цветные металлы (дуралюмин, латунь). В расплавленном состоянии большая часть металлов при растворении друг в друге образуют однородный жидкий сплав. Твердый раствор – образование однородных кристаллов в результате сохранения растворимости металлов друг в друге. Сталь – сплав железа и углерода, имеющий примеси марганца, кремния, серы и фосфора. Защита металлов от коррозии Защита металлов и сплавов от коррозии в агрессивных средах основывается на: 1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании электродного потенциала защищаемого изделия в данной среде. Существуют методы, используемые для защиты от электрохимической коррозии: 1) использование химически стойких сплавов; 2) защита покрытием поверхности металла или сплава; 3) снижение активности коррозийной среды; 4) электрохимические методы. Металлические покрытия – хром, никель, цинк, кадмий, алюминий, олово и др. Их наносят, используя методы гальванотехники. Неметаллические покрытия – лаки, краски, эмали, фенолформальдегидные смолы и др.
30. Щелочные металлы, физические и химические свойства, получение, применение. Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы)[1]: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами. В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: ихэлектронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства.В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов). Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Физические свойства К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы,бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств. Химические свойства Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns ², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1). Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина. Также, кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Взаимодействие кальция с водой. Ca+2H20 = Ca(OH)2+H2. Взаимодействие с кислотами Ca+2 HCl = CaCl2+H2 Взаимодействие с неметаллами 3Ca+ 2Р=Ca3P2 3Ca+N2=Ca3N2 Ca+S=СаS Ca+H2 =CaH2 Ca+Cl2+CaCI2 Са+ 2С=CaC2 2Са+О2=2СаО
32. Алюминий и его соединения, их физические и химические свойства. Амфотерность соединений алюминия. Алюминий расположен в 3-й группе главной подгруппы, в 3 периоде. Порядковый номер 13. Атомная масса ~27. Р-элемент. Электронная конфигурация: 1s22s22p63s23p1. На внешнем уровне 3s23p1 находятся 3 валентных электрона. Степень окисления +3, валентность – III. Физические свойства: алюминий – металл серебристо-белого цвета, мягкий, механически прочный, тепло– и электропроводный, легко вытягивается в проволоку, прокатывается в тонкую фольгу, легко образует сплавы. Химические свойства: 1) при обычной температуре реагирует с кислородом, образую окисную пленку, препятствуя дальнейшему окислению металла: 4Аl + 3О2 = 2Аl2О3; 2) алюминий, лишенный защитной оксидной пленки, взаимодействует с водой: 2Аl + 6Н2О = 2Аl(ОН)3 + 3Н2; 3) алюминий энергично взаимодействует с растворами щелочей:
4) при нагревании алюминий взаимодействует с галогенами, с азотом, с углеродом, с серой, а также с аммиаком:
Получение. В промышленности алюминий получают электролизом раствора Аl2О3 в расплавленном криолите Na3AlF6 с добавлением СаF2. Алюминий выделяется на катоде.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 72; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.189.177 (0.203 с.) |

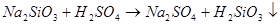
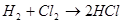


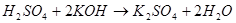

 1) Взаимодействие активных металлов с водой:
1) Взаимодействие активных металлов с водой: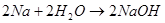



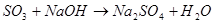














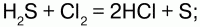


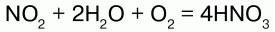


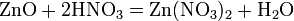
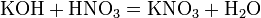



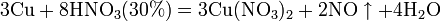

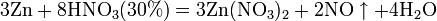

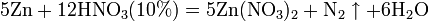

 увеличение активности металла
увеличение активности металла