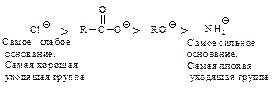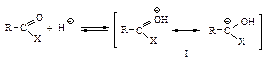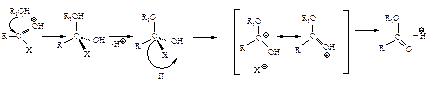Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И.С. Колпащикова, А.Ф. Бетнев, Е.М. АловСтр 1 из 16Следующая ⇒
И.С. Колпащикова, А.Ф. Бетнев, Е.М. Алов ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Допущено учебно-методическим объединением по образованию в области химической технологии и биотехнологии в качестве учебного пособия для студентов высших учебных заведений, обучающихся по химико-технологическим направлениям подготовки дипломированных специалистов
Ярославль 2006
УДК 547 ББК 24.23 К 60
Колпащикова И.С., Бетнев А.Ф., Алов Е.М. К 60 Функциональные производные углеводородов: Учебное пособие. – Ярославль: Изд-во ЯГТУ, 2006. – 136 с. ISBN 5-230-20643-8
В пособии рассмотрены основные вопросы строения и реакционной способности, типичные реакции и основные способы получения спиртов, фенолов, карбонильных соединений, кислот, нитросоединений, аминов, диазосоединений и полифункциональных соединений. Предназначено для студентов специальности «Химическая технология органических веществ», а также может быть рекомендовано для студентов дневной и заочной формы обучения всех специальностей химико-технологического факультета.
Ил. 5. Табл. 10. Библиогр. 5.
Рецензенты: кафедра общей и биоорганической химии Ярославского государственного университета; М.М. Кузнецов, канд. хим. наук, доцент кафедры биоорганической и биофизической химии Ярославской государственной медицинской академии. УДК 547 ББК 24.23 ______________________________________________________
Редактор Л.С. Кокина
План 2005
Подписано в печать 17.01.2006. Формат 60х84 1/16. Бумага белая. Печать ризограф. Усл. печ. л. 7,90. Уч.-изд. л. 7,88. Тираж 450. Заказ 99
Ярославский государственный технический университет 150023, Ярославль, Московский пр., 88
Типография Ярославского государственного технического университета 150000, Ярославль, ул. Советская, 14а _______________________________________________________
ISBN 5-230-20643-8
© Ярославский государственный технический университет, 2006 Спирты Спиртами называются соединения с общей формулой R-OH, где R – алкильная или замещенная алкильная группа. Гидроксил -ОН является функциональной группой и определяет свойства, характерные для спиртов. По числу функциональных групп в молекуле различают одно-, двух- и многоатомные спирты. R-OH – одноатомный спирт. Спирты классифицируют как первичные, вторичные и третичные:
По строению углеродного радикала различают насыщенные, ненасыщенные и ароматические спирты. Номенклатура. По номенклатуре IUPAC насыщенные спирты называют алканолами. В соответствии с заместительной номенклатурой название спирта строят следующим образом: 1) выбирается наиболее длинная углеродная цепь, содержащая гидроксильную группу; 2) эта цепь нумеруется с того конца, к которому ближе гидроксильная группа; 3) называют соответствующий углеводород с добавлением окончания - ол и указанием номера углерода, при котором находится гидроксил; 4) наименования всех оставшихся групп являются префиксами и располагаются в алфавитном порядке. Пример:
В соответствии с радикально-функциональной номенклатурой название спиртов составляется из названия радикала и слова спирт.
1.1. Физические свойства При нормальных условиях спирты до С10 - жидкости, начиная с С11 и далее - твердые тела. При сравнении физических свойств низших спиртов, в которых полярная группа -ОН составляет значительную часть молекулы, со свойствами углеводородов с близкой молекулярной массой обнаруживаются резкие различия: спирты имеют более высокие температуры кипения, плавления и растворимость в воде (табл. 1.). Таблица 1 Химические свойства 1.2.1. Реакции с участием связи O−H Кислотные свойства. В молекуле спирта содержится атом водорода, связанный с сильно электроотрицательным кислородом, поэтому спирт проявляет заметную кислотность. Спирты (кроме метанола) более слабые кислоты, чем вода: алкильная группа, проявляя электронодонорный индукционный эффект, подает электроны на кислород R→Оy, увеличивает на нем отрицательный заряд (по сравнению с зарядом на гидроксид-ионе) и делает алкоксид-ион R→Оy - сопряженное основание - более сильным, а кислоту - более слабой.
Алкоксиды (алкоголяты) нельзя получить реакцией спирта с гидроксидами металлов, их синтезируют реакцией спирта с активным металлом (Na, K, Mg, Al и др.).
Кислотные свойства спиртов убывают в ряду:
Основность. Спирты представляют собой основания, сравнимые по силе с водой. При действии сильных кислот они превращаются в соли.
Взаимодействие с магнийгалогеналкилами. В этой реакции происходит замещение гидроксильного водорода на магнийгалоген и выделяется углеводород.
В случае использования СН3MgJ выделяется метан. По объему выделившегося метана определяют количественное содержание гидроксильных групп. Образование сложных эфиров. Благодаря наличию электронной пары на атоме кислорода спирт является нуклеофильным реагентом. В качестве нуклеофила он выступает в реакциях образования сложных эфиров. Спирт может атаковать электронодефицитный атом углерода карбонильной группы хлорангидридов, ангидридов кислот и кислот (реакция ацилирования спирта).
Окисление, дегидрирование Первичные спирты можно окислить до альдегидов действием К2Сr2О7 + H2SO4, если одновременно с окислением вести отгонку легко окисляющихся альдегидов, кипящих при более низкой температуре, чем исходные спирты.
При нагревании первичных спиртов с водным раствором перманганата калия окисление идет до карбоновых кислот; выделить промежуточный продукт окисления – альдегид – не удается. Вторичные спирты окисляются до кетонов действием перманганата калия или хромовой кислотой.
Дальнейшее окисление кетона возможно только в жестких условиях, т.к. при этом происходит разрыв углерод-углеродной связи. Третичные спирты в присутствии кислот превращаются в алкены, которые далее легко окисляются. В щелочной и нейтральной средах третичные спирты не окисляются. Превращение первичных спиртов в альдегиды, вторичных – в кетоны можно осуществлять, нагревая пары спирта до температуры 200-300 оС над медным катализатором – реакция дегидрирования.
Способы получения Гидратация алкенов Присоединение воды к алкенам происходит в присутствии кислых катализаторов (серная, фосфорная кислоты, оксид алюминия или другой носитель, обработанный кислотами). Реакция идет по механизму электрофильного присоединения АЕ.
Поскольку реакция электрофильного присоединения протекает через стадию образования карбокатиона, возможна перегруппировка с образованием наиболее устойчивого карбокатиона. Гидролиз галогеналканов Гидролиз галогеналканов проводят при нагревании с водным раствором щелочей. Реакция протекает по механизму SN1 или SN2 в зависимости от строения галогеналкана.
Если реакция протекает по механизму SN1, возможна перегруппировка с образованием наиболее устойчивого карбокатиона. Брожение сахаров Дрожжи сбраживают некоторые виды сахаров. Это сложный каталитический многостадийный распад на спирт и диоксид углерода.
Способы получения и химические свойства спиртов приведены на рис. 1. Фенолы Фенолами называются соединения, в которых гидроксильная группа связана непосредственно с ароматическим ядром. Как и в случае спиртов, число ОН-групп определяет атомность фенолов. По числу гидроксильных групп в молекуле различают одно-, двух-, трех- и многоатомные фенолы:
Следует выделить особенности строения и свойства фенолов, в которых проявляются, с одной стороны, сходство со свойствами спиртов, а с другой - влияние ароматического кольца на реакционную способность гидроксильной группы и влияние гидроксильной группы на реакционную способность кольца.
Физические свойства Простейшие фенолы – высококипящие жидкости или низкоплавкие твердые соединения. Они имеют высокие температуры кипения из-за обра-
зования водородных связей Фенол заметно растворим в воде, это объясняется образованием водородных связей с водой Фенолы - бесцветные вещества (за исключением нитрофенолов, имеющих желтый цвет), однако обычно окрашены за счет примесей продуктов их окисления кислородом воздуха. Физические свойства некоторых фенолов представлены в табл. 2. Высокая температура кипения п -нитрофенола обусловлена наличием межмолекулярных водородных связей. Из-за межмолекулярных связей м - и п -нитрофенолы образуют ассоциаты, и поэтому их нельзя перегнать с водяным паром.
У о -нитрофенола образуется в большей степени внутримолекулярная водородная связь, поэтому он не обладает свойствами ассоциированных жидкостей.
Внутримолекулярная водородная связь образуется всегда, когда это позволяет структура соединения.
Таблица 2 Физические свойства фенолов
Химические свойства Химические свойства фенолов определяются наличием в молекуле полярной группы -ОН. В основном эти реакции связаны с кислотностью фенола и электрофильным замещением в ядре. При этом атом кислорода всегда остается в молекуле. Для нуклеофильного замещения группы -ОН нужны очень жесткие условия, и эти реакции мало изучены. Следует отметить, что реакции нуклеофильного замещения с участием феноксид-иона идут легче, чем с участием фенола.
Кислотность Фенолы более сильные кислоты, чем вода (Ка~10-16) и спирты (Ка~10-18), но значительно более слабые, чем карбоновые кислоты (Kа~10-5). Большинство фенолов имеют Ка~10-10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте, вследствие делокализации электронной пары феноксид-иона, изображенной с помощью граничных структур I - IV.
Ряд изменения кислотности и основности можно представить следующим образом: Относительная основность: Относительная кислотность: Влияние заместителей на кислотность фенолов
Повышенная кислотность фенолов по сравнению с водой и со спиртами проявляется в способности фенолов образовывать с водными растворами щелочей и спиртовыми растворами алкоксидов соли, называемые феноксидами (фенолятами).
Фенолы, в отличие от карбоновых кислот, не растворяются в водном растворе гидрокарбоната натрия, но их можно выделить из соли действием угольной кислоты
Нерастворимое в воде соединение, которое растворяется в водном растворе щелочи, но не растворяется в водном растворе гидрокарбоната, с большой долей вероятности является фенолом. Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенол. Большинство фенолов (как и енолов) дают характерное окрашивание с водным и спиртовым раствором хлорида железа (III) FеС13 вследствие образования комплексных солей железа (цветная качественная реакция на фенолы). При этом фенол окрашивается в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый, а салициловая кислота Окисление Фенолы чувствительны к действию окислителей. Под действием хромовой кислоты фенол и гидрохинон окисляются до п -бензохинона, а пирокатехин до о- бензохинона.
Резорцин (м -дигидроксифенол), а также фенолы сложного строения окисляются с образованием сложных смесей в результате димеризации и диспропорционирования. Фенолы, содержащие разветвленные алкильные группы в орто -положении к группе ОН, применяют в качестве антиоксидантов, стабилизаторов полимерных материалов. Такие фенолы легко образуют очень устойчивые (малореакционноспособные) радикалы, вызывая тем самым обрыв радикально-цепных окислительных реакций.
Восстановление Фенолы гидрируются водородом над никелевым катализатором в соответствующие циклогексанолы. В значительных количествах в промышленности гидрированием фенола получают, в частности, циклогексанол, применяемый в производстве полимерных материалов, например полиамида «найлон-6,6» (см. п. 10.2).
Способы получения Щелочной плав сульфонатов
Гидролиз солей диазония
ПРОСТЫЕ ЭФИРЫ Простыми эфирами называются соединения общей формулы R-О-R, R-О-Ar. Если оба радикала одинаковы, эфир называют симметричным; если радикалы разные – несимметричным. Низшие простые эфиры называют по радикально-функциональной номенклатуре.
Простые эфиры сложного строения рассматривают как алканы или арены, в которых атом водорода замещен алкоксидной группой – алкоксиалканы или алкоксиарены:
Для некоторых ароматических эфиров часто применяют и тривиальные названия (даны в скобках)
Физические свойства Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях является газообразным) и имеют своеобразный запах. Простые эфиры имеют более низкие температуры кипения, чем спирты, так как в эфирах отсутствуют межмолекулярные водородные связи. По той же причине простые эфиры (кроме диметилового эфира) плохо растворимы в воде. Простые эфиры менее полярны, чем спирты, их дипольный момент составляет (4,0-4,3)∙10-30 Кл∙м. Химические свойства Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований, восстановителей и разбавленных кислот. В частности, эфиры не вступают в реакции с NaOH/Н2О, CH3MgI, Na, LiAlH4. Химическая инертность простых эфиров обусловливает их широкое применение в качестве растворителей в химических реакциях. Основность. Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с концентрированной серной кислотой, превращаясь при низкой температуре в кристаллические оксониевые соли.
Диэтиловый эфир используют в качестве растворителя в синтезах Гриньяра. Расщепление галогеноводороднымикислотами. Разрыв связи углерод-кислород происходит только в жестких условиях – при нагревании с концентрированными галогеноводородными кислотами НХ: HI > НВг > НС1 реакционная способность уменьшается Реакция представляет собой нуклеофильное замещение в протониро-ванном эфире, более реакционноспособном, чем нейтральная молекула эфира (сравните с реакцией замещения в спиртах).
Реакция протекает по механизму SN1 или SN2 в зависимости от строения алкильных групп. Реакции расщепления эфиров, содержащих первичные и вторичные алкильные группы, протекают по механизму SN2. Простые эфиры, содержащие третичную алкильную группу, расщепляются преимущественно по механизму SN1. Расщепление эфира может протекать и одновременно по двум механизмам - SN1 и SN2, что приводит к смеси двух алкилгалогенидов и двух спиртов. Расщепление арилалкиловых эфиров Ar-O-Alk всегда протекает только по связи ArO-Alk с образованием алкилгалогенида и фенола. Примеры: Реакции бимолекулярного нуклеофильного замещения
Способы получения Химические свойства Трехчленные циклические эфиры представляют собой простые эфиры, но трехчленный цикл, подобно циклопропану, является сильно напряженным и легко раскрывается в мягких условиях. Поэтому они очень реакционноспособные соединения. Реакции, катализируемые кислотами. Оксираны в присутствии кислот превращаются в ионы оксония, которые вступают в реакции замещения с большим количеством нуклеофильных реагентов.
Реакции раскрытия кольца непротонированной эпокиси. Более сильный нуклеофильный характер реагента компенсирует более низкую реакционную способность непротонированной эпокиси.
Четырехчленный циклический эфир - оксид триметилена (СН2)3О расщепляется труднее, чем этиленоксид. Оксид тетраметилена (тетрагидрофуран) представляет собой устойчивое соединение, которое часто используется в качестве растворителя. Способы получения КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ К этому классу относятся соединения, в состав которых входит карбонильная группа По правилам номенклатуры ИЮПАК при составлении названия альдегида и кетона за основу выбирают наиболее длинную углеродную цепь, которая включает карбонильную группу. Эта группа получает наименьший номер. К названию углеводорода, соответствующего главной цепи, прибавляют суффикс -аль для альдегидов или суффикс -он для кетонов. Если альдегидная группа соединена с циклом и является старшей, ее обозначают в суффиксе – карбальдегид.
В том случае, когда в молекуле присутствует не только карбонильная, но и более старшая группа, карбонильная группа обозначается префиксом оксо-.
Если альдегидная группа
Для некоторых альдегидов применяют тривиальные названия, соответствующие названиям карбоновых кислот (даны в скобках).
Тривиальное название «ацетон» общепринято для простейшего кетона.
Если в кетоне присутствует бензольный или нафталиновый цикл, то название кетона будет состоять из двух частей: первая часть - название ацильной группы, присоединенной к бензолу или нафталину, и вторая - офенон или онафтон.
Кетоны также называют по радикально-функциональной номенклатуре.
Физические свойства Альдегиды и кетоны имеют более высокие температуры кипения, чем неполярные соединения с близкой молекулярной массой, однако более низкие, чем соответствующие спирты. Указанные закономерности изменения температур кипения объясняются тем, что в альдегидах и кетонах отсутствуют межмолекулярные водородные связи. Вместе с тем и альдегиды, и кетоны склонны к межмолекулярной ассоциации за счет диполь-дипольных взаимодействий. Формальдегид - газ с острым запахом, растворим в воде. Его используют в виде водного раствора с массовой долей 40 %, который называют формалином. Низшие альдегиды имеют резкий запах. Высшие гомологи имеют запах цветов и фруктов. Низшие альдегиды и кетоны заметно растворимы в воде. Растворимость резко уменьшается, когда число атомов углерода в молекуле равно или более пяти. Ароматические альдегиды и кетоны - бесцветные высококипящие жидкости или твердые соединения, плохо растворимые в воде. Многие ароматические альдегиды и кетоны обладают резким запахом, часто приятным. Химические свойства Восстановление В результате каталитического гидрирования альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные.
Литийалюминийгидрид* LiAlН4 – удобный, но дорогой восстанавливающий агент, используют для синтеза спиртов, которые менее доступны, чем карбонильные соединения. Эта реакция представляет собой нуклеофильное присоединение: нуклеофилом является водород, переносимый вместе с парой электронов
Образовавшийся таким образом комплексный алкоксид алюминия подвергается гидролитическому расщеплению.
Литийалюминийгидрид обычно восстанавливает карбонильные группы, не затрагивая двойные углерод-углеродные связи.
Альдегиды и кетоны можно восстанавливать в углеводороды при действии амальгамированного цинка и концентрированной соляной кислоты (восстановление по Клемменсену).
Окисление Альдегиды легко окисляются даже при действии таких слабых окислителей, как ион серебра.
Эта реакция используется главным образом для идентификации альдегидов. Как способ получения она представляет интерес только в тех случаях, когда альдегиды более доступны, чем кислоты. Окисление кетонов требует разрыва углерод-углеродной связи и поэтому происходит лишь в довольно жестких условиях (исключение составляет галоформная реакция). Реакция редко представляет интерес для синтеза; кетоны расщепляются с обеих сторон карбонильной группы, приводя к образованию смеси продуктов.
Важное значение имеет окисление циклических кетонов, которое приводит к дикарбоновым кислотам.
Способы получения Карбоновые кислоты Карбоновые кислоты содержат карбоксильную группу При составлении названия карбоновой кислоты алифатического ряда по номенклатуре ИЮПАК за основу берут наиболее длинную углеродную цепь, включающую карбоксильную группу. Нумерацию цепи начинают с атома углерода карбоксильной группы. К названию углеводорода по числу атомов углерода в главной цепи прибавляют суффикс -овая кислота.
Для первых членов гомологического ряда карбоновых кислот используют тривиальные названия. Их применяют и для замещенных карбоновых кислот, обозначая положения заместителей буквами a, b, g и т. д.
Для построения названия производных кислот следует знать названия ацилов и ацилатов этих кислот (табл. 4).
Таблица 4 Химические свойства Карбоксил представляет собой сочетание карбонильной и гидроксильной групп. Свойства одной группы зависят от присутствия другой и не являются типичными свойствами альдегидов или спиртов, хотя существует значительное сходство в поведении гидроксильной группы в кислотах и спиртах, а карбонильной группы – в кислотах и альдегидах и кетонах. Восстановление кислот Карбоновые кислоты восстанавливаются до спиртов действием литийалюминийгидрида.
Декарбоксилирование кислот Декарбоксилирование кислот происходит при сплавлении с натронной известью.
Для ароматических кислот:
Электролиз солей карбоновых кислот (синтез Кольбе) также происходит с отщеплением диоксида углерода.
Способы получения Окисление первичных спиртов При нагревании первичных спиртов с водным раствором перманганата калия получают карбоновые кислоты
Окисление алкилбензолов Это один из наиболее часто применяемых способов получения ароматических кислот. Окисление проводят либо при кипячении углеводорода с перманганатом калия, либо кислородом воздуха в присутствии катализаторов окисления.
Гидролиз нитрилов Реакцию гидролиза производных карбоновых кислот часто применяют в лабораторной практике. Нитрилы гидролизуют при нагревании (как правило, при кипячении) с водными растворами минеральных кислот (реже – щелочей).
Химические свойства Реакционная способность Ацильные соединения, т.е. карбоновые кислоты и их функциональные производные, вступают в реакции нуклеофильного замещения групп Х: –ОН, –Сl, –OCOR, –OR, NH2.
Первая стадия нуклеофильной атаки по карбонильному углероду одинакова для альдегидов, кетонов и ацильных соединений – образование продукта присоединения по двойной связи. Как и в случае альдегидов и кетонов, пространственные и электронные факторы делают карбонильную группу доступной для атаки нуклеофильным реагентом: а) атака нуклеофила по углероду плоской группы
В случае ацильных соединений стабилизация промежуточного аниона происходит путем отщепления групп, которые являются слабыми основаниями Сly, RCOOy или сравнительно сильными основаниями R1Oy, NH2y. У альдегидов и кетонов во второй стадии реакции не происходит отщепления ионов Нy или Ry, так как они являются самыми сильными основаниями и, следовательно, очень “плохими” уходящими группами, поэтому вместо отщепления Нy или Ry происходит присоединение НÅ. Таким образом, нуклеофильное замещение в ацильных производных происходит в две стадии: 1) нуклеофильное присоединение по двойной связи
По легкости протекания второй стадии ацильные производные располагаются в следующий ряд:
Как и в реакциях альдегидов и кетонов, в случае слабого нуклеофила (Н2О, RОН) реакция катализируется кислотой: во-первых, протон НÅ делает карбонильную группу более доступной для нуклеофильной атаки (I), во-вторых, в этом случае образуется устойчивый незаряженный промежуточный продукт (II)
Хлорангидриды и ангидриды очень реакционноспособные соединения; даже со слабыми нуклеофилами они реагируют без катализатора. Например, хлористый ацетил бурно реагирует с водой, хлорангидриды ароматических кислот менее реакционноспособны. Рис. 5. Очищающее действие мыла Твердые жиры устойчивы в хранении. Поэтому жидкие растительные масла часто подвергают отверждению. Этот процесс заключается в гидрировании (Ni, 200 оС, 0,2-1,5 МПа (2-15 атм)) двойных связей ненасыщенных карбоновых кислот в молекулах триглицеридов. Как правило, проводят лишь частичное гидрирование, сохраняя часть двойных связей в углеводородных фрагментах незатронутыми. Это позволяет избежать чрезмерного повышения температуры плавления гидрированного жира. Гидрированные жиры сходны во всех отношениях с природными твердыми жирами. Их используют для приготовления маргарина. Гидрирование растительных масел имеет нежелательное свойство: незатронутые при гидрировании двойные связи, имеющие цис -конфигурацию в природном растительном масле, приобретают транс -конфигурацию в гидрированном продукте. Полагают, что значительное употребление в пищу таких «транс -жиров» может стать причиной ряда сердечных и онкологических заболеваний. Воски – исторически сложившееся название разных по составу и происхождению продуктов, преимущественно природных, которые по свойствам близки пчелиному воску. Природные воски представляют собой пластичные, легко размягчающиеся при нагревании продукты, большинство из которых плавится в интервале температур 40-90 °С. Большинство природных восков содержит сложные эфиры одноосновных насыщенных карбоновых кислот нормального строения, таких как пальмитиновая, гексаэйкозановая или октаэйкозановая, и высших неразветвленных одноатомных спиртов с 12-46 атомами углерода в молекуле, например, 1-октадеканол (стеариловый) С17Н35СН2ОН, 1-триаконтанол (мирициловый) н-С29Н59СН2ОН или 9-октадеценол-1 СН3(СН2)7–СН=СН–(СН2)7СН2ОН. Типичным примером служит пчелинный воск, который содержит, в частности, мирициловый эфир пальмитиновой кислоты С15Н31СООС30Н61. Такие воски по химическим свойствам близки к жирам (триглицеридам), но омыляются только в щелочной среде. Иногда природные продукты, не содержащие сложные эфиры, например, парафин, называют аналогами воска или воскоподобными материалами. СУЛЬФОновые КИСЛОТЫ Сульфоновые кислоты (сульфокислоты) содержат функциональную группу – SO2OH. Сульфоновые кислоты классифицируют в зависимости от природы углеводородного радикала (ароматические, гетероциклические и алкансульфокислоты) и количества сульфогрупп.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 474; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.171.20 (0.155 с.) |


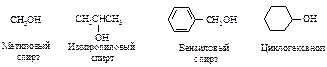




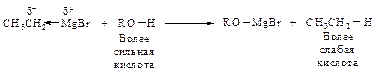
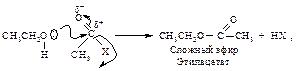
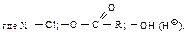
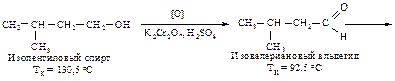

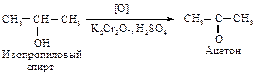


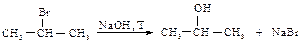


 . Более высокая температура кипения фенола (182 °С) по сравнению с температурой кипения циклогексанола (161 °С) также связана с тем, что в феноле прочнее водородные связи.
. Более высокая температура кипения фенола (182 °С) по сравнению с температурой кипения циклогексанола (161 °С) также связана с тем, что в феноле прочнее водородные связи. . Растворимость гомологов фенола ниже, двух- и трехатомных фенолов – выше.
. Растворимость гомологов фенола ниже, двух- и трехатомных фенолов – выше.





 G – электроноакцепторная группа: –NO2,–Hal,
G – электроноакцепторная группа: –NO2,–Hal,  ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
 G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность


 - в красный цвет.
- в красный цвет.

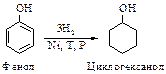



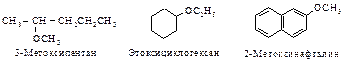
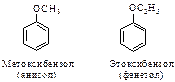

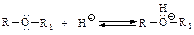



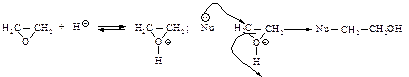
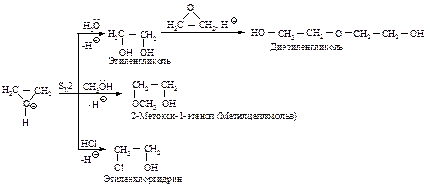
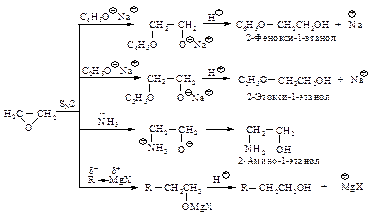

 связанная с углеводородным радикалом и водородом, - альдегиды
связанная с углеводородным радикалом и водородом, - альдегиды  или с двумя углеводородными радикалами - кетоны
или с двумя углеводородными радикалами - кетоны 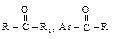 .
.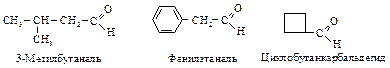
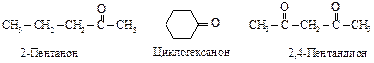

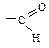 связана с циклом, ее название в префиксе – формил.
связана с циклом, ее название в префиксе – формил.
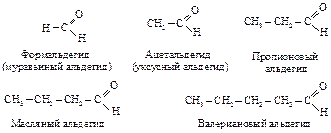

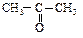
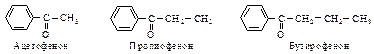
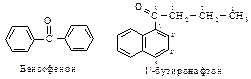
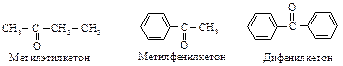


 от металла на карбонильный углерод. Реакция ведется в эфире.
от металла на карбонильный углерод. Реакция ведется в эфире.






 , онаможет быть связана с алкильным или арильным радикалом. Число карбоксильных групп определяет основность кислот.
, онаможет быть связана с алкильным или арильным радикалом. Число карбоксильных групп определяет основность кислот.
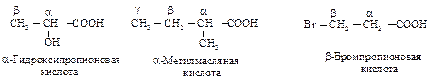




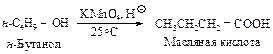
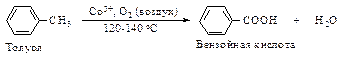

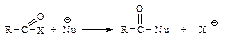
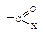 не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
не затруднена, тригональный углерод относительно беспрепятственно превращается в тетраэдрический промежуточный продукт (III); б) электроотрицательный кислород легко приобретает и несет на себе отрицательный заряд, возникающий в промежуточном соединении; дальнейшее превращение ионов (I) и (III) различно: промежуточный продукт, образующийся из альдегидов и кетонов (I), присоединяя протон, дает продукт присоединения (II), а промежуточный продукт, образующийся из ацильного производного (III), отщепляет группу Х, и в результате образуется продукт замещения (IV).
 с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду
с образованием промежуточного тетраэдрического продукта; 2) стабилизация последнего путем отщепления группы Хy (уходящая группа). Способность быть “хорошей” уходящей группой соответственно уменьшается в ряду