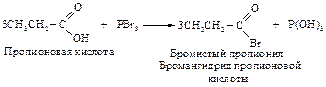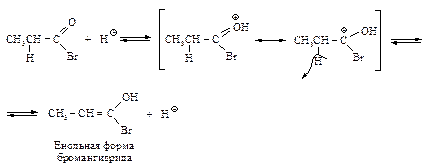Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции, сопровождающиеся разрывом связи С-ОН. Превращение в функциональные производные
Превращение в галогенангидриды
Превращение в ангидриды
Превращение в эфиры
Эта реакция обратима. Катализатор ускоряет как прямую реакцию – этерификацию, так и обратную реакцию – гидролиз. Равновесие можно сдвинуть в сторону образования сложного эфира, используя в избытке более дешевое исходное соединение: спирт или кислоту, или удаляя один из продуктов из реакционной смеси. Объемные группы, содержащиеся около реакционного центра в кислоте или спирте, затрудняют реакцию. В некоторых случаях пространственные препятствия для сближения молекул настолько велики, что необходимы специальные методы получения сложных эфиров. Реакционная способность в реакции этерификации уменьшается в ряду спиртов: СН3ОН > первичные > вторичные > третичные; в ряду кислот: НСООН > СН3СООН > RСН2СООН > R1R2CНСООН > R1R2R3CСООН. Механизм реакции. Роль катализатора состоит в протонировании карбонильного кислорода, при этом карбонильный углерод приобретает больший положительный заряд.
Реакционный центр атакуется нуклеофилом – молекулой спирта с образованием иона (I), который быстро превращается в промежуточный продукт (II) путем переноса протона.
Отрыв молекулы воды приводит к достаточно устойчивому катиону (III), который с отщеплением протона превращается в сложный эфир (IV).
Присоединение протона к молекуле спирта делает спирт нереакционноспособным.
Этот антикаталитический эффект при низких концентрациях минеральной кислоты не препятствуют протеканию реакции, т.к. перекрывается увеличением реакционной способности кислот за счет протонирования карбонильного кислорода. Более высокая концентрация H2SO4 замедляет реакцию. Сложные эфиры можно получать ацилированием спиртов ангидридами или хлорангидридами кислот.
Превращение в амиды
Амиды могут быть получены ацилированием аммиака или аминов хлорангидридами или ангидридами.
Превращение в нитрилы RC≡N можно осуществить нагреванием амидов с фосфорным ангидридом.
Другой путь получения нитрилов – реакция галогеналканов с солями синильной кислоты.
Реакции замещения у a-углеродного атома. Реакция Гелля-Фольгарда-Зелинского Карбоновые кислоты реагируют с бромом или хлором в присутствии небольших количеств фосфора с образованием a-галогензамещенных кислот.
Реакция состоит во взаимодействии первоначально образующегося бромангидрида с бромом.
Эта реакция по механизму аналогична реакции кислотно-каталитического галогенирования кетонов. Для этой реакции необходимы только каталитические количества PBr3, поскольку образовавшийся бромангидрид a-бромпропионовой кислоты, взаимодействуя с исходной пропионовой кислотой, превращается в a-бромпропионовую кислоту, регенерируя при этом бромангидрид пропионовой кислоты.
Галоген в этих кислотах так же, как в галогеналканах, замещается при действии нуклеофильных реагентов CNy, HOy, NH3, Iy или отщепляется при действии спиртового раствора щелочи (рис. 3.). Восстановление кислот Карбоновые кислоты восстанавливаются до спиртов действием литийалюминийгидрида.
Декарбоксилирование кислот Декарбоксилирование кислот происходит при сплавлении с натронной известью.
Для ароматических кислот:
Электролиз солей карбоновых кислот (синтез Кольбе) также происходит с отщеплением диоксида углерода.
|
|||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 288; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.107.241 (0.006 с.) |
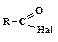 . Замещение ОН-группы на хлор осуществляется с помощью тионилхлорида SOCl2, треххлористого фосфора PCl3 или пятихлористого фосфора PCl5.
. Замещение ОН-группы на хлор осуществляется с помощью тионилхлорида SOCl2, треххлористого фосфора PCl3 или пятихлористого фосфора PCl5.
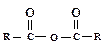 . Ангидриды могут быть получены из карбоновых кислот дегидратацией с помощью Р2О5, а также при взаимодействии хлорангидридов и солей карбоновых кислот.
. Ангидриды могут быть получены из карбоновых кислот дегидратацией с помощью Р2О5, а также при взаимодействии хлорангидридов и солей карбоновых кислот.
 . Сложные эфиры образуются при взаимодействии карбоновых кислот со спиртами в присутствии сильных минеральных кислот (реакция этерификации).
. Сложные эфиры образуются при взаимодействии карбоновых кислот со спиртами в присутствии сильных минеральных кислот (реакция этерификации).





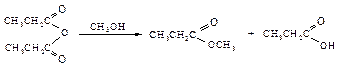
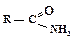 .Амиды получают путем нагревания аммонийных солей карбоновых кислот.
.Амиды получают путем нагревания аммонийных солей карбоновых кислот.