
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхнево-активні речовини.
Стосовно води усі речовини поділяють на поверхнево- активні (ПАР) та поверхнево-інактивні (П-інАР). Такий поділ речовин є умовній, бо велика кількість речовин, які є ПАР у водних розчинах, в інших розчинниках є П-інАР. Для інших розчинників, крім води,ют кож підібрати ПАР. ПАР-це речовини, щор адсорбуються на поверхні поділу фаз ( Здатність ПАР адсорбуватись на поверзневі води визначається особливістю їхньої будови. Схематично молекули ПАР можна зобразити у вигляді кульки з довгим хвостом (рис.4.2)
Молекула ПАР складається з неполярної групи (карбогідрогенного радикалу) та полярної функціональної групи. Перша є гідрофобна (відштовхує воду), а друга –гідрофільна (притягує воду, взаємодіє з нею). Молекули ПАР такої будови називають дифільними, тобто мають два(ді) вподобання (філ). Найвигіднішим енергетичним станом дифільних молекул є їх розташування на межі поділу фаз. 4.3.2 Насичений і ненасичений мономолекулярний поверхневий шар. «Двовимірний газ». Моношар- це поверхнева пліка з одного шару молекул ПАР, що утворюється на межі водним розчиом ПАР і повітрям, органічною рідиною або твердою поверхню.В залежності від концентрації ПАР на поверхні принциповао можливі принаймні 3 випадки орієнтації (рис 4.3.)
Рис.4.3. Зміна орієнтації молекул ПАР при збільшенні концентрації (від (а) до(в)) При низькій концентрації ПАР її молекули вільно переміщаються по поверхні у двох вимірах. Тому такий стан називають двовимірним газом (сильнорозріджена плівка ПАР). Дійсно, між поверхневим тиском (П),який створюють гідрлфобні кінці молекул ПАР і загальною площею (С), яку займають (н) молей ПАР існує співвідношення πS = nRT (4-2) Воно дійсно є аналогією рівнянню Клаперона-Мендєлєєва для тривимірного ідеального газу PV = nRT (1-1),(1-6) Основна храктеристика нерозчинних у воді моношарів ПАР є ізотерма поверхневий тиск-поверхня (π-S) (Рис.4.4.)
Рис.4.4. Залежність поверхневого тиску від велечини поверхні для розчину ПАР (стану мономолекулярного шару).
Ця ізотерма дуже подібна до кривих (ізотерм) конденсації звичайних газів згідно з рівнянням Ван-дер-Ваальса (Р-V) (Рис 1.2.) Ці аналогії (рівняння та ізотерми)приводять до висновку, що ці явища подібні.
Розглянемо ізотерму стану мономолекулярного шару. Якщо двовимірний газ розрідженний (стан г), то відстань між молекулами велика, і вони вільно рухаються. Зменшення площі їхнього розміщення зумовлює підвищення поверхневого тиску (π) молекул ПАР. 1. Для низьколетких ПАР при (S=S1 (р-г) у двовимірному газі починається двовимірна конденсація. Вона відбувається через зростання сил міжмолекулярної взаємодії, які прагнуть об’єднати молекули. 2. Кондесація триває при постійному тискові (π), досягаючи такого стану, Коли (S=Sx) і весь двовімірний газ переходить у двовимірну рідину (стан р) Коли (S˂Sx), моношар є практично не стислим і протидіє деформаціям різким збільшенням поверхневого тиску (π) (стан рідини). Якщо знати (Sx), то можна розрахувати площу (S0), яку займе одна молекула ПАР у моношарі двовимірної рідіни: n-кількість молей розчиненої речовини; NA -стала Авогадро (Число Авогадро* NA 6,022· N NA - кількість молекул на поверхні (Sx) Розрахунки показують, що площа, яку займає одна молекула, дорівнює площі Полярної групи ПАР. У гомологічному рядку жирних кислот площа, яку займають різні кислоти, виявляються однаковою для всіх кислот: S =0,205 Це підтверджує, що в моношарі гідрофобні хвости орієнтовані вертикально. Одноланцюгові ланцюгові амфіфільні молекули прагнуть до утворення у водному середовищі глобулярних міцел (рис.4.5). Міцела – це структурна колоїдна частинка дисперсної фази. Про це йтиметься далі. У випадку дволанцюгових амфіфільних молекул спостерігається тенденція до формування подвійних шарів у водних дисперсіях – пластинчатих структур
(рис.4.5,5) Таким шляхом утворюється, наприклад, біологічні мембрани. Можна припустити, що у разі дволанцюгових ПАР (а такі компоненти можуть бути у складі зв’язуючих друкарсь фарб) можливі утворення подвійних шарів як і моношарів у процесі зволоженення (змащення) елементів друкарської форми. Подумаємо, які наслідки можуть бути? У крайніх випадках гідрофізілізації замащенних елементів і гідрофобізації пробільних елементів ми маємо очікувати інверсію друкувальних і пробілних елементів.
Рівння адсорбції Гіббса Адсорбція на межі поділу рідина-газ, рідина-рідина. Як з’ясував Гіббс, розподіл розчиненої у розчині речовини відбувається так,що при цьому досягається максимальне зменшення поверхневого натягу.
Рівняння Гіббса є матиматичним обгрунтіванням загального правила: речовина, яка зменшує поверхневий натяг, концентрується у поверхневому шарі, і навпаки. Якщо σ зменьшеться при збільшенні с, то Граничне значення
Корисними на практиці є правило Дюкло-Таубе: Поверхнева активність (g) дифільних молекул (жирнрих кислот, спиртів т.і.) У водних розчинах однакової концентрації збільшується у 3-3.5 рази зі збільшенняч довжини карбогідроненого радикалу на одну (-C
Користуючись правилом Дюкло-Таубе можна підібрати ПАР потрібної поверхневої активності.
Для визначення адсорбції будують ізотерму поверхневого натягу Г. (рис.4.6, 4.7)
Із залежностей (рис.4.6) знаючи кут нахулу (АЛЬФА), визначають адсорбцію:
При високих концентраціях Г досягає свого граничного значення (Г∞) і далі не змінюється (рис. 4.7) (Г ∞) - постійна для всіх членів гомологічного ряду ПАР.
4.3.5. Адсорбція на межі тверде тіло-газ. Усі випадки поглинання газів і пари твердими тілами називають сорбцією. Якщо процес сорбції відбувається тільки на поверхні, то його називають адсорбцією. Адсорбцією – явище, коли речовинна, що поглинається поверхнею, дифундує у середину (об’єм) поглинаючої речовини і розподіляється по об’єму. Верде тіло, на поверхні якого відбувається адсорбція, називають адсорбентом, а речовину, яка адсорбується адсорботивом або адсорбатом. Процес, протилежний адсорбції – десорбція. Десорбція – це відокремлення адсорбованих молекул з поверхні шару адсорбенту. Коли швидкість десорбції зрівнюється зі швидкістю адсорбції наступає адсорбційна рівновага ( Отже розрізняють 2 види адсорбції: хімічну та фізичну. Першу називають також хемосорбцією. Фізична адсорбція зумовлена взаємодією поверхневих молекул адсорбенту з молекулами адсорбату. При цьому молекули адсорбату не втрачають своєї індивідуальності. Адсорбція відбувається тільки на певних ділянках адсорбенту, які мають надлишкову поверхневу енергію порівняно з площею поверхні. Для фізичної адсорбції характерна швидка оборотність процесу адсорбція-десорбція, зменшення адсорбції з підвищенням температури. Хімічна ж адсорбція часто зростає. Адсорбція залежить від тиску газу над поверхнею твердого адсорбенту. 4.3.5.1 Рівняння адсорбції Ленгмюра. Адсорбція газів твердим адсорбентом (позначають також А) описується рівнянням Ленгмюра:
Р- тиск газу (пари).
Ізотерма адсорбції Ленгмюра може нагадувати ізотерму адсорбції Гіббса (рис.4.7, 4.8) При низьких Р рівняннях Ленгмюра перетворюється у вираз: Тобто поверхнева концентрація газу Г прямо пропорційна тискові Р (рис.4.7, ділянка (І) При високих Р Р>>К і Г= 4.4 Адсорбція на межі поділу тверде тіло-розчин. Ізотерми адсорбції розчинених речовин із розчинів аналогічні ізотермам адсорбції газів. Для розведеннх розчинів ці ізотерми досить добре підпорядковуються рівнянню Ленгмюра. Адсорбція з розчинів порівняно з газовою адсорбцією має певні особливості: 1) На поверхні шару разом з молекулами розчиненої речовини можуть адсорбуватись і молекули розчинника. Тому можливі два різновиди адсорбції: додатна і від’ємна. В останньому випадку молекули розчинника краще адсорбуються за молекули розчиненої речовини. 2) Адсорбція з розчинів відбувається повільніше від адсорбції газів. Для прискорення встановлення адсорбційної рівноваги систему перемішують. 3) Підвищення температури розчину зменшує адсорбцію, але не так сильно, як адсорбцію газів. В залежності від природи розчиненої речовини (молекули чи йони) адсорбцію поділяють на молекулярну та йонну. Таким чином, на адсорбцію з розчинів впливають природа розчиненої речовини, природа розчинника, природа адсорбенту. 4.4.1 Адсорбція електролітів. Електроліти у водних розчинах знаходяться у вигляді йонів. Тому адсорбцією сильних електролітів з розчинів називають йонною. Йонна адсорбція – це хімічна реакція між йонами розчиненої речовини і твердою поверхнею адсорбенту. Енергії нового хімічного зв’язку недостатньо для того, щоб відірвати поверхнево активні атоми адсорбенту. Тому зберігаються зв’язок нової сполуки з твердим адсорбентом. Адсорбція йонів відбувається за двома основними механізмами: 1 – вибіркова адсорбція йонів на кристалах. 2 – еквівалентна або іонообмінна адсорбція. 4.4.2 Вибіркова адсорбція. Вибіркова адсорбція визначається вибірковістю адсорбції катіона або аніона. Правила вибіркова адсорбції сформульовано Панетом і Феянсом. Перше правило: Кристалічну гратку адсорбенту добувають ті йони, що входять до її складу, ізоморфні з її йонами й утворюють з йонами цієї гратки важкорозчинні сполуки. Друге правило: На твердій поверхні адсорбенту адсорбуються тільки ті йони, знак заряду яких протилежний заряду поверхні адсорбенту.
4.5. Змочування. Поверхневий натяг і міжмолекулярні взаємодії всередині фаз змочують процеси змочування і розтікання краплі рідини на тверді або рідинній поверхні, а також явища когезії та адгезії. Змочування. Маленька крапля рідини на твердій поверхні може набути різної форми: або близьку до сферичної (як крапля води на поверхні парафіну) вбо кляксу, оскільки розтікається по поверхні твердого матеріалу, подібного до краплі води на поверхні чистого скла. В першому випадку тверда поверхня не змочується рідиною, а в другому випадку змочується. Явище змочування впливає на перебіг багатьох процесів в природі та техніці, зокрема в поліграфічних технологіях. Це явище є початковоюб стадією взаємодії рідин з твердими тілами. За кількістю фаз, які беруть участь у процесі, можна виділити два різновиди змочування: Імерсійне та контактне. Перший випадок відповідає ситуації повного занурювання твердого тіла в рідину. В зволожуванні беруть участь дві фази: рідина і тверде тіло. В другому випадку змочування проходить за участю трьох фаз: твердої, рідинної та газоподібної, наприклад, крапля рідини на твердій поверхні (друкарська форма, папір, зокрема при струминному друці). Кількісною мірою змочування є кут, що утворюється краплню і твердою поверхнею (рис.4.9) Цей кут називають крайовим кутом змочування (_____).Значення (____) змінюється від 0 до 180(градусів). Велечину (___) відіграють між твердою поверхнею і дотичною до поверхні краплі в точці, спільній для усіх трьох фаз. Вимірювання кута проходять з боку рідини…
Рис 4.9
Зв'язок між кутом змочування і поверхневим натягом виражається рівнянням Юнга:
Де (або звідки); (рис.4.10.)
З рівняння Юнга випливає, що процесом змочування иожна керувати, змінюючи величини поверхневого натягу у системі. Найефективнішим методом є введення ПАР у рідинну фазу або попередня обробка твердої поверхні розчинами ПАР (гідрофілізація або гідрофобізація). Таким чином можна впливати на величину змочування, викликаючи навіть його інверсію, тобто поверхня, що раніше змочувалась стає такою, що не змочується, і навпаки. Повне змочування спостерігається при умові: Повне незмочування мало б бути при Загальна закономірність процесів змочування виявляється в тому, що чим вища полярність рідини, тим менше її змочувальні властивості. Високо полярна ртуть (меркурій) змочує тільки деякі метали. Вона змочує поверхні багатьох полярних речовин. Органічні рідини (спирти, бензол, гас, гексан) змочують практично будь-яку поверхню. Крайові кути змочування експериментально вимірюють, застосовуючи метод проектування краплі на екран за допомогою спеціального приладу або частіше, проектора.
4.5 Вибіркове змочування Звичайний інтерес являє змочування на межі твердої фази з двома рідинами, що не змішуються. Ці явища проявляються, зокрема, в офсетному друкарському процесі (плоский друк). Кожна рідина окремо може змочувати поверхню (приміром друкарської форми). Але при сумісній одна рідина змочує поверхню звийно краще, ніж інша. Рідина, що змочує краще тверду поверхню, називається рідиною, що вибірково змочує. Очевидно, що молекули цієї рідини активніше взаємодіють з твердою фазою. Розглянемо систему, що складається з твердої поверхні (Т), яка знаходиться в контакті з водою (В) та вуглеводнем (позначимо О – олія або М – мастило). Кут змочування завжди вимірюють з боку полярнішої рідини (В). За рівнянням Юнга При вибірковому змочуванні поверхні водою Або Це означає, що різниця полярності між твердою фазою і водою менше, ніж між твердою фазом і вуглеводнем (олією). Рис.4.11
Тверді поверхні, що вибірково змочуються, гідрофільними. В капілярі такі рідини утворюють угнутий меніск. Коли ж тверде тіло краще змочується неполярною (мало полярною) рідиною (О) меніск в капілярі буде опуклим і можна написати
Тверді поверхні, що вибірково змочуються неполярними рідинами, називають гідрофобними або олеофільними. Отож, можна з формулювати правило: з двох рідин змочує тверду поверхню та, у якої різниця полярностей з твердим тілом найменша, а енергія взаємодії найбільша. У випадку порошкоподібних або поруватих матеріалів вимірювання кута змочування Змочування твердої поверхні рідиною призводить до утворення нової межі поділу фаз: тверде тіло – рідина замість вихідної межі тверде тіло – газ повітря). Це супроводжується зменшенням поверхневої енергії Гіббса. Теплота змочування дорівнює зміні повної поверхневої енергії одного кілограму твердої речовини при перенесенні її з повітря у рідину і пов’язана зі зміною поверхневої енергії Гіббса-Гельмгольца.
Де:
Поверхневий натяг на межі тверда поверхня – повітря Для гідрофільних поверхонь (приміром, амфіфільні * елементи) теплота змочування водою більша, ніж органічними рідинами. Для гідрофобних поверхонь (друковальні елементи) спостерігається зворотна залежність. Питому поверхню (член
Веоичину В називають коефіцієнтом гідрофільності. Гідрофільні поверхні мають в>1, а гідрофобні - <1. 4.6. Розтікання Якшо на поверхню води або іншої рідини, нанести краплю нерозчинної у ній рідини, то вона иоже розтікатись по поверхні, а може не розтікатись. Розтікання пов’язане з поверхневим натягом на трьох поверхнях подвлу фаз: вода-повітря Довільно перебігають, як ми знаємо, процеси зі зменшенням поверхневої енергії Гіббса. Припустимо, що: У цьому випадку розтікання не відбувається, а сили тяжіння надають краплі сферичного вигляду (рис.4.12а) Якщо ж співвідношення величин поверхневого натягу буде іншим:
То для зменшення поверхневої енергії повинен перебігати процес скорочення поділу повітря-вода і збільшення поверхні поділу вода-олія (крапля) і крапля повітря. Крапля розтікатиметься поверхнею води і набуватиме вігляду лінзи (рис.4.12.б.) 4.12б.
Мірою розтікання є коефіцієнт розтікання f:
Тобто f – це зміна енергії Гіббса на одиниці плoщі поверхні в процесі розтікання. З іншого боку:
Отже, умови розтікання є такі: розтікання f >0, Відсутність розтікання: f ˂0, Когезія та адгезія Явища змочування і розтікання пов’язані з дією сил когезії і адгезії. Когезія – це зчепність однорідних молекул, атомів чи йонів, за рахунок міжмолекулярних та міжатомного притягання всередині однієї фази. Когезія визначає існування речовини у конденсованому (рідкому чи твердому) стані. Адгезія (прилипання) - це молекулярне тяжіння шляхом дії фізичних або хімічних міжмолекулярних сил між поверхнями двох різнорідних фаз (твердих чи рідких), що межують,* Кідькісно когезію й адгезію характеризують величинами роботи когезії (cohesion) ( Робота когезії дорівнює енергії, яку треба витратити для розірвання сил зчеплення між молекулами даної фази. Чилельно це дорівнює подвоєнному значенню поверхневого натягу.
Це співвідношення відоме, як рівняння Дюпре. З рівняння Дюпре (4-27) видно, що робота адгезії тим більша, чим більші поверхневі натяги кожної з фаз на межі з повітрям і чим менший поверхневий натяг на межі поділу між фазами А та Б. Явище адгезії супроводжується зменшенням поверхневої енергії. Це означає, що при суміщенні різних фаз енергії Гіббсв системи зменьшеється на величину роботи когезії:
Явище когезії й адгезії відіграють роль у друкарських і після друкарських процесах поліграфічного виробництва. Згадаймо хоча б процеси фарбо перенесення і закріплення фарб, відшаровування, склеювання, тощо. 5. Фізико-хімія дисперсних систем. Термін “колоїдна” хімія, незважаючи на те, що його й сьогодні можна часто зустріти, має все ж історичне значення. Зараз на зміну йому прийшла нова “фізико-хімія дисперстних систем”, яка включає також поняття фізики та хімії поверхні. 5.1 Загальна характеристика дисперстних систем. Дисперстними називають системи, що складаються з великої кількості малих частинок, розподілених у рідкому, твердому або газо-подібному середовищах. Сукупність подрібленних частинок називається дисперсною фазою, яка знаходиться у дисперсійному середовищі – безперервній неподрібненій фазі. Для дисперсних систем характерні три ознаки: - гетерогенність. -дисперсність. -питома поверхня. Усі особливості колоїдних дисперсних систем є функціями або наслідками цих ознак. Гетерогеність, абр неоднорідність, чи багатофазовість свідчить про наявність міжфазової поверхні і пройесів, що відбуваються на міжфазових поверхнях поділу. Дисперсність, або подрібненість визначається розмірами тіла за трьома його вимірами. Дисперсії речовин, вірніше її складові частини можуть мати різну форму: Розгляньмо утворення дисперсної фази при зменшенні розмірів частинуи кубічної форми по трьох осях (рис.5.1) При значному зменшенні розмірів в одному вимірі (по осі Y) одержимо плівку, пбо пластину; при зменшенні розмірів куба у двох вимірах (по осях X та Y) одержимо капіляри. Зменьшення розмірів по всіх трьох осях (X,Y,Z) дає маленькі частинки. Дисперсність визначається величиною діаметра частинки (d). Або величиною, оберненою розміру діаметра (d): D =
Вверх Третя характеристика дисперсної системи. Питома поверхня – S- між фазова поверхня, V - об’єм дисперсної фази, m – маса дисперсної фази. Усі три характеристики дисперсних систем зв’язані між собою: зі зменшенням розмірів діаметра збільшується дисперсність та питома поверхня. Гетерогенність, або наявність між фазової поверхні передбачає наявність поверхневого натягу. Чим більша гетерогенність і чим різкіше відрізняються фази за природою, тим більший поверхневий натяг. 5.2. Класифікація дисперсних систем (ДС). В основу загальної класифікації ДС покладена відміність в агренативному стані дисперсної фази (ДФ) і дисперсійного середовища (ДСр). За трьома агрегатними станами виділяють вісві (дев’ять – один) типів ДС:
Отже умовно ДС позначають дробом, у якому чисельник вказує на агрегатний стан ДФ, а займенник – на ДСр. З наведеної класифікації видно, що усі ДС за кінетичними властивостями ДФ та за структурою ДСр можна поділити надва класи:
Отже, вільно дисперсні системи мають ДФ рухому, а зв’язанодисперсні системи мають тверде ДСр, у якомучастинки ДФ не можуть вільно рухатись. Класийіковані за агрегатним станом ДС у свою чергу класифікуються за дисперсністю. Звязанодисперсні системи класифікують за розмірами пор: мікропористі – 2-200нм; макропористі – вище 200нм. Вільнодисперсні системи класифікуються за розмірами частинок ДФ.
Залежно від агрегатного стану ДСр вільнодисперсні системи поділяюмься на: - Золі з газоподібним ДСр (аерозолі) та золі з рідким ДСр – лізолі(від lios (грецька)- рідина). За природою середовища лізолі поділяють на: гідрозолі (середовище-вода) та оргаозолі (середовище органічна рідина). Якщо органічна речовина (рідина) – спирт (алкоголь), то органозоль називають алкоголем, якщо етер- етерозолем, а якщо естер- естерозолем. Наприклад друкарські фарби флексографічного або глибокого друку на бутилацетаті є есстерозолі. - Існує також класифікація за топографічною ознакою (на відмінність форми частинок): - Корпускулярні (частинки ДФ малі у трьох вимірах) - Фібрилярні (волокнисті) (частинки ДФ малі у одному вимірі). За термодинамічною стійкістю і характером утворення розрізняють ліофобні та ліофільні ДС. Ліофобні утворюються з переначисенних систем внаслідок подрібнення великих частинок, тому вони термоденамічно не стійкі (наприклад фарби, концентровані речовини). Ліофільні ДС утворюються шляхом довільного диспергування. Отже, вони є термоденічно стійкими. Класифікація за фазовою відмінністю: - Міцелярні ДС - Макромолекулярні ДС.
5.3. Методи одержання колоїдно-дисперсних систем. З наведеної вище класифікації дисперсних систем зробити висновок, що колоїдні розчини, або золі займають проміжне положення між молекулярно йонними розчинами з розмірамии частинок, меншими за ( Існує два методи одержання колоїдних розчинів: конденсаційний та диспергаційний (т.т. можна скласти частинки з менших або подрібнити крупні частинки). Рим.5.2.
Конденсація Диспергування Рис.5.2. Одержання колоїдних розчинів. Конденсаційний метод полягає в утворенні дисперсних частинок за рахунок агрегації молекул або йонів. Диспергіційний метод полягає у подрібленні великих частинок грубої дисперсії до стану колоїдної дисперсності. Отже, в обох методах суть полягає у створені нової фаз из колоїдним ступенем дисперсності. 5.3.1. Кондесаційні методи Кондесаційні методи поділяються на методи: Фізичної та хімічної Конденсації. Загальна умова для створення нової фази – стан перенасичення розчину або пари, внаслідок чого утворюється агрегат из кількох молекул, які стають зародками нової фази. Чим більша кількість зародків (центрів кристалізації) і менша швидкусть зростання агрегатів (кристалів), тим вища дисперсність золю. 5.3.1.1. Фізична конденсація - Заміна розчинника. При додаванні невеликої кількості істинного розчину речовини до розчинника, в якому ця речовина нерозчинна або малорозчинна, відбувається видцлення речовини у вигляді високодисперсної системи. Наприклад, каніфоль розчинається в єталоні з утворенням істинного розчину. При додаванні до такого розчину води, яка не розчиняє каніфоль, утворюється стійкий зольканіфолю. (як правило спиртовий розчин додають до води). -Конденсація пари При прпусканні пари речовини у рцдину при кондеснації пари утворюється золь. До цього методу можна віднести одержання дисперсій металів, що розпорошують у вольтовійдузі або в іскровому високочастотному розряді в органічній речовині або воді. Цікавий метод Рогинського-Шальникова одержання гідрозолів та органозолів високого ступення чистоти. Суть методу видно з (рис.5.3) Рис.5.3.
Цим методом одержали органозолі сірки селену, фосфору, калію, натрію, олива (свинцю) Чи можна отримувати методом фізичної конденсації (Рогинського-Шальникова) – золі алюмінію та забарвлених алюмінієвих дисперсій, т.т. чи можна отримати металізовані друкарські фарби? - або люмінорні системи (дисперсна фаза – люмінофори, зокрема люмінори, тобто органічні люмінофори)? - або пігментнізолі (т.т. пігментовані фарби)? -Чи системи олея – вода та вода – олія? 5.3.1.2. Хімія конденсація. При хімічній конденсаціі нова тверда фаза виникає внаслідок реакцій, продуктами яких є нерозчинні в реакційному середовищі речовини. Такими реакціями можуть бути подвійний оюмін, окислення – відновлення, гідроліз. Високодисперні золі одержуютьпри внесенні в розведений розчин одного реагкнту невеликої кількості концентрованого розчину другого реактиву. Останній відіграє роль стабілізатора. Нова дисперсна фаза спочатку досить часто має аморфну будову і складається з агрегатів нерозчиненної речовини. З часом тверда фаза набуває кристалічної структури. Отже, для одержання золю необхідно виконати три головні умови: -Дисперсна фаза повинна бути нерозчинна у дисперсійному середовищі; - система повинна мати стабілізатор, який надає ій стійкості (концентрований розчин одного з реагентів можливо полімер, ПАР); -розмір дисперсної фази В основу більшості кондесаційних методів одержання колоїдних розчинів покладено різномаанітні хімічні реакції. -Так, реакції подвійного обміну дозволяють одержати золі важкорозчинних сполук.
Умова:? Один з реагентів є у надлишку.Тоді йодид срібла не випадає в осад, а утворює колоїдний розчин.
Реакції відновлення (одержання золю срібла)
Прозорі для видимого світла золі срібла використовують, наприклад, як фільтрові шари в кольорових фотографічних матеріалах, що розглядатимуться в курсі “Теорія фотографічних процесів” Реакції окиснення (одержання золю сірки)
Реакції гідролізу (золі гідроксидів і основних солей важких металів)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 1309; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.199.162 (0.192 с.) |
 ) та знижують між фазову вульну поверхневу енергію (поверхневий натяг) (
) та знижують між фазову вульну поверхневу енергію (поверхневий натяг) ( ). ПАР поділяють на йонні та нейонні, айонні, катіонні а також амфолітні.
). ПАР поділяють на йонні та нейонні, айонні, катіонні а також амфолітні.

 Літерами р і г позначені стани: газоподібний (г), рідкий (р), та одночасно існування рідкого (р) та газоподібного (г) станів (р+г)
Літерами р і г позначені стани: газоподібний (г), рідкий (р), та одночасно існування рідкого (р) та газоподібного (г) станів (р+г) ;
;
 ,
, .
.
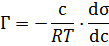
 і адсорбція (Г > 0) буде мати додатнє значення. Така адсорбція позитивна. Якщо ж
і адсорбція (Г > 0) буде мати додатнє значення. Така адсорбція позитивна. Якщо ж 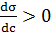 і σ збільшується зі зростанням концентрації розчиненної речовини, то адсорбція буде негативною.
і σ збільшується зі зростанням концентрації розчиненної речовини, то адсорбція буде негативною. при c
при c  0 -(
0 -( g- поверхова активність,
g- поверхова активність,
 -) группу:
-) группу: та
та 

 (4-5)
(4-5) Природа адсорбційних сил може бути: специфічна (хімічна) та неспецифічна (фізична).
Природа адсорбційних сил може бути: специфічна (хімічна) та неспецифічна (фізична).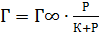 , де: К- коефіцієнт пропорційності,
, де: К- коефіцієнт пропорційності,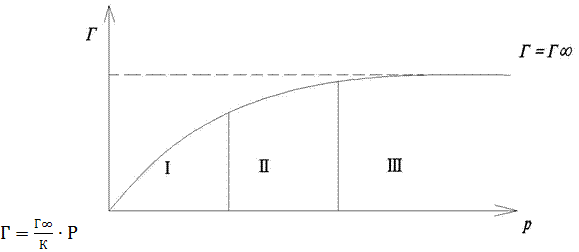
 т.ч. кількість адсорбованих молекул дорівнює кількості активних центрів і адсорбція досягає граничного значення
т.ч. кількість адсорбованих молекул дорівнює кількості активних центрів і адсорбція досягає граничного значення  (рис.4.8. ділянка (ІІІ)
(рис.4.8. ділянка (ІІІ)


 (4.10, 4.11)
(4.10, 4.11) (4.12)
(4.12) Але повного незмочування ніколи не буває, оскільки завжди є сили взаємодії між рідиною та твердим тілом. Звичайно вважають змочування, коли
Але повного незмочування ніколи не буває, оскільки завжди є сили взаємодії між рідиною та твердим тілом. Звичайно вважають змочування, коли  , а при
, а при 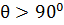 – незмочування.
– незмочування.
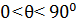

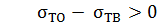
 (4.15)
(4.15)  0 або (4.16)
0 або (4.16)  (4.17)
(4.17) є складною проблемою. Тому використовують дві інші характеристики процесу змочування. Наприклад, можна кількісно визначити калориметричним методом теплоту змочування, яка виділяється при занурюванні твердого тіла у рідину. Теплоту змочування звичайно відносять до одиниці поверхні (
є складною проблемою. Тому використовують дві інші характеристики процесу змочування. Наприклад, можна кількісно визначити калориметричним методом теплоту змочування, яка виділяється при занурюванні твердого тіла у рідину. Теплоту змочування звичайно відносять до одиниці поверхні ( ) або маси (кг) речовини.
) або маси (кг) речовини.

 - поверхнева енергія одиниці поверхні;
- поверхнева енергія одиниці поверхні; – питома поверхня твердої речовини, (
– питома поверхня твердої речовини, ( – теплота змочування.
– теплота змочування. )завжди більший, ніж на межі тверда поверхня – рідина
)завжди більший, ніж на межі тверда поверхня – рідина  )Ось чому при змочуванні теплота виділяється.
)Ось чому при змочуванні теплота виділяється. з рівняння (4-18), можна визначити теплоту змочування порошкової речовини абп твердого тіла водою
з рівняння (4-18), можна визначити теплоту змочування порошкової речовини абп твердого тіла водою  і досліджуватаним рідким вуглеводнем (олією)
і досліджуватаним рідким вуглеводнем (олією)  і знайти відношення цих двох величин.
і знайти відношення цих двох величин.
 , вода-олійна крапля
, вода-олійна крапля 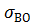 і крапля-повітря
і крапля-повітря 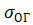 .
. (4.20)
(4.20)
 (4.22)
(4.22) (4.23)
(4.23) (4.24)
(4.24) (4.25)
(4.25) ) та роботи адгезії (adhesion) (
) та роботи адгезії (adhesion) (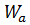 ).
). (4.26)
(4.26)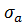 ) та Б – повітря (
) та Б – повітря ( ), для чого потрібна робота, що дорівнює сумі
), для чого потрібна робота, що дорівнює сумі  . Оскільки при тім зникла поверхня поділу А-Б (
. Оскільки при тім зникла поверхня поділу А-Б ( ), то виділилась повна кількість енергії, що дорівнює (
), то виділилась повна кількість енергії, що дорівнює ( ) (4.27)
) (4.27) (4.28)
(4.28) , де
, де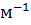 )
) ,
,  , де
, де



 м). Отже золі – це дисперсні систем из розмірами частинок від
м). Отже золі – це дисперсні систем из розмірами частинок від  до
до  м), або 1-100нм, т.т їхній розмір менше довжини хвилі світла видимого діапазону (як і УФ).
м), або 1-100нм, т.т їхній розмір менше довжини хвилі світла видимого діапазону (як і УФ). м
м
 або
або  надлишок
надлишок – важко розчинна сполука
– важко розчинна сполука






