Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика забору біоптатів ендометрія під час гістероскопії та їх дослідження
Для вивчення особливостей морфологічної картини ендометрія та оцінки адекватності секреторних перетворень в ньому пацієнткам в програмі ДРТ проводиться гістологічне дослідження гістеробіоптатів та вишкрібів ендометрія. Біопсія проводиться з патологічних його осередків при наявності вогнищевих патологічних змін слизової та при відсутності візуальної патології (з передньої і (або) задньої стінок). У випадку виявлення поліфакторної патології слизової матки дослідженню слід піддавати декілька біоптатів, отриманих з різних патологічних ділянок. При наявності тотального ураження ендометріяпатологічним процесом проводиться діагностичне вишкрібання стінок порожнини матки. Морфологічному дослідженню слідтакож піддавати поліпи ендометрія та цервікального каналу, видалені під час гістероскопії. Після забору матеріалу проводиться його фіксація 5% розчином формаліну. Кількість фіксуючої рідини повинна в 20 разів перевищувати об'єм досліджуваного матеріалу. Тривалість фіксації 12 та більше год. Далі гістологічне дослідження проводиться за загальноприйнятою методикою. Критеріями повноцінної секреторної трансформації в період середньої фази стадії секреції, що відповідає 20-22 дням 28-денного менструального циклу є наступна морфологічна картина ендометрія: чіткий розподіл на глибокий і поверхневий шари; наявність в глибокому шарі великої кількості розвинутих залоз і невеликої кількості строми, у поверхневому шарі (компактному) – менш звивистих залоз і багато сполучнотканинних клітин; розширений просвіт залоз з низьким однорядним епітелієм із базально розташованими ядрами, нерівним апікальним краєм; периваскулярна реакція строми, наявність глікогену в цитоплазмі клітин; різко звивисті спіральні артерії, які утворюють “мотки”, визначаються не лише в глибоких відділах функціонального шару, а і в поверхневих відділах компактного (наявність “мотків” спіральних артерій – індикатор готовності ендометрія до імплантації); розширені вени. Для оцінки мікробіоценозу ендометрія проводиться мікробіологічне дослідження гістеробіоптатів. При наявності ознак хронічного ендометриту біопсію слід проводити з цих ділянок. Беручи до уваги результати, отримані нами при мікробіологічному дослідженні ендометрія у пацієнток при підготовці до ДРТ, рекомендуємо у даного контингенту жінок в обов’язковому порядку проводити діагностику на предмет виявлення наступних патогенних та умовно-патогенних збудників інфекції: за допомогою культурального дослідження – на наявність стафілококів, стрептококів, кишкової палички, дріжджових клітин роду Candida Albicans, гонококів; за допомогою ПЛР – на наявність ЗІПСШ – хламідії (Ch. trachomatis), мікоплазми (M.hominis, M. genitalium), уреаплазми (U.urealiticum), віруси (вірус простого герпесу (HSV 1,2), цитомегаловірус (CMV hominis)). Враховуючи складність програми ДРТ та можливість діагностичних помилок діагностику ЗІПСШ бажано доповнювати методом ПІФ (дослідження мазків-відбитків біоптатів ендометрія).
Бактеріологічне дослідження проводиться традиційним культуральним методом, за допомогою якого виділяють та ідентифікують патогенні та умовно-патогенні аеробні мікроорганізми з біоптатів ендометрія. Отриманий біоптат виводиться через тубус операційного каналу гістероскопа, в стерильних умовах забирається в пробірку з рідким поживним середовищем, де зберігається до моменту доставки його в лабораторію одразу після операції. Шматочки біоптата подрібнюються або розтираються в ступці з додаванням поживного бульйону, після чого проводиться висівання отриманої суміші досліджуваного матеріалу в чашки Петрі на тверді селективні поживні середовища. Матеріал інкубують при температурі 370С у термостаті протягом 1-2 діб, щоденно оцінюють. Отримані ізольовані колонії, а з них - чисті культури мікроорганізмів ідентифікують за морфологічними, тинкторіальними, культуральними та біохімічними властивостями згідно визначника бактерій Дж.Берджі. При появі росту на щільних середовищах в кожному конкретному випадку враховується сукупність ознак – визначають видовий склад мікроорганізмів, проводиться підрахунок колоній різної морфології, враховуючи співвідношення кожного виду шляхом підрахунку утворених колоній, однотипних за морфологією та іншими ознаками. Кількісні показники вираховують в десятичних логорифмах від кількості колоній-утворюючих одиниць. Крім того, враховують клінічні дані пацієнтки. Для орієнтовної оцінки кількісного співвідношення різних видів мікроорганізмів в асоціації використовують наступні критерії (при засіві досліджуваного матеріалу на чашку Петрі з твердим поживним середовищем): I – дуже бідний ріст (тільки на рідкому середовищі, на твердих середовищах немає); II – бідний ріст (на твердому середовищі до 10 колоній мікроорганізмів означеного виду); III – помірний ріст (на твердому середовищі від 10 до 100 колоній мікроорганізмів означеного виду); IV – густий ріст (на твердому середовищі більше 100 колоній).
Негативним вважається результат за відсутності росту колоній мікроорганізмів на твердому середовищі протягом 72 годин. I та II ступені росту розцінюють як контамінацію ендометрія патогенною та умовно-патогенною флорою, при III та IVступені росту мікроорганізмів одного типу на твердих середовищах свідчать про етіологічну роль даного мікроорганізму як імовірного збудника процесу. Однак, санацію інфекції ми рекомендуємо проводити при будь-якому ступені обсіменіння ендометрія. Після отримання чистих культур мікроорганізмів наступним етапом є визначення чутливості їх до антибіотиків, що враховується в подальшому для вибору лікувальної тактики. Контрольне обстеження після лікування проводиться аналогічним чином після менструації. Матеріалом для дослідження слугують зскрібки слизової з порожнини матки, отримані за допомогою одноразової щіточки uterobrash. Забір матеріалу для дослідження проводиться наступним чином: в стерильних умовах, не торкаючись стінок піхви, одноразова щіточка вводиться в порожнину матки за межі цервікального каналу і після легкого обертального руху обережно виводиться з неї. Дана процедура проводиться після оголення шийки матки в дзеркалах, протирання її змоченим розчином спирту, а потім – сухим ватним тампоном для видалення слизової пробки з глибини цервікального каналу та виключення контамінації отриманого матеріалу флорою цервікального каналу. Отриманий біосубстрат поміщається у пробірку з рідким поживним середовищем, після чого в лабораторних умовах проводиться висівання досліджуваного матеріалу в чашки Петрі на тверді селективні поживні середовища. Далі бактеріологічне дослідження проводиться за описаною вище методикою. Для мікробіологічного дослідження біоптатів ендометрія за допомогою РПІФ важливим етапом є приготування мазків. Для цього отриманий матеріал наноситься на чисті знежирені предметні скельця, отримують мазки – відбитки (при достатній кількості біопсійного матеріалу). При мізерних розмірах біоптата останній вносять в стерильну пробірку з 0,5 мл фізіологічного розчину, після чого центрифугують протягом 20 хв при 2000-3000 об./хв. З осаду наносять матеріал на спеціальне предметне скло з луночками, готуючи таким чином мазки. Для ідентифікації різних збудників інфекції матеріал наноситься на відповідну кількість окремих ділянок скла. Мазки висушуються на повітрі протягом 20-30 хвилин, після чого проводиться фіксація досліджуваного матеріалу протягом 5-10 хвилин холодним (+ 40С) абсолютно чистим ацетоном шляхом нанесення його в кількості 0,15 мл на поверхню лунок. Дослідження проводиться в день забору матеріалу або не пізніше 2-3 днів при необхідності нетривалого їх зберігання. В даному випадку фіксовані препарати можуть зберігатися при +40С не більше зазначеного терміну. Постановка РПІФ проводиться безпосередньо на предметному склі за технологією її виконання.
Для діагностики ЗІПСШ за допомогою ПЛР гістеробіоптат ендометрія в стерильних умовах переносять у поліпропіленову пробірку на 1,5 мл типу “Еppendorf” із 100 мкл фізіологічного розчину, після чого така проба використовуєтьсядля виділення ДНК інфекційних агентів. При необхідності такі проби можна зберігати при температурі – 20°С не більше двох тижнів згідно технології проведення ПЛР. Обробка клінічних проб та ампліфікація ДНК проводиться згідно методики проведення ПЛР. Контрольне обстеження після лікування проводять у реакції прямої імунофлюоресценції та/або ПЛР після забору матеріалу з порожнини матки. Досліджують зскрібки слизової з порожнини матки, отримані за допомогою одноразової щіточкиuterobrash. Забір матеріалу для дослідження проводиться аналогічно методиці, описаній вище при характеристиці бактеріологічного дослідження. Мікробіологічне дослідження біоптатів ендометрія на наявність збудників інфекції є обов’язковим у всіх пацієнток, оскільки відомі випадки безсимптомного хронічного ендометриту та переривання вагітності після ЕКЗ при персистуванні патогенної та умовно-патогенної флори в ендометрії у цих пацієнток. Обстеження на той вид інфекції, яка, перенесена в анамнезі, слід проводити методом ПЛР, як високочутливим методом лабораторної діагностики. Результати дослідження біоптатів дозволяють провести етіопатогенетичну замісну гормональну та протизапальну терапію з урахуванням чутливості до антибіотиків мікроорганізмів, виділених з ендометрія. Гістероскопія в акушерстві Гістероскопія в акушерській практиці використовується з діагностичною і лікувальною метою. На сучасному етапі ендоскопія – обов’язковий елемент алгоритму обстеження і корекції маткової патології, без якого неможливий кінцевий діагноз, нерідко з поєднаною патологією. Впровадження в акушерство гістероскопії відкрило нові можливості для визначення лікувальної тактики у пацієнток з післяпологовим ендометритом. Висока інформативність, низька інвазивність, можливість повторного застосування дозволяють використовувати гістероскопію як об’єктивний метод діагностики післяпологової інволюції і субінволюції матки, стану післяопераційного шва на матці та вмісту її порожнини, виявити клініко-патогенетичні варіанти перебігу післяпологового ендометриту.
Особливу зацікавленість викликає застосування гістероскопії у консервативному лікуванні і веденні пацієнток з шийковою вагітністю для контролю цитостатичної терапії та видалення залишків хоріона. Така тактика дозволяє зберегти репродуктивну функцію у молодих жінок (В.И. Кулаков и соавт.2000). Одним із сучасних підходів до лікування післяпологового ендометриту є розгляд цієї патології з позиції типової раневої інфекції, у лікуванні якої актуальним є застосування активної хірургічної санації порожнини матки. Застосування гістероскопії дозволяє одночасно вирішувати декілька завдань: 1. Визначити клінічний варіант ендометриту, наявність або відсутність паталогічного субстрату, який підтримує запалення; 2. З високим ступенем точності оцінити стадію запального процесу та його розповсюдженість у стінці матки; 3. Отримати біоптат ендометрію для бактеріологічного дослідження; 4. Забезпечити ретельний контроль за виконанням кюретажу порожнини матки і тим самим виключити необхідність повторного втручання; 5. Провести санаційне дренування порожнини матки розчинами антисептиків; 6. Оцінити ефект лікувальних заходів, які проводяться, і своєчасно визначити показання для гістеректомії. Гістероскопія, що використовується в акушерській практиці, дозволяє встановити не тільки причину ендометриту, але й виділити форми патології: істинний (справжній) ендометрит; ендометрит із затримкою частин плаценти, ендометрит з некрозом децидуальної тканини. Для двох останніх форм показано вишкрібання стінок порожнини матки, що дає можливість запобігти генералізації процесу і знизити тривалість захворювання. За даними А.П.Ніконова (1999) застосування гістероскопії у післяпологовому періоді, особливо після кесарського розтину дозволяє виявити неспроможність шва на матці ще до клінічних проявів ускладнення. При порівняльній оцінці різних методів клініко-лабораторної діагностики післяпологового ендометриту встановлено що гістероскопія є найбільш інформативним та ефективним методом, оскільки дає можливість встановити діагноз до маніфестації симптомів ендометриту, забезпечує пряму візуалізацію стінок порожнини матки, прижиттєву мікроскопію тканин, локалізацію патологічних змін ендометрія та травматичних пошкоджень. Ф.А.Смекуна і співавт. (1998) на основі гістероскопічної картини виділяють три клінічні варіанти перебігу ендометрита, що відрізняються за ступенем інтоксикації та місцевими проявами 1) ендометрит – білісуваті нашарування на стінках матки, внаслідок фібринозного запалення; 2) ендометрит з некрозом децидуальної тканини – ендометрій чорного кольору, тяжистий, дещо виступає над поверхнею стінок матки;
3) ендометрит із затримкою залишків плацентарної тканини – різко виділяється горбикувата структура з синюватим відливом. Враховуючи високу інформативність гістероскопії доцільно для раннього виявлення післяопераційного ендометриту на 5-6 добу проводити її з бактеріологічним дослідженням виділень та аналізом їх метаболічного складу. В результаті несвоєчасної діагностики та неадекватної терапії ендометриту після кесарського розтину порушуються репаративні процеси в ділянці шва на матці, що призводить до вторинної його неспроможності та генералізації процесу. Така картина підтверджується специфічними симптомами гістероскопії, яка є не тільки діагностичним методом, а й лікувальним, оскільки дає можливість видалити нежиттєздатні тканини, лігатури та знизити ендогенну інтоксикацію (А.Н. Стрижаков і соавт., 1991). Гістероскопія в післяпологовому періоді може служити надійним методом прогнозування захворювання. Рання гістероскопія на доклінічному етапі діагностики захворювання дозволяє підвищити ефективність лікування та зменшити терміни перебування хворих у стаціонарі. Проте використання гістероскопії в акушерстві не значне і потребує подальшого вивчення та удосконалення. Гістероскопія при гнійно-септичних ускладненнях в післяпологовому періоді дозволяє вирішувати питання радикального оперативного лікування, реєструвати кількісні та якісні зміни в матці, обгрунтовувати патогенетичну терапію та запобігати генералізованих форм інфекції. Виконання гістероскопії в акушерській практиці проводиться за загальноприйнятою методикою: обробка операційного поля, фіксація шийки матки, введення гістероскопа, огляд порожнини матки, оперативне втручання, виведення інструментів. Фізіологічні особливості післяпологової матки дозволяють проводити гістероскопію без розширення цервікального каналу. Оптичне середовище створюється шляхом нагнітання в порожнину матки 0,9% -ного розчину натрію хлориду. З лікувальною метою до розчину натрію хлориду додають 0,2 % - вий розчин мірамістину, метрагіл, гексенал та ін. Знеболення внутрішньовенне, за необхідності ендотрахеальний наркоз. Підготовка пацієнток аналогічна підготовці до малих оперативних маніпуляцій.
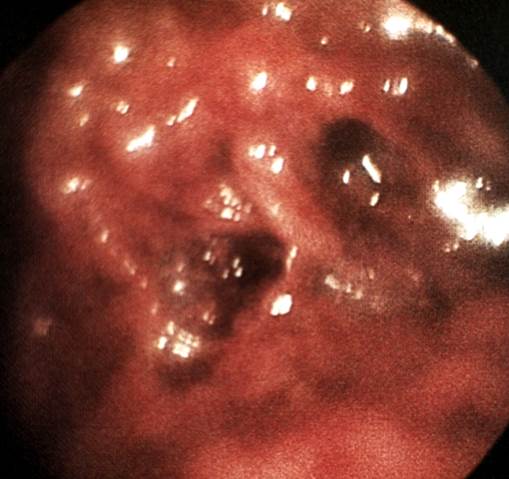
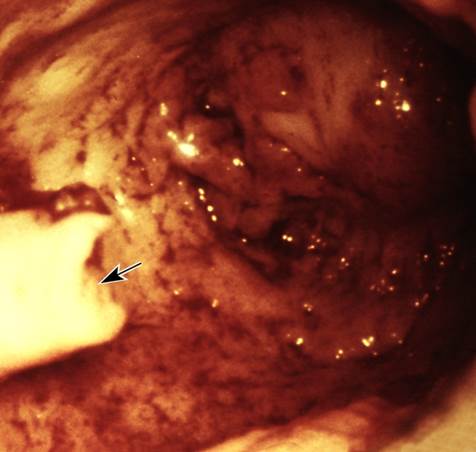
Рис. 4. Гистероскопические картины в норме и при некоторых заболеваниях матки: рак эндометрия, видны участки распадающейся ткани (указаны стрелками), сгустки крови.
Рис. 2. Гистероскопические картины в норме и при некоторых заболеваниях матки: полип эндометрия (указан стрелкой) с удаленной верхней частью.
Рис. 1. Гистероскопические картины в норме и при некоторых заболеваниях матки: норма, в полости матки видно устье маточной трубы (указано стрелкой).
Рис. 3. Гистероскопические картины в норме и при некоторых заболеваниях матки: подслизистая миома матки (указана стрелкой).
Оперативна гістероскопія
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 332; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.29.89 (0.02 с.) |