V группа, главная подгруппа - общая характеристика.
| | Электронная конфигурация внешнего слоя
| Металл-неметалл
| Характерные степени окисления
| Оксиды, тип
| Водородные соединения
|
| N
| ns2np3
| Неметаллы
| -3,+1, +2, +3, +4, +5
| N2O,
NO, N2O3, NO2, N2O5
| NH3
|
| P
| -3,+1, +3,+5
| P2O3, P2O5
| PH3
|
| As
| -3, +3, +5
| As2O3, As2O5
| AsH3
|
| Sb
| Металлы
| +3, +5
| Sb2O3, Sb2O5
| SbH3
|
| Bi
| +3, +5
| Bi2O3
| -
|
Азот
Часть 1. Простое вещество.
:N≡N:
Связь – ковалентная неполярная. В молекуле имеются одна сигма и две пи- связи.

| Степени окисления:
–3, 0, +1, +2, +3, +4, +5.
Электронная формула: 1s22s22p3
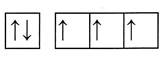 2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
|
| Получение азота:
1) разложение нитрита аммония:
NH4NO2 - t → N2 + 2H2O
2) горение аммиака:
4NH3 + 3O2 = 2N2 + 6H2O
3) В промышленности азот получают из воздуха.
| Нахождение в природе:
Азот является основной частью ВОЗДУХА (79% по объёму).
В земной коре встречается в основном в виде нитратов.
В живых организмах входит в состав аминокислот, белков и нуклеиновых кислот.
|
Химические свойства:
1) из-за тройной связи азот очень малоактивен.
При обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре, электрическая дуга, 20000С (в природе – во время грозы):
N2 0 + O2 ⇄ 2N +2 O - Q
2) Реагирует с металлами: литием при комнатной температуре, кальцием, натрием и магнием при нагревании: N2 + 6Li = 2Li3N – нитр ИД лития. N2 + 3Ca -t→ Ca3N2
3) С водородом – при высоком давлении и в присутствии катализатора: N2 + ЗН2 ⇄ 2NH3 (t,p,kat)
4) Из галогенов непосредственно реагирует только с фтором: N2 + F2 = NF3
5) При высоких температурах реагирует с кремнием, углеродом, бором.
Соединения азота(‑3)
1. Нитриды металлов: - твёрдые, легко гидролизующиеся вещества.
| Получение:
N2 + 6Li = 2Li3N
| Свойства: гидролизуются водой и кислотой.
Ca3N2 + 6H2O =3Са(OH)2 +2NH3 Li3N + 4HCl = 3LiCl + NH4Cl
|
2. Аммиак NH3
Бесцветный газ с резким запахом, бесцветный, легче воздуха. Ядовит.
 Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.
Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.
В молекуле аммиака – ковалентные полярные связи, атом азота находится в состоянии sp3-гибридизации.
Способы собирания газов:
А) Вытеснением воздуха для газов легче воздуха;
Б) Вытеснением воды (для газов, малорастворимых в воде).
В) Вытеснением воздуха для газов тяжелее воздуха.

Аммиак можно собирать только по методу (А), т.к. он легче воздуха и хорошо растворим в воде.
Свойства аммиака:
| 1.В водном растворе аммиак проявляет основные свойства.Он взаимодействует с водой, создавая щелочную среду. Принимая протон от кислот, он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе
|
:NH3 + H2O ⇄ NH4+ + OH- (в растворе);
:NH3 + H+ = NH4+ (в растворе);
:NH3(г) + HCl(г) = NH4Cl(кр) (в газ. фазе).
|
| 2.Реагирует с кислотами, образуя СОЛИ АММОНИЯ:
| NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
2NH3 + H2SO4 = (NH4)2SO4 сульфат аммония.
|
| 3. Реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды:
| FeSO4 + NH3 + H2O = Fe(OH)2 + (NH4)2SO4
|
| 4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы:
| 4NH3 + CuSO4 = [Cu(NH3)4]SO4
2NH3 • H2O + AgCl = [Ag(NH3)2]Cl + 2H2O
4NH3•H2O+Ag2O =2[Ag(NH3)2]OH+3H2O
|
| 5. Аммиак горит на воздухе, образуя азот и воду. Если реакцию проводить в присутствии катализатора (Pt), то образуется NO:
| 4NH3 + 3O2 = 2N2 + 6H2O (горение аммиака),
4NH3 + 5O2 = 4NO + 6H2O
(каталитическое окисление).
|
| 6. Аммиак способен восстанавливать не очень активные металлы из их оксидов:
| 3CuO + 2NH3 = 3Cu + N2 + 3H2O
|
| 7. Аммиак в реакциях является восстановителем
| 2NH3 + 3Вr2 = N2 + 6HBr
2NH3 + 3H2O2 = N2 + 6H2O
|
| 8. Жидкий аммиак способен реагировать с активными металлами.
| 2NH3 + 2Na = 2NaNH2 + H2
Амид натрия
|
Получение аммиака:
В лаборатории:
а) вытеснение щелочами из солей аммония
2NH4Cl+Са(OH)2 - t →CaCl2+ 2NH3+2Н2O
б) гидролиз нитридов: Ca3N2 + 6H2O = ЗСа(OH)2 + 2NH3
2. В промышленности: N2 + 3Н2 (t, p, кат) ⇄ 2NH3
Синтез проводят при температуре 500-5500С и в присутствии катализатора.
Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния.
Для полного использования исходных веществ применяют метод ЦИРКУЛЯЦИИ АЗОТОВОДОРОДНОЙ СМЕСИ: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Схема производства аммиака.

| №
| Аппарат
| Назначение аппарата, процессы, протекающие в нём.
|
|
| трубопровод
| Подаётся предварительно подготовленная смесь, состоящая из 3 объёмов водорода и 1 объёма азота.
|
|
| колонна синтеза
| Колонна синтеза предназначена для проведения процесса синтеза аммиака. В контактном аппарате расположены полки с катализатором. Процесс синтеза является сильно экзотермическим, протекает с большим выделением тепла, часть которого расходуется на нагревание поступающей азотоводородной смеси. Смесь, выходящая из колонны синтеза, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
|
|
| сепаратор
| Предназначен для отделения жидкого аммиака от газообразной фазы. Аммиак собирается в сборник, расположенный в нижней части сепаратора.
|
|
| циркуляционный насос
| Предназначен для возвращения не прореагировавшей смеси в контактный аппарат. Благодаря циркуляции удаётся довести использование азотводородной смеси до 95%.
|
СОЛИ АММОНИЯ
Получение:
1) Аммиак (или гидроксид аммония) + кислота à
NH3 + HNO3 à NH4NO3 (нитрат аммония) 2NH4OH + H2SO4 à (NH4)2SO4(сульфат аммония) + 2Н2O
NH3 + H2SO4 à NH4НSO4(гидросульфат аммония)
2) В обменных реакциях между солями: NH4Cl + AgNO3 à AgCl ↓+ NH4NO3
3) Из кислой соли при добавлении аммиака получается средняя соль: NH4НSO4+ NH3 à (NH4)2SO4
Химические свойства.
| 1. Соли аммония – хорошо растворимы в воде, полностью диссоциируют.
| NH4Cl ⇄ NH4+ + Cl-
|
| 2. Разложение при нагревании.
a) разложение без ОВР, с выделением аммиака: хлорид, карбонат, фосфат, сульфат.
b) окислительно-востановительное разложение: нитрат, нитрит, дихромат.
| а)NH4Cl ⇄NH3 + HCl
NH4HCO3 =NH3 + Н2O + CO2
b) NH4NO3 = N2O + 2Н2O
NH4NO2 = N2 + 2Н2O
(NH4)2Cr2O7 = N2 + Cr2O3 + 4Н2O
|
| 3. Реакции обмена с кислотами, основаниями и другими солями (если выделяется осадок, газ)
| a) (NH4)2CO3 +2НCl =2NH4Cl + Н2O + CO2↑
CO32- + 2H+ = Н2O + CO2
b) (NH4)2SO4+Ba(NO3)2= BaSO4 ↓+2NH4NO3
Ba2+ + SO42- = BaSO4
с) NH4NO3 + KOH à KNO3 + NH3↑ + H2O
NH4+ + OH ¯ à NH3↑ + H2O
|
| 4.Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
| NH4Cl + Н2O ⇄ NH4OH + HCl
NH4+ + Н2O ⇄ NH4OH + H+
|
ОКСИДЫ АЗОТА
| N2O
ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ"
| NO
ОКСИД АЗОТА (II) ОКИСЬ АЗОТА
| N2O3
ОКСИД АЗОТА (III), АЗОТИСТЫЙ АНГИДРИД
| NO2
ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ»
| N2O5
ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД
|
| Бесцветный газ
| Бесцветный газ
| темно-синяя жидкость (при низких температурах).
| бурый газ
| крист. вещество, легко плавится (ок.40 °)
|
| несолеобра-зующий
| несолеобра-зующий
| кислотный
| кислотный* (даёт 2 кислоты)
| кислотный
|
N2O – Несолеобразующий оксид.
| Получение:
NH4NO3 =N2O + 2Н2O
| Химические свойства:
1. Разлагается при 700°C с выделением кислорода: 2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C à N2 + CO
с фосфором: 5N2O + 2Р à 5N2 + Р2O5
|
NO - Несолеобразующий оксид
| Получение:
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 = 4NO + 6H2O
2. 3Cu+HNO3(разб.)=3Cu(NO3)2 +2NO +4H2O
3. N2 + O2 =2NO (в природе, во время грозы, 2000 градусов)
| Химические свойства:
1. Легко окисляется кислородом и галогенами 2NO + O2 = 2NO2
2NO + Cl2 = 2NOCl (хлористый нитрозил)
2.Может быть окислителем, переходя в простое вещество азот: в нём могут гореть водород, углерод и т.п. 2NO + 2H2 =N2 + 2H2O 2NO + 2SO2 =2SO3 + N2
|
N2O3 - азотистый ангидрид – кислотный оксид.
| Получение:
NO2 + NO ⇄ N2O3
(при охлаждении)
| Химические свойства:
1) Неустойчив, разлагается на NO и NO2
2) N2O3 + 2NaOH =2NaNO2+ H2O (нитрит натрия)
3) N2O3 + H2O =2НNO2 (азотистая кислота)
4) N2O3 + К2O =2КNO2 (нитрит калия)
|
NO2 -бурый газ, ядовит.
Химические свойства
| 1. Кислотный оксид, образует две кислоты сразу:
| А) с водой: 2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
Б) со щелочами: 2NO2 +2NaOH =NaNO2+NaNO3 +H2O
|
| 2. Окислитель:
| NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
|
| 3. Димеризация:
| 2NO2(бурый газ)⇄ N2O4(бесцветная жидкость) – димер.
|
Получение: 1. 2NO + O2 = 2NO2
2. Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3. Разложение нитратов: Cu(NO3)2 –tà CuO + 2NO2 + O2
N2O5 - азотный ангидрид
| Получение:
1. Окисление диоксида азота: 2NO2 + O3 = N2O5 + O2
2. Обезвоживание азотной кислоты:
2HNO3 +P2O5 = 2HPO3 + N2O5
| Химические свойства:
1. Кислотный оксид:
a) С водой: N2O5 + H2O = 2HNO3
b) С основаниями: N2O5 + 2КОН = 2KNO3 + H2O
c) С оксидами металлов: N2O5 + CaO = Ca(NO3)2
2. Сильный окислитель: 2N2O5 + S = SO2 +4NO2
3. Легко разлагается (при нагревании – со взрывом): 2N2O5 = 4NO2 + O2
|
КИСЛОТЫ АЗОТА.
Азотистая Кислота HNO2
Получение: Вытеснение из нитритов сильной кислотой: AgNO2 + HCl = HNO2 + AgCl↓
Химические свойства:
1. Слабая неустойчивая кислота: HNO2 + NaOH = NaNO2 + H2O
2. Разлагается: при нагревании: 3HNO2 = HNO3 + 2NO + H2O
без нагревания: 2HNO2 = NO2 + NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями) 2НNO2+2KI+2H2SO4=K2SO4+I2 + 2NO + 2H2O
4. Сильный восстановитель: HNO2 + Cl2 + H2O = HNO3 + 2HCl
HNO2 + Н2O2 = HNO3 + H2O
Нитриты: Нитриты устойчивы к нагреванию, кроме нитрита аммония.
- Получение: 2КОН + NO2 + NO à 2KNO2 + H2O
- Свойства. Могут быть и окислителями, и восстановителями:
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 + 2NO + 2H2O
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + Na2SO4 + 2MnSO4 + 3H2O
2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O
АЗОТНАЯ КИСЛОТА HNO3
РАЗЛОЖЕНИЕ НИТРАТОВ
| 1. Щелочные металлы, кроме лития.
| KNO3 –tà КNO2 + O2
нитрит металла + кислород
|
| 2. От магния до меди + литий + щелочноземельные
| Mg(NO3) 2–tà MgO + NO2 + O2
оксид металла + NO2 + O2
|
| 3. После меди
| AgNO3 –tàAg + NO2 + O2
металл + NO2 + O2
|
| 4. Нитрат аммония и нитрит аммония
| NH4NO3 –tà N2O + 2H2O
NH4NO2 –tà N2 + 2H2O
|
Особые случаи:
Fe(NO3) 2 –tà Fe2O3 + NO2 + O2 - образуется оксид железа (III)
Mn(NO3)2 –tà MnO2 + NO2 - образуется оксид марганца (IV)
ФОСФОР
Электронная конфигурация Р 1s22s22p63s23p3
S 2s 2p 3s 3p 3d

образование возбужденного состояния.
Возможные валентности: - в невозбужденном состоянии: III
- в возбужденном состоянии: V
Нахождение в природе
Встречается только в виде соединений. В основном это фосфаты (например, Ca3(PO4)2) и апатиты 3Ca3(PO4)2·СаF2
ПОЛУЧЕНИЕ: Белый фосфор получают восстановлением фосфата кальция (сплавление в электрической печи с углём и песком):
Ca3(PO4)2+3SiO2+5C –tà3CaSiO3+5CO + 2P. Красный и черный фосфор получают из белого.
Фосфиды металлов.
| Получение:
2P + 3Mg = Mg3P2
| Свойства:Разлагаются водой и кислотами:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3 Mg3P2 + 6H2O =3Mg(OH)2 + 2PH3
|
 ФОСФИН PH3 – газ, с неприятным запахом, бесцветный, мало растворим в воде, нестоек, ядовит. Водородные связи между молекулами фосфина не образуются.
ФОСФИН PH3 – газ, с неприятным запахом, бесцветный, мало растворим в воде, нестоек, ядовит. Водородные связи между молекулами фосфина не образуются.
| Получение: из фосфидов:
Ca3P2 + 6HCl=3CaCl2 + 2PH3
Ca3P2+6H2O=Ca(OH)2+2PH3
| Свойства:
1) Разлагается при нагревании: 2PH3 = 2P + 3H2
2) Проявляет очень слабые основные свойства:
PH3 + HI = [PH4]+I- йодид фосфония
– менее устойчив, чем соли аммония.
3) Сильный восстановитель. На воздухе самовоспламеняется: 2РН3 + 4О2 = Р2О5 + 3Н2О или РН3 + 2О2 = H3PO4
|
P2O3 (P4O6)- Фосфористый ангидрид (оксид фосфора (III)).
Белые кристаллы, в парах состоит из молекул P4O6. Кислотный оксид.
| Получение.
Окисление фосфора при недостатке кислорода:
4P + 3O2 = 2P2O3
| Химические свойства.
1. Кислотный оксид ДВУХОСНОВНОЙ фосфористой кислоты:
P2O3 + 3H2O = 2H3PO3
P2O3+ 4NaOH = 2Na2HPO3+ H2O
2. Сильный восстановитель: O2+P2O3=P2O5
|
H3PO3 Фосфористая кислота
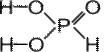 Бесцветное кристаллическое вещество, хорошо растворимое в воде.
Бесцветное кристаллическое вещество, хорошо растворимое в воде.
Получение: гидролиз хлорида фосфора (III) или реакция оксида фосфора (III) с водой. PCl3+ 3H2O =H3PO3+ 3HCl
и P2O3 + 3H2O = 2H3PO3
Химические свойства.
1) Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты): H3PO3+ 2NaOH = Na2HPO3+ 2H2O
2) При нагревании происходит превращение в ортофосфорную кислоту и фосфин: 4H3PO3 = 3H3PO4+ PH3
3) Восстановительные свойства: H3P +3 O3+ HgCl2+ H2O = H3 +5 PO4+ Hg + 2HCl
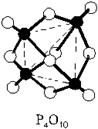
P2O5 (P4O10) Фосфорный ангидрид (оксид фосфора (V)).
Белые кристаллы. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение: 4P + 5O2 = 2P2O5
Реакция с водой
P2O5 + H2O = 2HPO3 (мета фосфорная кислота) – в холодной воде
P2O5 +3H2O = 2H3PO4 (орто фосфорная кислота) – при нагревании
2) Реакция с оксидами металлов P2O5 + 3BaO = Ba3(PO4)2
3) реакция с основаниями P2O5 + 6KOH = 2K3PO4+ 3H2O
4) P2O5 - сильное водоотнимающее средство, можно использовать для получения ангидридов сильных кислот: P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
H3PO4 Ортофосфорная кислота.
 Белое твердое вещество, гигроскопичное, хорошо растворимое в воде.
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде.
Кислота трехосновная, прочная, нелетучая.
Получение: 1) P2O5+ 3H2O = 2H3PO4
2) 3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
3) Промышленный способ: обработка фосфорита концентрированной серной кислотой: Ca3(PO4)2(твердый) + 3H2SO4(конц.) = 2H3PO4+ 3CaSO4
ХИМИЧЕСКИЕ СВОЙСТВА:
V группа, главная подгруппа - общая характеристика.
| | Электронная конфигурация внешнего слоя
| Металл-неметалл
| Характерные степени окисления
| Оксиды, тип
| Водородные соединения
|
| N
| ns2np3
| Неметаллы
| -3,+1, +2, +3, +4, +5
| N2O,
NO, N2O3, NO2, N2O5
| NH3
|
| P
| -3,+1, +3,+5
| P2O3, P2O5
| PH3
|
| As
| -3, +3, +5
| As2O3, As2O5
| AsH3
|
| Sb
| Металлы
| +3, +5
| Sb2O3, Sb2O5
| SbH3
|
| Bi
| +3, +5
| Bi2O3
| -
|
Азот
Часть 1. Простое вещество.
:N≡N:
Связь – ковалентная неполярная. В молекуле имеются одна сигма и две пи- связи.

| Степени окисления:
–3, 0, +1, +2, +3, +4, +5.
Электронная формула: 1s22s22p3
 2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
|
| Получение азота:
1) разложение нитрита аммония:
NH4NO2 - t → N2 + 2H2O
2) горение аммиака:
4NH3 + 3O2 = 2N2 + 6H2O
3) В промышленности азот получают из воздуха.
| Нахождение в природе:
Азот является основной частью ВОЗДУХА (79% по объёму).
В земной коре встречается в основном в виде нитратов.
В живых организмах входит в состав аминокислот, белков и нуклеиновых кислот.
|
Химические свойства:
1) из-за тройной связи азот очень малоактивен.
При обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре, электрическая дуга, 20000С (в природе – во время грозы):
N2 0 + O2 ⇄ 2N +2 O - Q
2) Реагирует с металлами: литием при комнатной температуре, кальцием, натрием и магнием при нагревании: N2 + 6Li = 2Li3N – нитр ИД лития. N2 + 3Ca -t→ Ca3N2
3) С водородом – при высоком давлении и в присутствии катализатора: N2 + ЗН2 ⇄ 2NH3 (t,p,kat)
4) Из галогенов непосредственно реагирует только с фтором: N2 + F2 = NF3
5) При высоких температурах реагирует с кремнием, углеродом, бором.
Соединения азота(‑3)
1. Нитриды металлов: - твёрдые, легко гидролизующиеся вещества.
| Получение:
N2 + 6Li = 2Li3N
| Свойства: гидролизуются водой и кислотой.
Ca3N2 + 6H2O =3Са(OH)2 +2NH3 Li3N + 4HCl = 3LiCl + NH4Cl
|
2. Аммиак NH3
Бесцветный газ с резким запахом, бесцветный, легче воздуха. Ядовит.
 Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.
Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.
В молекуле аммиака – ковалентные полярные связи, атом азота находится в состоянии sp3-гибридизации.
Способы собирания газов:
А) Вытеснением воздуха для газов легче воздуха;
Б) Вытеснением воды (для газов, малорастворимых в воде).
В) Вытеснением воздуха для газов тяжелее воздуха.

Аммиак можно собирать только по методу (А), т.к. он легче воздуха и хорошо растворим в воде.
Свойства аммиака:
| 1.В водном растворе аммиак проявляет основные свойства.Он взаимодействует с водой, создавая щелочную среду. Принимая протон от кислот, он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе
|
:NH3 + H2O ⇄ NH4+ + OH- (в растворе);
:NH3 + H+ = NH4+ (в растворе);
:NH3(г) + HCl(г) = NH4Cl(кр) (в газ. фазе).
|
| 2.Реагирует с кислотами, образуя СОЛИ АММОНИЯ:
| NH3 + H2SO4 = NH4HSO4 гидросульфат аммония
2NH3 + H2SO4 = (NH4)2SO4 сульфат аммония.
|
| 3. Реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды:
| FeSO4 + NH3 + H2O = Fe(OH)2 + (NH4)2SO4
|
| 4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы:
| 4NH3 + CuSO4 = [Cu(NH3)4]SO4
2NH3 • H2O + AgCl = [Ag(NH3)2]Cl + 2H2O
4NH3•H2O+Ag2O =2[Ag(NH3)2]OH+3H2O
|
| 5. Аммиак горит на воздухе, образуя азот и воду. Если реакцию проводить в присутствии катализатора (Pt), то образуется NO:
| 4NH3 + 3O2 = 2N2 + 6H2O (горение аммиака),
4NH3 + 5O2 = 4NO + 6H2O
(каталитическое окисление).
|
| 6. Аммиак способен восстанавливать не очень активные металлы из их оксидов:
| 3CuO + 2NH3 = 3Cu + N2 + 3H2O
|
| 7. Аммиак в реакциях является восстановителем
| 2NH3 + 3Вr2 = N2 + 6HBr
2NH3 + 3H2O2 = N2 + 6H2O
|
| 8. Жидкий аммиак способен реагировать с активными металлами.
| 2NH3 + 2Na = 2NaNH2 + H2
Амид натрия
|
Получение аммиака:
В лаборатории:
а) вытеснение щелочами из солей аммония
2NH4Cl+Са(OH)2 - t →CaCl2+ 2NH3+2Н2O
б) гидролиз нитридов: Ca3N2 + 6H2O = ЗСа(OH)2 + 2NH3
2. В промышленности: N2 + 3Н2 (t, p, кат) ⇄ 2NH3
Синтез проводят при температуре 500-5500С и в присутствии катализатора.
Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния.
Для полного использования исходных веществ применяют метод ЦИРКУЛЯЦИИ АЗОТОВОДОРОДНОЙ СМЕСИ: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Схема производства аммиака.

| №
| Аппарат
| Назначение аппарата, процессы, протекающие в нём.
|
|
| трубопровод
| Подаётся предварительно подготовленная смесь, состоящая из 3 объёмов водорода и 1 объёма азота.
|
|
| колонна синтеза
| Колонна синтеза предназначена для проведения процесса синтеза аммиака. В контактном аппарате расположены полки с катализатором. Процесс синтеза является сильно экзотермическим, протекает с большим выделением тепла, часть которого расходуется на нагревание поступающей азотоводородной смеси. Смесь, выходящая из колонны синтеза, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
|
|
| сепаратор
| Предназначен для отделения жидкого аммиака от газообразной фазы. Аммиак собирается в сборник, расположенный в нижней части сепаратора.
|
|
| циркуляционный насос
| Предназначен для возвращения не прореагировавшей смеси в контактный аппарат. Благодаря циркуляции удаётся довести использование азотводородной смеси до 95%.
|
СОЛИ АММОНИЯ
Получение:
1) Аммиак (или гидроксид аммония) + кислота à
NH3 + HNO3 à NH4NO3 (нитрат аммония) 2NH4OH + H2SO4 à (NH4)2SO4(сульфат аммония) + 2Н2O
NH3 + H2SO4 à NH4НSO4(гидросульфат аммония)
2) В обменных реакциях между солями: NH4Cl + AgNO3 à AgCl ↓+ NH4NO3
3) Из кислой соли при добавлении аммиака получается средняя соль: NH4НSO4+ NH3 à (NH4)2SO4
Химические свойства.
| 1. Соли аммония – хорошо растворимы в воде, полностью диссоциируют.
| NH4Cl ⇄ NH4+ + Cl-
|
| 2. Разложение при нагревании.
a) разложение без ОВР, с выделением аммиака: хлорид, карбонат, фосфат, сульфат.
b) окислительно-востановительное разложение: нитрат, нитрит, дихромат.
| а)NH4Cl ⇄NH3 + HCl
NH4HCO3 =NH3 + Н2O + CO2
b) NH4NO3 = N2O + 2Н2O
NH4NO2 = N2 + 2Н2O
(NH4)2Cr2O7 = N2 + Cr2O3 + 4Н2O
|
| 3. Реакции обмена с кислотами, основаниями и другими солями (если выделяется осадок, газ)
| a) (NH4)2CO3 +2НCl =2NH4Cl + Н2O + CO2↑
CO32- + 2H+ = Н2O + CO2
b) (NH4)2SO4+Ba(NO3)2= BaSO4 ↓+2NH4NO3
Ba2+ + SO42- = BaSO4
с) NH4NO3 + KOH à KNO3 + NH3↑ + H2O
NH4+ + OH ¯ à NH3↑ + H2O
|
| 4.Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
| NH4Cl + Н2O ⇄ NH4OH + HCl
NH4+ + Н2O ⇄ NH4OH + H+
|
ОКСИДЫ АЗОТА
| N2O
ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ"
| NO
ОКСИД АЗОТА (II) ОКИСЬ АЗОТА
| N2O3
ОКСИД АЗОТА (III), АЗОТИСТЫЙ АНГИДРИД
| NO2
ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ»
| N2O5
ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД
|
| Бесцветный газ
| Бесцветный газ
| темно-синяя жидкость (при низких температурах).
| бурый газ
| крист. вещество, легко плавится (ок.40 °)
|
| несолеобра-зующий
| несолеобра-зующий
| кислотный
| кислотный* (даёт 2 кислоты)
| кислотный
|
N2O – Несолеобразующий оксид.
| Получение:
NH4NO3 =N2O + 2Н2O
| Химические свойства:
1. Разлагается при 700°C с выделением кислорода: 2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C à N2 + CO
с фосфором: 5N2O + 2Р à 5N2 + Р2O5
|
NO - Несолеобразующий оксид
| Получение:
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 = 4NO + 6H2O
2. 3Cu+HNO3(разб.)=3Cu(NO3)2 +2NO +4H2O
3. N2 + O2 =2NO (в природе, во время грозы, 2000 градусов)
| Химические свойства:
1. Легко окисляется кислородом и галогенами 2NO + O2 = 2NO2
2NO + Cl2 = 2NOCl (хлористый нитрозил)
2.Может быть окислителем, переходя в простое вещество азот: в нём могут гореть водород, углерод и т.п. 2NO + 2H2 =N2 + 2H2O 2NO + 2SO2 =2SO3 + N2
|
N2O3 - азотистый ангидрид – кислотный оксид.
| Получение:
NO2 + NO ⇄ N2O3
(при охлаждении)
| Химические свойства:
1) Неустойчив, разлагается на NO и NO2
2) N2O3 + 2NaOH =2NaNO2+ H2O (нитрит натрия)
3) N2O3 + H2O =2НNO2 (азотистая кислота)
4) N2O3 + К2O =2КNO2 (нитрит калия)
|
NO2 -бурый газ, ядовит.
Химические свойства
| 1. Кислотный оксид, образует две кислоты сразу:
| А) с водой: 2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
Б) со щелочами: 2NO2 +2NaOH =NaNO2+NaNO3 +H2O
|
| 2. Окислитель:
| NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
|
| 3. Димеризация:
| 2NO2(бурый газ)⇄ N2O4(бесцветная жидкость) – димер.
|
Получение: 1. 2NO + O2 = 2NO2
2. Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3. Разложение нитратов: Cu(NO3)2 –tà CuO + 2NO2 + O2
N2O5 - азотный ангидрид
| Получение:
1. Окисление диоксида азота: 2NO2 + O3 = N2O5 + O2
2. Обезвоживание азотной кислоты:
2HNO3 +P2O5 = 2HPO3 + N2O5
| Химические свойства:
1. Кислотный оксид:
a) С водой: N2O5 + H2O = 2HNO3
b) С основаниями: N2O5 + 2КОН = 2KNO3 + H2O
c) С оксидами металлов: N2O5 + CaO = Ca(NO3)2
2. Сильный окислитель: 2N2O5 + S = SO2 +4NO2
3. Легко разлагается (при нагревании – со взрывом): 2N2O5 = 4NO2 + O2
|
КИСЛОТЫ АЗОТА.
Азотистая Кислота HNO2
Получение: Вытеснение из нитритов сильной кислотой: AgNO2 + HCl = HNO2 + AgCl↓
Химические свойства:
1. Слабая неустойчивая кислота: HNO2 + NaOH = NaNO2 + H2O
2. Разлагается: при нагревании: 3HNO2 = HNO3 + 2NO + H2O
без нагревания: 2HNO2 = NO2 + NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями) 2НNO2+2KI+2H2SO4=K2SO4+I2 + 2NO + 2H2O
4. Сильный восстановитель: HNO2 + Cl2 + H2O = HNO3 + 2HCl
HNO2 + Н2O2 = HNO3 + H2O
Нитриты: Нитриты устойчивы к нагреванию, кроме нитрита аммония.
- Получение: 2КОН + NO2 + NO à 2KNO2 + H2O
- Свойства. Могут быть и окислителями, и восстановителями:
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 + 2NO + 2H2O
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + Na2SO4 + 2MnSO4 + 3H2O
2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O
АЗОТНАЯ КИСЛОТА HNO3



 2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
2s 2p
Физические свойства:
Азот – газ без цвета и запаха, плохо растворим в воде.
 Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.
Аммиак очень хорошо растворим в воде, что объясняется образованием каждой молекулой аммиака четырех водородных связей с молекулами воды.


 ФОСФИН PH3 – газ, с неприятным запахом, бесцветный, мало растворим в воде, нестоек, ядовит. Водородные связи между молекулами фосфина не образуются.
ФОСФИН PH3 – газ, с неприятным запахом, бесцветный, мало растворим в воде, нестоек, ядовит. Водородные связи между молекулами фосфина не образуются.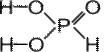 Бесцветное кристаллическое вещество, хорошо растворимое в воде.
Бесцветное кристаллическое вещество, хорошо растворимое в воде.
 Белое твердое вещество, гигроскопичное, хорошо растворимое в воде.
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде.


