
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спеціальність 5.091711 «Технологія харчування»Стр 1 из 5Следующая ⇒
Викладач Таран В.І. Предмет: Аналітична хімія. Спеціальність 5.091711 «Технологія харчування» · Тематичний план. (I частина) · Пояснювальна записка. · Cписок літератури. · Назви лабораторних і практичних робіт. · Тематичний план (II частина). · Методи об’ємного аналізу. · Консультація на тему: «Об’ємний аналіз”. · Запитання для самоконтролю. · Тести. · Фронтальний опит. · Використана література. Тематичний план з предмету “Аналітична хімія” з спеціальності 5.091711 “Технологія харчування” денного відділення (1 частина)
Пояснювальна записка
Програмою предмету передбачено визначення кількісного аналізу хімічних сполук. Мета курсу – вивчення основних методів дослідження хімічного складу речовин, надбання вмінь та навичок проведення аналізів та виявлення змін в технологічних процесах обробки продуктів. Програма курсу “Аналітична хімія” складена відповідно з учбовими планами для спеціальності 5. 091711 “Технологія харчування”. Матеріал курсу слід пов’язати з дисциплінами “Товарознавство харчових продуктів”, “Фізична та коллоїдна хімія”, “Технологія приготування їжі” та іншими. Викладачі учбовий матеріал необхідно користуватись інформацією про нові досягнення науки, одноразово викладаючи застарівший матеріал. В процесі вивчення курсу необхідно сприяти формуванню у студентів інтересу до професії, свідомого відношення до своїх функцій майбутнього спеціаліста, елементарної грамотності в питаннях екології, інтересу до науково – технічного прогресу, вдосконалювати матеріалістичні погляди на хімічну природу речовин.
Методика вивчення предмету базується на основі об’єднання теоретичного навчання з проведенням лабораторно – практичних робіт. Особливу увагу слід приділяти самостійній роботі студентів, яка повинна проводитися як поза аудиторією, так і на учбових заняттях. Це самостійна робота з учбовою та відповідною літературою, підготовка до семінарських занять та лабораторно-практичних робіт, підготовка рефератів. В процесі роботи слід використовувати таблиці, плакати, а особливо, демонструвати студентам досліди. Тематика та методика проведення лабораторно – практичних робіт обумовлена завданням формування у студентів навиків експериментальної роботи, розвиток здібностей до творчого мислення, установлення зв’язків між будовою речовини та змінами, які відбуваються з ними при технологічній обробці. Внаслідок вивчення предмету молодий спеціаліст Повинен знати: Кількісний аналіз: 1. Гравіметричний метод, (ваговий); 2. Тетриметричний (об’ємний метод аналізу) Класифікація, його методи, вимірювальний посуд, способи вираження концентрації розчинів. а) метод нейтралізації; б) метод окислення – відновлення; в) метод осадження; г) комплексонометричний метод; д) колометричний метод; е) методи контролю санітарно – харчових лабораторій сировини та різних напівфабрикатів.
Повинен вміти: 1. Написати рівняння реакції в іонному виді: за допомогою групового реактиву, або систематичним аналізом. 2. Визначити концепцію та масу даної речовини в розчинах. 3. Аналізувати кількість даної речовини. 4. Скласти акт виїмки проб на визначення доброякості та стандартності сировини і н/ф. 5. Оформляти бракеражний журнал оцінки якості сировини та н/ф.
Список літератури:
1. Конституція України.
2. Закон України про освіту.
3. Ю.Н. Жванко, Г.В. Панкратова, З.У. Мамедова. “Аналітична хімія та технологічний контроль в громадському харчуванні”. –Москва: “Вища школа”, 1989 г.
4. С.А. Шапіро, М.А. Шапіро. “Аналітична хімія”. – Москва: “Вища школа”, 1979 р.
Лабораторна робота №1 «Визначення кристалізаційної води в СuSO4 х 5H2O» Лабораторна робота №2 «Визначення кількості барію в BaCℓ2 х 2H2O.»
Лабораторна робота №4 «Визначення кількості сірчаної кислоти за стандартним розчином NaOH» Лабораторна робота №5 «Приготування стандартного розчину КМnО4 Та визначення його нормальності та титру за щавелевою кислотою» Лабораторна робота №6. «Визначення кількості заліза в солі Мора». Практична робота №1 «Розрахунки в об’ємному аналізі. Розв’язування задач». Практична робота №2 «Складання рівнянь окисно-відновних реакцій.» Програмою предмету передбачено визначення кількісного аналізу хімічних сполук. Мета курсу – вивчення основних методів дослідження хімічного складу речовин, надбання вмінь та навичок проведення аналізів та виявлення змін в технологічних процесах обробки продуктів. Програма курсу “Аналітична хімія” складена відповідно з учбовими планами для спеціальності 5. 091711 “Технологія харчування”. Матеріал курсу слід пов’язати з дисциплінами “Товарознавство харчових продуктів”, “Фізична та коллоїдна хімія”, “Технологія приготування їжі” та іншими. Викладачі учбовий матеріал необхідно користуватись інформацією про нові досягнення науки, одноразово викладаючи застарівший матеріал. В процесі вивчення курсу необхідно сприяти формуванню у студентів інтересу до професії, свідомого відношення до своїх функцій майбутнього спеціаліста, елементарної грамотності в питаннях екології, інтересу до науково – технічного прогресу, вдосконалювати матеріалістичні погляди на хімічну природу речовин. Методика вивчення предмету базується на основі об’єднання теоретичного навчання з проведенням лабораторно – практичних робіт. Особливу увагу слід приділяти самостійній роботі студентів, яка повинна проводитися як поза аудиторією, так і на учбових заняттях. Це самостійна робота з учбовою та відповідною літературою, підготовка до семінарських занять та лабораторно-практичних робіт, підготовка рефератів. В процесі роботи слід використовувати таблиці, плакати, а особливо, демонструвати студентам досліди. Тематика та методика проведення лабораторно – практичних робіт обумовлена завданням формування у студентів навиків експериментальної роботи, розвиток здібностей до творчого мислення, установлення зв’язків між будовою речовини та змінами, які відбуваються з ними при технологічній обробці. Внаслідок вивчення предмету молодий спеціаліст Повинен знати: Кількісний аналіз: 3. Гравіметричний метод, (ваговий); 4. Тетриметричний (об’ємний метод аналізу) Класифікація, його методи, вимірювальний посуд, способи вираження концентрації розчинів. а) метод нейтралізації; б) метод окислення – відновлення; в) метод осадження; г) комплексонометричний метод; д) колометричний метод; е) методи контролю санітарно – харчових лабораторій сировини та різних напівфабрикатів.
Повинен вміти: 6. Написати рівняння реакції в іонному виді: за допомогою групового реактиву, або систематичним аналізом. 7. Визначити концепцію та масу даної речовини в розчинах. 8. Аналізувати кількість даної речовини. 9. Скласти акт виїмки проб на визначення доброякості та стандартності сировини і н/ф. 10. Оформляти бракеражний журнал оцінки якості сировини та н/ф.
План занять з “Аналітичної хімії” (II частина) Всього 55 годин
Метод окислення – відновлення, який в свою чергу підрозділяється на метод перманганатометрії та йодометрії; 3. Метод осадження; 4. Метод комплексонометрії.
Метод нейтралізації.
В основі методу лежить реакція взаємодії між іонами Н+ (що зумовлюють кисле середовище) та ОН- (що зумовлюють лужне середовище). Метод застосовується для визначення кислот, основ та солей, (які взаємодіють з основами або кислотами, такі як Na2CO3, NH4Cℓ, Na2B2О7 та інші.). Для визначення кислот використовують титровані розчини лугів – NaOH або КОН, для визначення основ – розчини кислот - НСℓ; H2SO4; H2C2O4; Любе об’ємно-аналітичне визначення складається з слідуючих операцій: 1. Приготування стандартного розчину; 2. Вибір індикатора; 3. Встановлення титру та нормальності стандартного розчину; 4. Титрування досліджуваного розчину стандартним розчином; 5. Розрахунки результатів аналізу. В методі нейтралізації в якості індикаторів використовують: 1. Фенолфталеїн; 2. Метиловий оранжевий; Таблиця 1.
Методи оксидиметрії. а). перманганатометрія – це метод об'ємного аналізу, в якому в якості стандартного розчину використовують розчин КМnО4. Перманганат калію являється сильним окислювачем, особливо в кислому середовищі і здатен окислювати багато речовин. Для того, щоб зрозуміти чому це так, необхідно згадати будову атому мангану та пояснити, що з ним відбувається, коли він знаходиться в складі КМnО4 в різних середовищах розчинів. Найкраще це йому вдається в кислому середовищі, він збирає найбільшу кількість електронів аж 5. Mnº +25)))) 1S22S22P63S23P64S23d5
В період хімічного збудження відбувається розпарювання 4S2 електронів, так як є вільні орбіталі Р, d, ƒ, таким чином манган має 7 неспарених електронів на 3 –ому та 4-ому рівнях, які він легко може віддати іншим елементам, відновлюючи їх, а сам окислюється до останньої межі:
+7 Наприклад в сполуці КМnО4 де манган має окислювальне число +7. Схаменувшись, що віддав всі свої неспарені електрони, манган стає сильним агресором, тобто окислювачем і намагається повернути їх собі. Наприклад: -2 +7 +2 5Н2S + 2KMnO4 + 3H2SO4→5Sº+2MnSO4+K2SO4+8H2O;
Mn + 5е- = Mn+2 2 окислювач S-2 – 2e- = S0 10 5 відновник
В нейтральному середовищі манган приєднує 3 електрони. +7 +4 +4 +6
Mn+7 + 3 е- = Mn+4 2 окислювач S+4 – 2e- = S+6 6 3 відновник
В лужному середовищі манган приєднує лише 1 електрон. +4 +7 +6 +6 Na2SO3+2KMnO4+2KOH→Na2SO4 + 2К2MnO4 + Н2О;
Це дуже важливо знати, тому що є такі задачі, в яких еквівалент KMnO4 треба визначити залежно від середовища, в якому відбувається реакція.
Наприклад:
Задача. ТKMnO4= 0,002980. Знайти нормальну концентрацію розчину для реакцій, в яких перманганат калію перетворюється: а). в МnO2; б).MnSO4;
Дано:
Знайти Сn KMnO4 в реакціях: а) перетворюється на МnO2; б).перетворюється на МnSO4; +7 +3е +4 а). KMnO4 → MnO2 +7 процес відновлення, але Mn являється окислювачем. Знаходимо молярну масу KMnO4. М (KMnO4) = 158 г. Еквівалент окислювача дорівнює молярній масі поділеній на кількість прийнятих електронів.
Екв. KMnO4 =
Метод йодометрії.
Йодометрія – один з методів оксидиметрії, в основі якого лежать реакції: I02 + 2е- = 2I-; 2I-I – 2е- = I02; Цим методом визначають окислювачі та відновники. При цьому використовують два стандартних розчини – для визначення відновників – розчин йоду (окислювач), для визначення окислювачів – розчин тіосульфату натрію Na2S2O3 – (відновник). Окислювачі визначають методом заміщення, суть якого в тому, що до досліджуваного розчину додають надлишок розчину КІ в кислому середовищі. Окислювач виділяє з КІ еквівалентну кількість йоду, який відтитровують розчином Na2S2O3. В якості прикладу розберемо реакцію з К2Сч2О7 (окислювач). К2Сч2О7 + 6КІ + 7Н2SO4 = 3І02 + Сч2(SO4)3 +K2SO4 + 7H2O;
2І- - 2е- = І02 3 відновник
І2 + 2Na2S2O3 = 2NaI + Na2S4O6 Тетратіонат натрію I02 + 2e- = 2I- 2S2O2-3 – 2e- = S4O3-6 тетратіонат натрію
Дихромат калію виділяє еквівалентну кількість йоду. За об’ємом розчину тіосульфату натрію, який пішов на титрування йоду, можна розрахувати нормальну концентрацію розчину К2Сч2О7, а потім його титр та масу в грамах. Вміст відновників в розчинах знаходять прямим титруванням стандартним розчином І2. Йодомитричний метод широко використовують в харчових лабораторіях для дослідження жирів на вміст ненасичених жирних кислот.
Метод осадження.
В основі методу осадження лежать реакції, що відбуваються з випадінням осаду, до якого пред’являються певні вимоги: 1. Осад повинен бути практично нерозчинним; 2. Взаємодія між стандартним розчином та досліджуваним повинна відбуватися відповідно рівнянню реакції; 3. Випадіння осаду повинно відбуватися швидко. 4. Повинна чітко визначатися точка еквівалентності.
Найчастіше методом осадження визначають вміст іонів І-, Вч-; Сℓ; в вигляді срібних солей: АgI; AgBr; AgCℓ. Метод застосовують для визначення вмісту кухонної солі в окремих продуктах харчування, напівфабрикатів або росолах. Для визначення іонів І-, Вч-; Сℓ; в якості стандартного розчину використовують розчин AgNO3, тому метод називають аргентометричним. Але найчастіше використовується спосіб Мора, який нескладний в використані та має достатню точність визначення. В нашій практиці використовується для визначення кількості хлориду натрію в I та II стравах, рублених м’ясних н/ф, солоній рибі до та після вимочування.
Спосіб Мора. В якості стандартного розчину використовується 0,05 н розчин АgNO3 титр та нормальність якого встановлюють за розчином NaCℓ, індикатором являється 5% - ний розчин К2СчО4. Визначення хлориду натрію відбувається за хімізмом.
NaCℓ+AgNO3 = NaNO3 +AgCℓ↓ Білий К2СчО4 + 2AgNO3 = 2KNO3 + Ag2CrO4 ↓ Червоно-бурий.
Титрування за методом Мора необхідно проводити в нейтральному середовищі, тому що в кислому середовищі розчиняється хромат срібла, а в лужному утворюється бурий оксид срібла Ag2O, який заважає визначенню точки еквівалентності; в аміачному середовищі і хлорид і хромат срібла розчиняються з утворенням комплексного аміакату срібла.
Метод комплексонометрії Комплексонометрія – метод об’ємного аналізу, в основі якого лежить реакція утворення комплексної сполуки при взаємодії катіонів з комплексонами. В якості індикатора при титруванні комплексонами застосовують речовини (металіндикатори), які також дають комплексні сполуки з цими ж іонами металів, але менш стійкі та характерно забарвлені. Ми в своїй практиці цим методом визначаємо загальну жорсткість води, що зумовлюється в основному катіонами Сa2+ та Mg2+ у вигляді різних солей – хлоридів, сульфатів, карбонатів та інших. Для проведення багатьох технологічних процесів необхідна м’яка вода, а тому технологи повинні знати як, та вміти визначати жорсткість води. В останній час, для визначення загальної жорсткості стали використовувати комплексонометрію, так як цей метод досить чутливий, вимагає невеликих затрат часу та дає добрі результати. Для визначення загальної жорсткості води (яка складається з тимчасової та постійної), в якості стандартного розчину використовують розчин трилону Б, в якості індикатора еріохром чорний Т, ну, а в якості досліджуваного розчину – звичайна водопровідна вода. Реакція найкраще відбувається в лужному середовищі, при рН =10, тому таке середовище підтримується аміачним буферним розчином, який додають до води при її титрувані. Якщо умовно позначити еріохром чорний через Н2Э, а комплексон через Na2H2X, то процес можна відобразити схематично:
Синій синій
Синій червоний
[CaЭ] + Na2H2Х = Νa2[CaХ- ]+Э2+ + 2Н+ червоний безбарвний безбарвний синій
В точці еквівалентності відбувається перехід забарвлення з червоного в синьо-голубий. Шляхом титрування визначається об’єм стандартного розчину трилону Б, який пішов на взаємодію з певним об’ємом досліджуваної води і визначається загальна жорсткість досліджуваної води за формулою: Заг. ЖН2О =
В об’ємному аналізі використовуються для вимірювання об’ємів розчинів – бюретки (мірний посуд на 25 мл.), піпетки Мора (від 1 до 50 мл.), мірні колби (від 100 мл. до 1000 мл.) та мірні циліндри різних об’ємів. Стандартні розчини готують декількома способами: 1. Найпростіший і найточніший це із готових фіксаналів що являють собою скляні запаяні ампули, в яких міститься 1 г- екв. певної речовини. Якщо цю речовину перенести в мірну колбу на 1000 мл і долити дистильованою водою, то добре перемішавши одержимо 0,1 н. розчин даної речовини. 2. Другий спосіб – за точно розрахованою та відваженою на аналітичних терезах наважкою. Наважка розраховується за формулою маси в любому об’ємі
Сn – нормальна концентрація розчину; Екв. – еквівалент розчиненої речовини, V – об’єм, в якому розчиняється наважка. Наприклад: приготували 250 мл. 0,1 н. розчину NaOH
Дано:
M – молярна маса 40 г
m NaOH = Відважують 1 г NaOH переносять в мірну колбу на 250 мл., додають дистильовану воду і розчин готовий. Але не всі речовини можна приготувати таким способом і мати точну концентрацію, тому що деякі, як наприклад і NaOH адсорбують з повітря вуглекислий газ та водяні пари і утворюють на своїй поверхні карбонати. А деякі окислюють органічні рештки, що містяться навіть у дистильованій воді, і на протязі 8-10 діб зменшують свою концентрацію, наприклад розчин перманганату калію. Тому приготовані розчини відтитровують розчинами встановлюючи речовин, наприклад: щавелева кислота, розраховують точну концентрацію їх і використовують уже, як стандартні. До встановлюючи речовин ставляться певні вимоги: 1). речовина повинна бути хімічно чиста; 2). склад її повинен строго відповідати формулі; I.Організаційна частина. Стандартний 2. Титрований це одне і те саме Робочий Це розчини, концентрація (Сп) яких відома і як правило виражена нормальністю. HCl + NaOH = NaCl + H2O HCl – 1л. 1н. розчину містить 36,5г. NaOH – 1л. н. розчину містить – 40г. Коли об’еми рівні, то і нормальності однакові, а якщо об’еми різні, то і нормальності зворотно пропорціональні. За V і Сп одного розчину судимо про Сп другого розчину, який вступив з першимв реакцію.
Ця залежність між V та Сп реагуючихи речовин ввійшла в науку під назвою закону пропорціональності. Звідси: Сп досліджуваного Залежність міжV I Сп існує тільке для нормальної концентроції. Стандартні розчини готують двома способами: 1. Із фіксаналів; 2. по вірно розрахованій наважці, взятій на аналітичних терезах. Наприклад: потрібно приготувати 750 мл. 0,14 н. розчину щавелевої кислоти. Використовуемо формулу Як робиться? (метод) Титрування (метод нейтралізації). Наприклад: В об’ємному аналізі 3 учасники: 1.досліджуванний розчин; 2.стандартний розчин; Нейтралізації Осадження Комплексонометрії Перманганатометрії Йодометрії. Закріплення. 1. Чому концентрація стандартного розчину завжди виражена нормальністю? 2. Ви взяли 10 мл. досліджуваного розчину,відтитрували його 10 мл. стандартного розчину, що ви можете сказати про нормальність аналізуемого розчину? (концентрація однакова), а якщо 10 мл. досліджуваного розчину відтитрували 20 мл. стандартного?
Задачі: Ю.Н. Жванко та інші. стор. 94 приклад 1. стор. 95 контрольне запитання № 8,№ 7,№ 9 Задача: 6 г. NaOH розчинили в 1 л. розчину, яка нормальність одержаного розчину? Задача: 6 г. NaOH розчинили в 750 мл. розчину, визначте Сп? Задача: Розрахувати титр 0,05 н. HCl Сп HCl = 0.05
Запитання для самоконтролю
1. Що таке обємний аналіз? Які речовини належать до встановлюючих речовин, та яким вимогам вони повинні відповідати?
2. В якому агрегатному стані досліджуються речовини об’ємним аналізом
3. Які методи об’ємного аналізу ми вивчаємо?
4. Скільки учасників в об’ємному аналізі? Які?
5. |Які концентрації найчастіше використовуються в об’ємному аналізі?
6. Чим зумовлюються: а). нормальна концентрація; б). титр -?
7. Якими способами готуються стандартні розчини?
8. Як розрахувати наважку для приготування розчину заданої концентрації?
9. Як визначаються еквіваленти: а). кислоти; б). основи; в). солі; г).окислювача та відновника. Наведіть приклади.
10. В чому суть методу нейтралізації? Яка хімічна реакція лежить в основі цього методу?
11. Які індикатори використовують в методі нейтралізації?
12. Як розрахувати вміст кислоти або лугу в розчині?
13. Зробіть розрахунки для приготування 250,0 мл. 0,1розчину лугу NaOH. (Відповідь: наважка NaOH = 1 г).
14. Розрахуйте титр 0,1096 н. розчину НСI. (Відповідь ТНСI = 0,0040 г/мл.).
15. Скільки грамів щавелевої кислоти містилось в розчині об’ємом250,0мл. якщо на титрування 10,0 мл. його витрачено 12,50 мл. 0,15 н. розчину NaOH? (Відповідь: m щ. к. = 2,9531 г.)
16. Яка особливість методів оксидиметрії? Які це методи?
17. Як змінюється ступінь окислення мангану в перманганаті калію, якщо окислення розчином KMnO4 проводити в кислому, нейтральному та лужному середовищі?.
18. Чому не можна приготувати стандартний розчин KMnO4 прямо з розрахованої наважки.
19. Т KMnO4 = 0,005816 г/мл.. Знайти нормальність розчину для реакції, в якій перманганат перетворюється на MnSO4 (Відповідь:Cn KMnO4 = 0,1835н.)
20. Які реакції лежать в основі методу йодометрії?
21. На чому оснований метод осадження?
22. Що таке аргентометрія?
23. В чому сутність способу Мору?
24. Де та з якою метою ми використовуємо аргентометрію? 25. В якому середовищі необхідно визначити кількість NaCI?
26. Скільки грамів NaCI міститься в розчині об’ємом 500,0 мл., якщо на титрування 20,0 мл. його витрачається 25,0 мл. 0,05 н р-ну AgNO3? (Відповідь: m NaCI =1,8281).
27. На титрування розчину кухонної солі необхідно 30,20мл розчину AgNO3 (Т AgNO3=0,1245 г/мл.). Визначити масу хлориду натрію (NaCI) в даному розчині. (Відповідь: m NaCI = 1,2928 г.)
28. В чому суть методу комплексонометрії?
29. Яку сполуку в комплексонометрії позначають через ЕДТА?
30. Що ми визначаємо методом комплексонометрії?
31. Чим зумовлюється загальна жорсткість води? В яких одиницях вона вимірюється?
32. Чому дорівнює загальна жорсткість води, якщо на титрування 100,0 мл. її витрачено 25,20 мл. 0,1022 н розчину ЕДТА? (Відповідь: загальна жорсткість води дорівнює 25,7544 мг-екв./л.
Тести
1. На чому базується об’ємний метод аналізу? а). зважування на терезах; б). титрування; в). осадження.
2. Який спосіб вираження концентрації розчинів найчастіше використовується в об’ємному аналізі. а). % б). молярна в). нормальна
3. Який спосіб вираження концентрації розчинів використовується в об’ємному аналізі? а). %; б) титр; в). молярна;
4. Скільки учасників в об’ємному аналізі для,безбарвних розчинів? а). 4; б). 2; в). 3;
5. Скільки учасників в об’ємному аналізі для забарвлених розчинів? а). 4; б). 2; в). 3;
6. В якому методі об’ємного аналізу використовують два стандартних розчини – для визначення окислювачів, та визначення відновників? а). перманганатометрії; б). комплексонометрії; в). йодометрії
7. Чим визначається титр? Еріохром чорний Т.
12. Який індикатор використовується в методі комплексонометрії? Етиловий оранжевий Еріохром чорний Т. 3. 5% розчин К2СчО4; 13. Яким методом об’ємного аналізу визначається кількість кислоти в даному розчині? 1. осадження; 2. нейтралізації; 3. перманганатометрії;
14. Яким методом об’ємного аналізу визначається кількість NaCI в даному розчині? 1. комплексонометрії; 2. осадження; Нейтралізації.
15. В якому середовищі найкраще відбувається перманганатометрія? 1. нейтральному; 2. кислому; Лужному;. Фронтальний опит. Використана література Химия».
Викладач Таран В.І. Предмет: Аналітична хімія. Спеціальність 5.091711 «Технологія харчування» · Тематичний план. (I частина) · Пояснювальна записка. · Cписок літератури. · Назви лабораторних і практичних робіт. · Тематичний план (II частина). · Методи об’ємного аналізу. · Консультація на тему: «Об’ємний аналіз”. · Запитання для самоконтролю. · Тести. · Фронтальний опит. · Використана література. Тематичний план з предмету “Аналітична хімія” з спеціальності 5.091711 “Технологія харчування” денного відділення (1 частина)
Пояснювальна записка
Програмою предмету передбачено визначення кількісного аналізу хімічних сполук. Мета курсу – вивчення основних методів дослідження хімічного складу речовин, надбання вмінь та навичок проведення аналізів та виявлення змін в технологічних процесах обробки продуктів. Програма курсу “Аналітична хімія” складена відповідно з учбовими планами для спеціальності 5. 091711 “Технологія харчування”. Матеріал курсу слід пов’язати з дисциплінами “Товарознавство харчових продуктів”, “Фізична та коллоїдна хімія”, “Технологія приготування їжі” та іншими. Викладачі учбовий матеріал необхідно користуватись інформацією про нові досягнення науки, одноразово викладаючи застарівший матеріал. В процесі вивчення курсу необхідно сприяти формуванню у студентів інтересу до професії, свідомого відношення до своїх функцій майбутнього спеціаліста, елементарної грамотності в питаннях екології, інтересу до науково – технічного прогресу, вдосконалювати матеріалістичні погляди на хімічну природу речовин. Методика вивчення предмету базується на основі об’єднання теоретичного навчання з проведенням лабораторно – практичних робіт. Особливу увагу слід приділяти самостійній роботі студентів, яка повинна проводитися як поза аудиторією, так і на учбових заняттях. Це самостійна робота з учбовою та відповідною літературою, підготовка до семінарських занять та лабораторно-практичних робіт, підготовка рефератів.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 221; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.114.142 (0.416 с.) |
 2 8 13 2
2 8 13 2





 1S2 2S2 2Р6 3S2 3Р6 3d5 4Р6
1S2 2S2 2Р6 3S2 3Р6 3d5 4Р6











 ТKMnO4= 0,002980.
ТKMnO4= 0,002980.


 Н2Э 2Н+ + Э2-
Н2Э 2Н+ + Э2-
 Са2+ + Э2- [CaЭ]
Са2+ + Э2- [CaЭ]

 V NaOH = 250,0 мл.
V NaOH = 250,0 мл. 
 ;
;

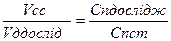 ;
;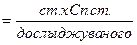 - це математичний вираз закону пропорціональності.
- це математичний вираз закону пропорціональності.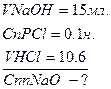

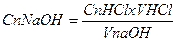 ;
;



