
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 4. Изучение кинетики реакции омыления уксусноэтилового эфира щелочью методом потенциометриии
Реакция окисления уксусноэтилового эфира протекает по уравнению
Данная реакция практически необратима, протекает с заметной скоростью и является реакцией второго порядка. В общем случае выражение для скорости этой реакции можно записать
Для определения частного порядка реакции по гидроксид-иону и константы скорости применяется "метод избытка реагента". При избытке эфира уравнение для константы скорости будет иметь вид
где
В данной работе концентрация щелочи определяется методом потенциометрии. В качестве индикаторного используется стеклянный электрод. Потенциал стеклянного электрода зависит от активности ионов водорода:
Активность ионов водорода связана с активностью гидроксид-ионов
где
где Таким образом, мы установили, что потенциал стеклянного электрода линейно зависит от концентрации гидроксид-ионов. Составим гальваническую цепь из стеклянного электрода и электрода сравнения, погруженных в исследуемый раствор. В работе в качестве электрода сравнения используется насыщенный хлоридсеребряный электрод (ХСЭ). Измеряемая ЭДС такой цепи будет равна
Из этого уравнения находим концентрацию гидроксид-ионов
и подставляем в уравнение (1)
где Константу скорости реакции вычисляем по уравнению
Для определения
Т.е. по тангенсу угла наклона прямой в координатах
Порядок выполнения работы
1. Налить в термостат 100 мл дистиллированной воды. Установить в него стаканчик с 50 мл раствора NaOH (С=0.01 моль/л) и магнитной мешалкой. Закрыть термостат крышкой. 2. Установить стеклянный, хлоридсеребряный электроды и термодатчик в соответствующие отверстия в крышке. Подсоединить электроды с помощью универсального кабеля к разъемам «3» и «
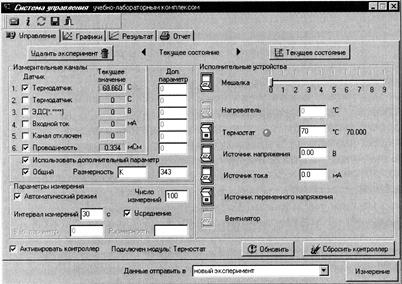
3. Включить контроллер, компьютер и запустить программу управления УЛК «Химия» - elsms2.exe. 4. В появившемся окне «Добро пожаловать в УЛК» необходимо выбрать вариант «Работа с контроллером» и нажать кнопку «Вход».
5. Для того чтобы в ходе работы проводить измерения температуры и ЭДС в окне «Управление» в группе элементов «Измерительные каналы» нужно поставить галочки напротив датчиков 1 и 3. При этом в столбце «Текущее значение» появятся текущие значения температуры (t1, 0С) и ЭДС (Е, В) составленного гальванического элемента.
6. Далее необходимо установить следующие «Параметры измерения»: число измерений (10), интервал измерений (60 секунд), включить автоматический режим и усреднение. 7. Для быстрого термостатирования ячейки необходимо обеспечить в ней интенсивное перемешивание. Для этого в группе элементов «Исполнительные устройства» установить скорость перемешивания (3) и нажатием на кнопку включить мешалку. 8. Когда температура ячейки установится необходимо отобрать пипеткой предварительно рассчитанный объем эфира (его концентрация в растворе должна составлять 0.1 моль/л), влить его в ячейку и одновременно включить секундомер. Через 20 секунд отключить мешалку и нажать кнопку «Измерение». С этого момента начинается отсчет времени опыта. 9. В окне «Обмен данными с контроллером» будет отображаться кривая изменения измеряемого параметра. Для выбора нужной зависимости необходимо выбрать соответствующий канал. 10. Измерения заканчиваются путем нажатия кнопки «Стоп». После этого экспериментальные данные передаются в программу. 11. Чтобы сохранить данные нужно перейти в окно «Результат» и нажать на значок «Добавить график». В специальном окне определяется соответствие между координатами графика и данными, полученными на измерительных каналах. Необходимо выбрать для оси Х «Время», а для оси У – «ЭДС» и нажать кнопку «Принять». Далее нажать на значок «Дискета», который расположен в правой части окна над таблицей с экспериментальными данными, и сохранить в соответствующую папку.
12. Для проведения опыта при другой температуре (t2=t1+10 0C) необходимо перейти в окно «Управление» и нажать кнопку «Текущее состояние». В пункте «Исполнительные устройства» включить «Термостат» и установить требуемую температуру. Далее действовать согласно вышеприведенной инструкции.
Экспериментальные и расчетные данные оформить в виде таблицы 4, предваряя ее следующими данными.
Реакционная смесь: концентрация раствора щелочи моль∙л-1 концентрация раствора эфира моль∙л-1
Таблица 4. Измерение ЭДС во времени и расчет константы скорости омыления сложного эфира.
Определить константы скорости реакции графическим методом по тангенсам углов наклона прямых на графиках Вычислить энергию активации реакции.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 676; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.84.32 (0.025 с.) |


 ,
,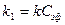 , и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет
, и кинетика этой реакции будет подчиняться кинетике реакции первого порядка, а выражение для константы скорости будет (1)
(1) (2)
(2)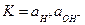 (3)
(3) - ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2):
- ионное произведение воды, величина постоянная при заданной температуре. Из уравнения (3) находим концентрацию ионов водорода и подставляем в (2): ,
, ;
; 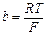


 (4),
(4), - разность потенциалов в момент времени t от начала опыта, а
- разность потенциалов в момент времени t от начала опыта, а  - в начальный момент времени.
- в начальный момент времени.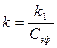 (5)
(5)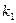 графическим методом уравнение (4) запишем в виде
графическим методом уравнение (4) запишем в виде
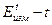 можно оценить
можно оценить  , а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению
, а затем по уравнению (5) найти константу скорости реакции. Зная константы скорости при двух температурах Т1 и Т2 можно вычислить энергию активации Еа по уравнению (6)
(6) », а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
», а термодатчик к разъему «1». Оставшееся отверстие в крышке закрыть пробкой.
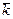 =
= 


